胃癌肿瘤突变负荷相关差异基因的研究*
安覃景 刘 丽 李晓松
首都医科大学石景山教学医院 北京市石景山医院检验科,北京市 100043
胃癌是世界上最常见的肿瘤之一,目前其主要的治疗方法是手术切除和放化疗,现有的治疗方法对正常组织和细胞都有较大的损伤且治愈率较低[1],因此对于胃癌患者来说,选择合适的治疗方法显得更为重要。而免疫治疗目前已成为一种新兴的治疗方法,其对患者影响小,治愈率较高。免疫治疗的主要方式是激发患者自身免疫系统对肿瘤的杀伤和清除作用,从而起到治疗作用。胃癌的肿瘤突变负荷(Tumor Mutation Burden, TMB)是影响免疫治疗的关键因素之一,其反映了基因的突变密度,其与免疫反应之间存在一定的相关性,TMB越高,其突变的细胞越多,免疫系统越容易发现,则免疫治疗效果越好[2]。以往的研究对胃癌的TMB进行分析,仅发现了高 TMB 的患者生存及预后较好,但未明确找到影响TMB高低的Hub关键基因,从而不能为治疗方式的选择提供帮助。因此本研究以胃癌TMB为研究对象,筛选出影响胃癌肿瘤突变负荷高低的Hub关键基因,旨在为其靶向免疫治疗提供参考。
1 对象与方法
1.1 研究对象 本研究的所有TMB数据和临床数据均来自癌症和肿瘤基因图谱(The Cancer Genome Atlas,TCGA)数据库。共纳入 441 例病例,本研究完全符合TCGA提供的发表指南。
1.2 高低TMB差异基因分析 使用 R 软件中的“limma”包对高低肿瘤突变负荷进行差异基因分析。根据 TMB 中值确定高和低 TMB 组,大于中值为高TMB组,小于中值为低TMB组。这项研究的截止值是|log2foldChange|>1.0 且调整后的P<0.05。
1.3 基因本体富集分析及KEGG信号转导通路分析 使用R软件(3.6.0版)中的“clusterProfiler”包对获得的差异基因进行基因本体富集分析和KEGG信号转导通路分析。截止值调整为P<0.05。
1.4 TMB与生存的关系 本研究使用 R 软件的“survival”包(版本 3.6.0)对高低 TMB 样本进行生存分析。当P<0.05 时,差异具有统计学意义。
1.5 统计学方法 本研究所有数据分析均使用R 3.6.0软件进行统计学分析,所使用的数据P<0.05表示差异具有统计学意义。
2 结果
2.1 人口特征 该研究共纳入 32 个正常样本和 375 个肿瘤样本,总共来自 441 例病例。
2.2 差异分析基因 根据TMB值对mRNAs表达数据进行分组,对TMB高低组进行差异基因分析,根据筛选条件发现了491个差异基因。
2.3 GO富集分析和KEGG信号转导通路分析 对mRNAs表达数据的高、低TMB组的差异基因进行GO富集分析,发现它们主要集中在3个途径:生物过程(Biological Process,BP)、细胞成分(Cellular Component,CC)和分子功能(Molecular Function,MF),具体结果见图1。同时,对KEGG信号转导通路进行了分析,见图2。最后,还进行了PPI分析,发现7个Hub基因为MYH11、TAC1、ALB、AOX1、DMD、FGFR1、IGF1,见图3。
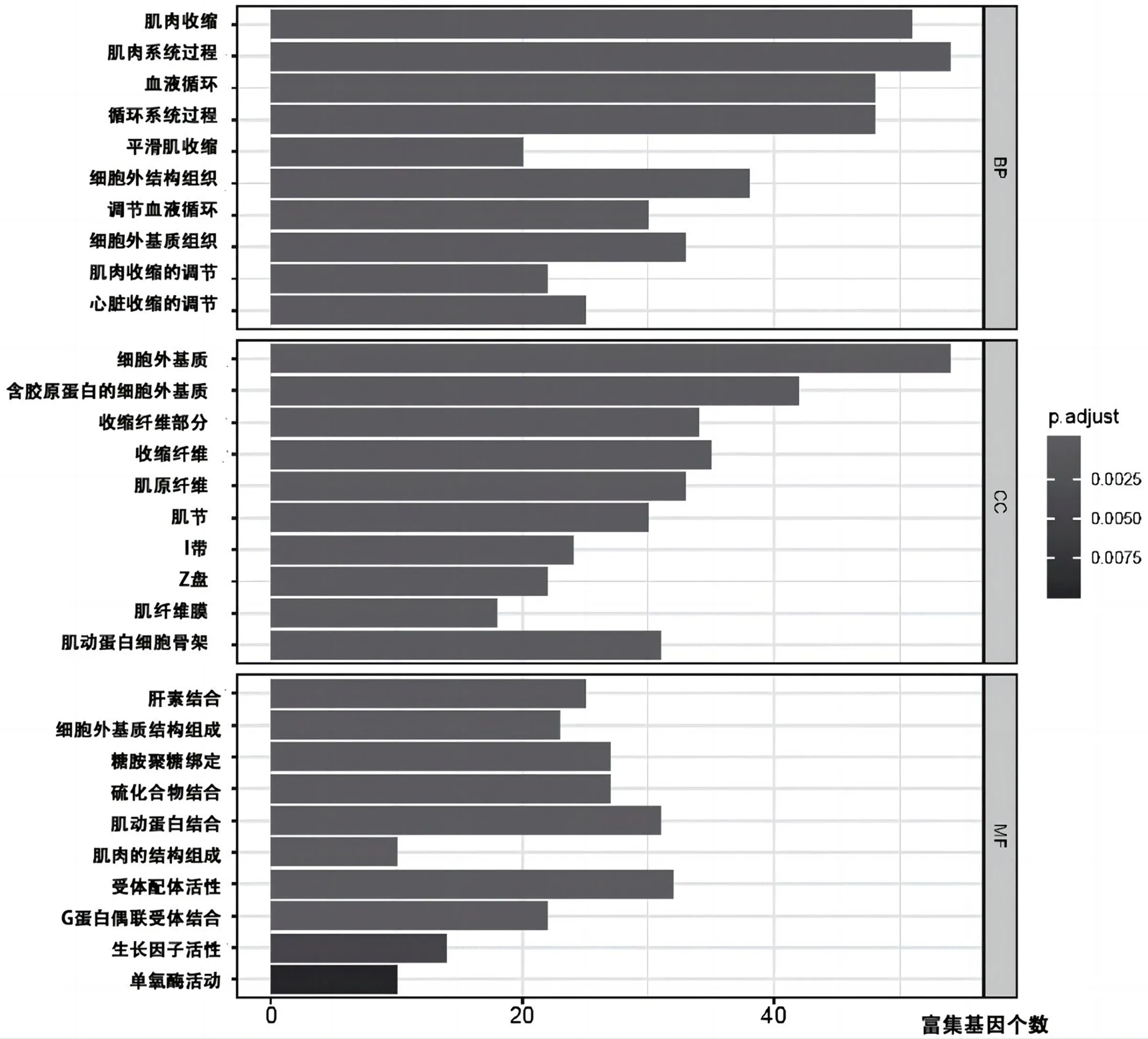
图1 GO富集分析
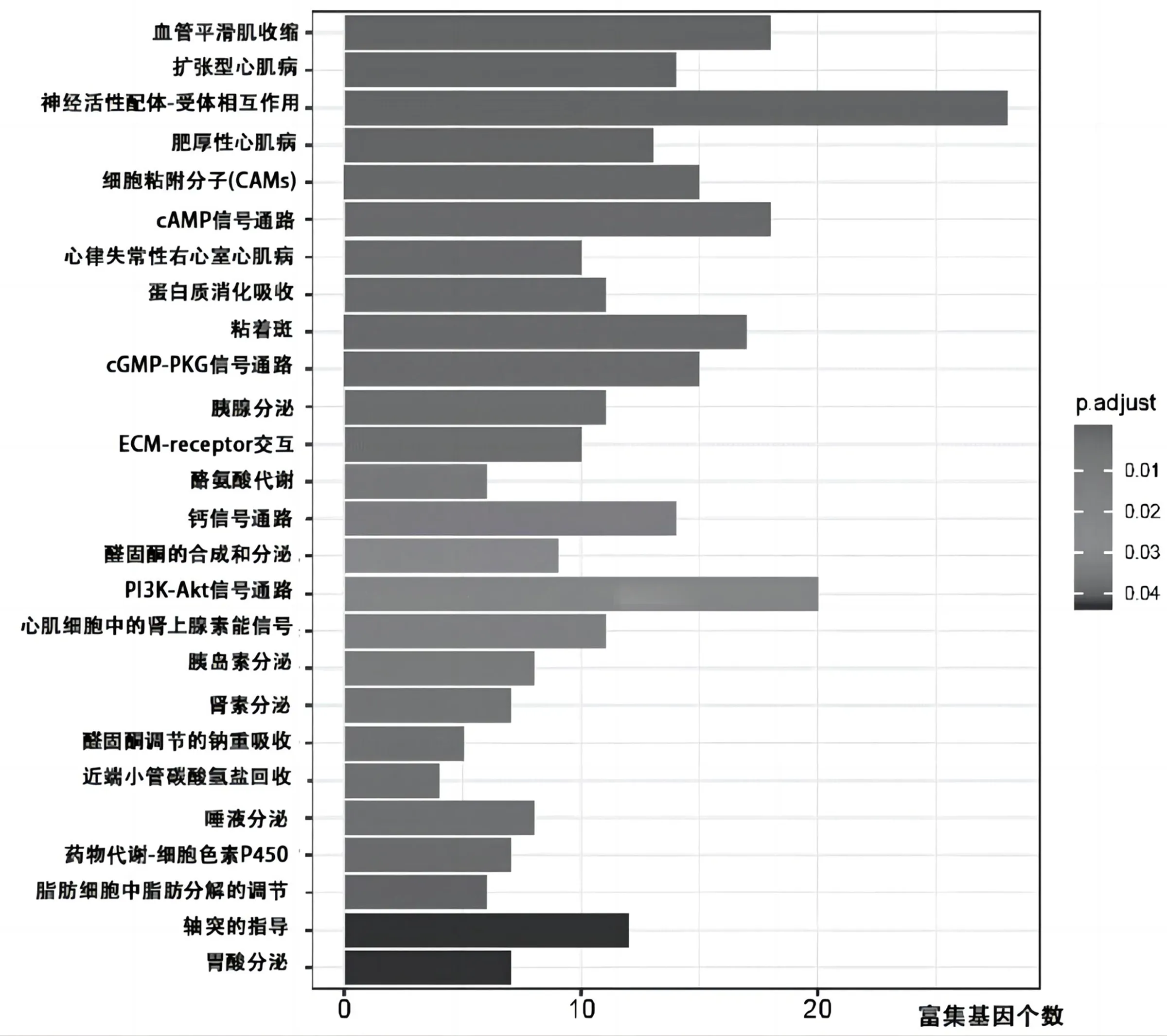
图2 KEGG信号转导通路分析
2.4 生存分析 对高、低TMB组进行的生存分析显示,高TMB组的5年生存率显著高于低TMB组(P=0.007)。 其中,高TMB组为41.8%,低TMB组为28.3%,见图4。
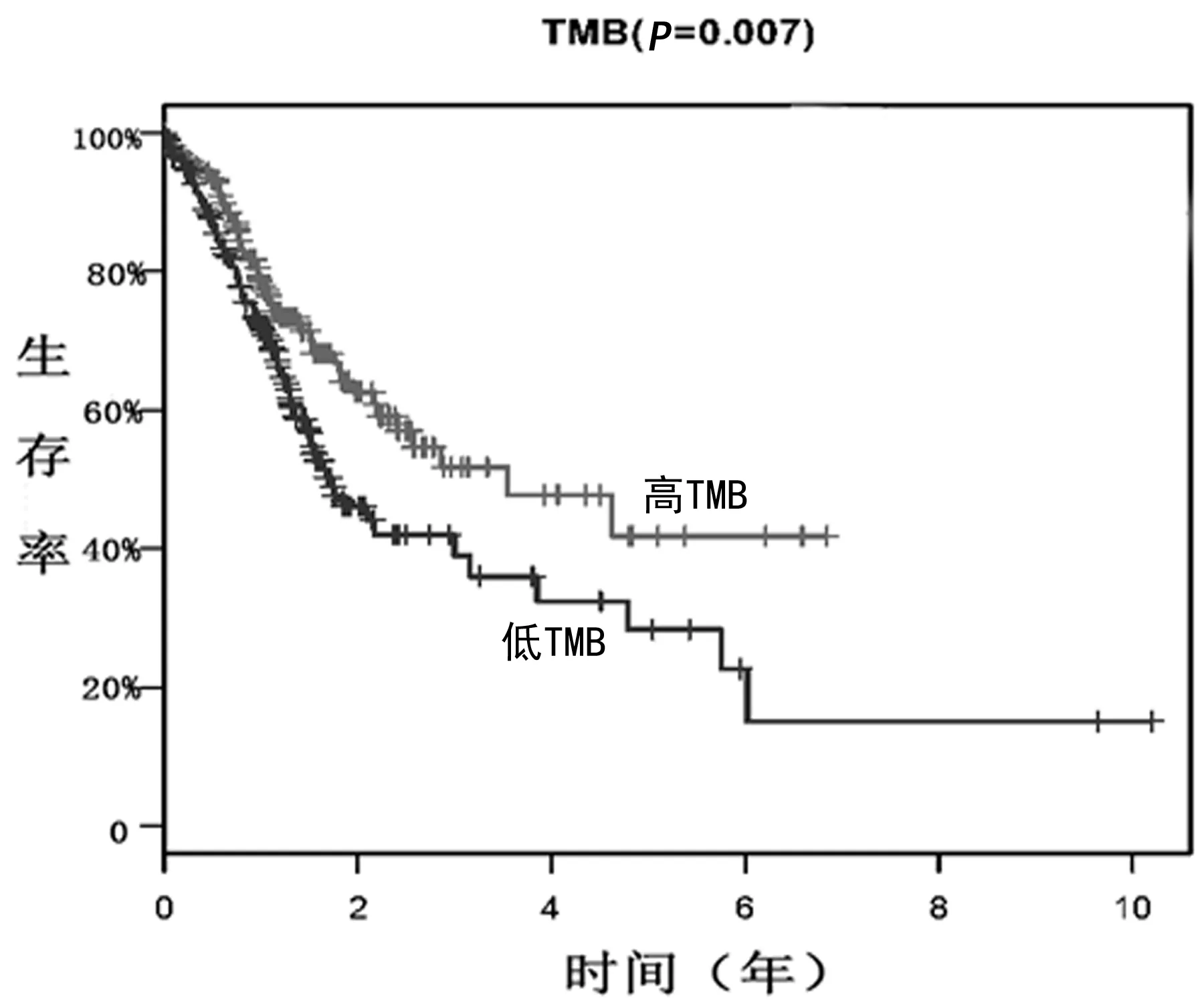
图4 生存分析
3 讨论
胃癌是全世界较为常见的消化道肿瘤之一,也是亚洲国家每年癌症相关死亡的主要原因,在中国大多数患者被诊断时多已发展为晚期疾病,生存率低且预后较差[3]。TMB是反映机体对免疫反应的大小的一项指标,体细胞突变的积累是肿瘤发生的主要原因之一,并有助于新抗原的表达,新抗原通过识别肿瘤细胞上的靶抗原,激活T细胞发挥抗肿瘤作用,其不仅可以影响肿瘤的发生、进展和治疗耐药性,而且还能促进免疫检查点阻断剂疗法的反应预测。然而目前与其相关的关键基因尚未明确,因此本研究对胃癌TMB进行分析,以期找到相关差异基因,从而为胃癌的治疗提供新思路。
本研究中GO富集分析主要集中在肌肉收缩、细胞外基质和肝素结合等,而KEGG信号转导通路分析发现涉及的通路包括血管平滑肌收缩、扩张型心肌病等,这与以往的研究结果一致[4-5]。
在本研究中,发现了高低负荷组之间的差异表达基因中的最为关键的7个Hub基因是MYH11、TAC1、ALB、DMD、FGFR1、IGF1和AOX1。
肌球蛋白重链11(Myosin Heavy Chain 11,MYH11)基因产物是一个六聚体蛋白的亚基,由两个重链亚基和两对不相同的轻链亚基组成。Wang J等[6]的研究表明MYH11通过结合TNFRSF14启动子抑制TNFRSF14的表达,而TNFRSF14可逆转MYH11对胃癌细胞恶性表型的抑制作用。He F等[7]进行了胃癌的WGCNA分析,发现了与衰老分子表型相关的关键基因(ACTA2、CALD1、LMOD1、MYH11、MYL9、MYLK和TAGLN),这些基因在肿瘤中特异性上调,与预后不良相关。在本研究中,MYH11在低突变负荷中高表达,从而不被免疫细胞识别,导致预后不良,这与之前的结果一致。速激肽1(Tachykinin-1,TAC1)通过选择性剪接、转录编码神经肽物质P、神经激肽A、神经肽K和γ,主要参与胃分泌、运动、黏膜免疫和细胞增殖。David S等[8]采用实时荧光定量PCR方法发现了胃癌患者中TAC1甲基化更为普遍 (P<0.01)。另外,还有研究表明TAC1启动子高甲基化在食管癌中较为常见,发生较早,与食管腺癌发生的其他进展危险因素相关,是ESCC预后不良的组织生物标志物[9]。在本研究中,TAC1在低突变负荷中高表达,不易被免疫细胞识别,因此更易导致患者预后不良。白蛋白(Albumin,ALB)是反映机体营养状况的一项很重要的指标。Alkurt EG等的研究表明较高的术前CRP/ALB的比值可以预测局部晚期胃癌患者的不良预后[10]。在本研究中,ALB在高突变负荷中高表达,更容易被免疫细胞识别,患者预后较好。
DMD是一个具有 79 个外显子的大基因,可编码肌肉必需的抗肌萎缩蛋白,这是一种突变会导致肌肉紊乱的基因。在骨骼肌外,DMD最主要和普遍存在的基因产物是Dp71,其中至少有14个剪接亚型已被鉴定。Tan S等[11]的研究表明104例胃癌患者中,72.2%的患者Dp71表达被抑制,而Dp71表达降低与肿瘤分化程度(P=0.001)和淋巴管侵犯程度(P= 0.041)显著相关。在本研究中,DMD在胃癌的低突变负荷中高表达,这可能会使癌细胞迁徙、侵袭和增殖变快,从而导致患者预后较差,这与之前的结果一致。成纤维细胞生长因子受体(Fibroblast Growth Factor Receptor,FGFR)家族由FGFR1、FGFR2、FGFR3、FGFR4 4个成员组成,它们通过与成纤维细胞生长因子(FGFs)相互作用激活,导致下游信号通路的激活,其中FGFR1属于酪氨酸受体激酶,具有多种生物学功能,如增殖、生存、迁移和分化等。另外还有研究表明,FGFR1基因的下调可抑制胃癌细胞的恶性表型,其高表达与腹腔灌洗细胞学和同步的腹膜播散阳性以及预后不良显著相关[12]。在本研究中,其在胃癌的低突变负荷中高表达,胃癌细胞增殖侵袭变快,患者预后较差。
胰岛素样生长因子1 (Insulin-like Growth Factor 1,IGF1)是肌肉和骨骼发育所必需的,也是生长激素作用的主要介质。Li H等[13]的研究表明IGF1通过GSK-3β和ZEB2诱导BGC-823胃癌细胞系上皮细胞向间质细胞转化,从而参与肿瘤的转移。在本研究中其在低突变负荷中高表达,使癌细胞更易转移扩散,患者预后较差。
醛氧化酶1(Aldehyde Oxidase 1,AOX1)是一种具有广泛底物的氧化酶,包括多种芳香氮杂环和醛。此外,它还参与药物前体的生物活化、氧平衡的调节、一氧化氮的产生和脂肪的形成。Narci K等[14]发现AOX1和AGER作为PI3K/Akt/mTOR通路的靶点参与了这种联合增殖作用,siRNA敲除AOX1和AGER后,肝细胞癌的细胞增殖明显降低。但目前尚无AOX1在胃癌方面的研究,本文发现AOX1在胃癌的低突变负荷中高表达,其不易被免疫细胞识别,更易进行细胞侵袭、增殖,导致患者预后较差。
综上所述,本研究通过对TCGA数据库中的胃癌数据进行肿瘤突变负荷的相关差异基因分析,筛选出了7个Hub关键基因,其中首次发现AOX1基因可能在胃癌的进展中发挥着重要作用,针对关键基因选择靶向治疗,可能会产生更好的效果,这为胃癌的免疫治疗提供了新思路。

