缺氧缺血性脑病新生儿血清高迁移率族蛋白1水平与炎症因子、新生儿行为神经测定评分关系及其对预后的预测价值
耿淑霞
(邢台市人民医院新生儿科,河北 邢台 054000)
新生儿缺氧缺血性脑病(Hypoxic-ischemic encephalopathy,HIE)为临床常见疾病,通常是在围产期因缺血缺氧所致的一种脑部损伤疾病[1]。随病情进展,新生儿可出现神经系统后遗症,如脑性瘫痪、智力低下、癫痫等,严重者危及生命安全,故临床将其视为新生儿期后病残儿中最为常见病因[2]。尽管该病具有较高的残疾率和病死率,但具有可控性,即早期诊断、早期治疗有利于控制病情发展和改善预后。文献[3]报道,高迁移率族蛋白1(High mobility group box-1,HMGB1)在HIE患者中呈异常表达。研究[4]指出,HMGB1可能会受HIE炎症水平及新生儿行为神经测定(Neonatal behavioral neurological assessment,NBNA)评分影响。故动态监测HMGB1水平可为判断HIE病情进展及预后提供参考。本研究选取86例HIE患儿为研究对象,探讨HIE患儿血清HMGB1水平与炎症因子、NBNA评分的关系及其对预后的预测价值。
1 资料与方法
1.1 一般资料 选取2020年5月至2022年5月于本院接受治疗的HIE患儿86例为观察组,并根据患儿出生后28 d是否存活分为死亡组(22例)和存活组(64例)。死亡组中,男性12例,女性10例;胎龄37~42周,平均(39.26±2.52)周;平均出生体重(3241.45±102.52)g;存活组中,男性33例,女性31例;胎龄38~41周,平均(39.35±2.47)周;平均出生体重(3242.05±101.96)g。病例纳入标准:符合《新生儿缺氧缺血性脑病诊断标准》[5]中关于HIE的诊断标准;出生体重2500~4000 g;出生时脐动脉血气分析pH≤7.0;胎心<100次/min,持续时间>5 min;患儿家属均已了解研究内容,并在知情同意书上签字。排除标准:电解质紊乱、颅内出血、宫内感染或先天性疾病引起的脑损伤;患有严重肝、肾功能不全;患有先天性心脏病。选取同期健康新生儿172例为对照组,其中男性86例,女性86例;胎龄38~42周,平均(39.34±2.47)周;平均出生体重(3241.65±102.48)g。三组一般资料比较差异无统计学意义(均P>0.05)。
1.2 HMGB1及炎症因子检测 所有新生儿均在出生后3 d内采集股静脉血5 ml,2500 r/min离心10 min,取上清液,采用酶联免疫吸附(ELISA)法测定血清HMGB1及炎症因子[白细胞介素-6(IL-6)和肿瘤坏死因子-α(TNF-α)]水平,试剂盒(货号:CSB-E08223h、CSB-E04638h、CSB-E04740h)均购自武汉华美生物公司。
1.3 NBNA评分[6]于新生儿出生后3 d内由同一位医师在安静、半暗、温暖的环境下进行测评,评估内容包括行为能力(6项)、被动肌张力(4项)、主动肌张力(4项)、原始反应(3项)、一般评估(3项),总分40分,35分以下表示存在脑损伤。
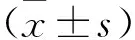
2 结 果
2.1 观察组与对照组HMGB1、炎症因子、NBNA评分比较 见表1。观察组血清HMGB1、IL-6、TNF-α水平高于对照组,NBNA评分低于对照组(均P<0.05)。

表1 观察组与对照组HMGB1、炎症因子、NBNA评分比较
2.2 死亡组与存活组HMGB1、炎症因子、NBNA评分比较 见表2。死亡组血清HMGB1、IL-6、TNF-α水平高于存活组,NBNA评分低于存活组(均P<0.05)。

表2 死亡组与存活组HMGB1、炎症因子、NBNA评分比较
2.3 不同HMGB1水平患儿炎症因子和NBNA评分比较 见表3。以HMGB1表达中位数17.90 ng/ml为截点将86例患儿分为HMGB1高水平组与低水平组,每组43例。HMGB1高水平组血清IL-6、TNF-α高于HMGB1低水平组,NBNA评分低于HMGB1低水平组(均P<0.05)。
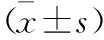
表3 不同HMGB1水平患儿炎症因子、NBNA评分比较
2.4 HMGB1与IL-6、TNF-α、NBNA评分相关性分析 Pearson相关性分析显示,HMGB1与IL-6、TNF-α呈正相关(r=0.551、0.506,均P<0.05),与NBNA评分呈负相关(r=-0.572,P<0.05)。
2.5 HMGB1、IL-6、TNF-α水平及NBNA评分对HIE患儿预后的预测价值 见表4。ROC曲线分析显示,HMGB1、IL-6、TNF-α水平及NBNA评分对HIE患儿出生后28 d死亡均有一定的预测价值。
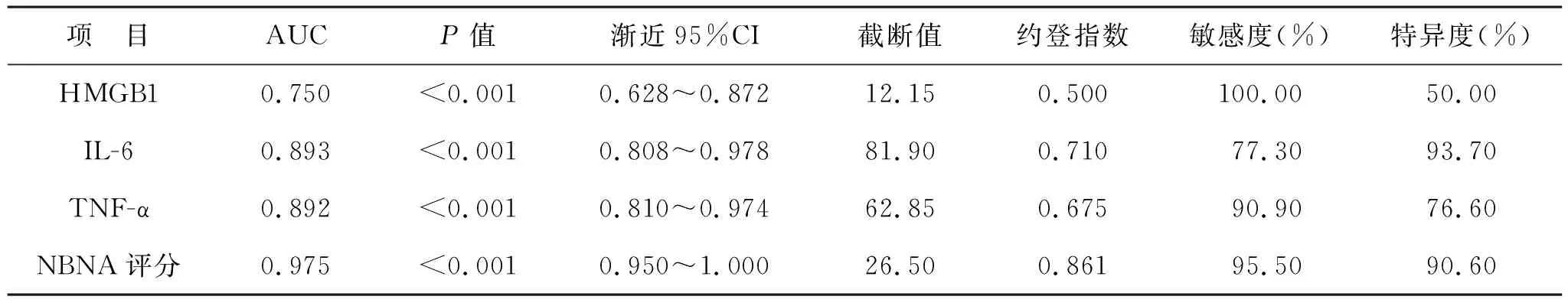
表4 HMGB1、IL-6、TNF-α水平及NBNA评分对HIE患儿预后的预测价值
3 讨 论
经流行病学调查[7]显示,HIE发病率在新生儿中约0.2%~0.4%,随病情发展患儿可逐渐出现智力低下、脑瘫、神经发育迟缓等严重后遗症,甚至死亡。据临床统计[8],HIE病死率达10.00%~60.00%。因此,尽早诊断并及时予以治疗是控制病情发展和改善预后的关键。
HMGB1是存在于血管内皮细胞的促炎症细胞因子,具有调整基因转录、稳固胞核结构及介导炎症反应等作用[9-10]。HMGB1能通过与多种细胞因子、血管黏附分子、促炎症细胞趋化因子等发挥相互作用,参与HIE的发生,同时缺血-再灌注损伤也会促使HMGB1表达显著升高[11]。在HIE发病过程中,脑组织缺血、缺氧的刺激可能促使HMGB1主动或被动释放至细胞外,并通过诱导单核/巨噬细胞、中性粒细胞等合成并分泌IL-6、TNF-α等炎症介质,而这些炎症介质的释放又能进一步促进HMGB1分泌,形成恶性循环,从而促进HIE发展[12-13]。另外,脑组织的缺血、缺氧极易引起血管内皮细胞损伤甚至死亡,进而降低内皮细胞的储备能力,并促使血管内皮裂缝增大及通透性增加,引发局部脑组织炎症反应[14-15]。在本研究中,观察组患儿血清HMGB1水平显著高于对照组,表明HMGB1参与了HIE的发生与发展。但关于其是否与炎症细胞因子相互影响尚无定论。本研究为了进一步论证两者之间的关系,进行了Pearson相关性分析,结果显示血清HMGB1与IL-6、TNF-α水平呈正相关,提示HMGB1可能是通过与IL-6、TNF-α等炎症细胞因子的相互作用参与HIE发病过程。
NBNA评分为临床评估新生儿神经系统及反映脑损伤的常用方法[16]。在本研究中,观察组患儿NBNA评分高于对照组,说明HIE患儿存在神经行为损害。本研究相关性分析发现,NBNA评分与血清HMGB1表达呈负相关,HIE患儿的NBNA评分会随着HMGB1表达的增加而降低,可能原因是HMGB1通过介导脂质过氧化反应和促进炎症反应参与脑缺血缺氧后神经损害过程[17-18]。同时,在不同HMGB1水平患儿的NBNA评分比较中可见,HMGB1高水平组患儿NBNA评分显著低于HMGB1低水平组,而血清IL-6、TNF-α水平高于HMGB1低水平组,进一步相关性分析也表明血清HMGB1水平与炎症因子IL-6、TNF-α水平呈正相关,提示血清HMGB1水平越高,HIE患儿的炎症反应、神经损害越严重,不利于患儿预后[19-20]。
为了进一步论证上述指标水平对HIE患儿预后的影响,本研究对比了死亡组与存活组患儿血清HMGB1、IL-6、TNF-α水平及NBNA评分变化,结果显示死亡组患儿血清HMGB1、IL-6、TNF-α水平高于存活组,而NBNA评分低于存活组。表明HIE患儿血清HMGB1、炎症因子水平会随病情进展而上升,而NBNA评分会随着病情进展而下降,故临床应提高警惕,通过监测其水平变化及时评估患儿预后。为了验证上述指标对HIE患儿预后的预测价值,本研究将其纳入ROC曲线分析模型中,结果显示血清HMGB1、IL-6、TNF-α水平和NBNA评分对HIE患儿28 d死亡均有一定的预测价值,提示动态监测上述指标对HIE患儿预后的评估效能较高,可作为评估HIE患儿预后的重要参考指标。
综上所述,HIE患儿血清HMGB1水平与IL-6、TNF-α、NBNA评分具有相关性,其水平变化可作为预测HIE患儿预后的参考指标。

