高产磷脂酶D 的蜡样芽孢杆菌诱变筛选及发酵条件优化
王天一 刘 欢 王 芳 邓 利
(北京化工大学生命科学与技术学院, 北京 100029)
引 言
磷脂酶D(phospholipase D,PLD,EC 3.1.4.4.)属于磷酸二酯酶超家族成员,可作用于甘油磷脂类物质中的磷酰氧键(P—O)。 PLD 具有水解活性和转酯酰基活性,前者可以催化甘油磷脂类物质生成磷脂酸和羟基化合物,后者可以催化磷脂酰胆碱(PC)与各类羟基化合物反应,产生稀有磷脂(如磷脂酰丝氨酸)[1]。 因此,PLD 在食品保健品[2-3]、医药[4]等领域具有重要的应用价值。
PLD 广泛存在于动物[5]、植物[6]及微生物[7]中,其主要生理功能是参与细胞脂质代谢、信号转导和细胞膜生成[8]。 微生物来源的PLD 具有较好的转酯酰基能力和较广泛的底物专一性[9],目前已经有多种产PLD 的微生物被分离出来,如链霉菌[10]、棒状杆菌[11]、沙门氏菌[12]、假单胞菌[13]和蜡样芽孢杆菌[14]等。 其中,链霉菌属PLD 的转酯活性尤为突出[15],但其生长缓慢,生产周期较长(约为3 ~7 d)。而蜡样芽孢杆菌的产酶速度快,抗逆性强,可利用多种底物,是一种新型的PLD 生产菌株,并且其生长速度快,生产周期短(约48 h),具有较大的生产潜力。 代书玲等[16]首次从香油作坊的土壤中筛选出一株产PLD 的蜡样芽孢杆菌,经条件优化,培养8 h后该菌株的产酶量达到4.21 U/mL。 徐银凤[17]从土壤中筛选出一株以蛋黄为唯一碳源的蜡样芽孢杆菌(Bacillussp.P1),培养3 d 后PLD 的酶活性达到0.43 U/mL。 Zhao 等[14]研究了蜡样芽孢杆菌ZY12的产酶性质,发现只有在特定物质诱导且无单糖存在的情况下,该菌株才能产生PLD。
目前,蜡样芽孢杆菌的PLD 产量与链霉菌还有一定差距,产酶条件尚有待进一步优化。 本研究以野生蜡样芽孢杆菌(Bacillus cereusCICC 20551)为出发菌株,采用紫外线和硫酸二乙酯复合诱变的方法对其进行诱变,筛选出一株高产PLD 的蜡样芽孢杆菌,并对其诱导产酶条件进行了优化。
1 实验部分
1.1 实验材料
1.1.1 菌株
蜡样芽胞杆菌(B.cereusCICC 20551),购自中国工业微生物菌种保藏管理中心,生物危害程度为四类,属于通常情况下不会引起人类或动物疾病的微生物。
1.1.2 试剂
胆碱氧化酶(12 U/mg)、过氧化物酶(250 U/mg),美国Sigma 公司;卵磷脂(PC 含量>60%),上海生工生物工程股份有限公司;卵磷脂(PC 含量>10%)、卵磷脂(PC 含量>90%),上海源叶生物科技有限公司;甘油磷酰胆碱(GPC)(纯度98%),上海阿拉丁生化科技股份有限公司;蛋黄卵磷脂(PC含量>98%)、卵磷脂(PC 含量>95%)、蛋黄粉(试剂级),北京索莱宝科技有限公司;硫酸二乙酯(DES)、蛋白胨、酪蛋白胨、鱼蛋白胨、酵母浸粉、牛肉膏、尿素、硫酸铵、葡萄糖、果糖、蔗糖、乳糖、可溶性淀粉、微晶纤维素、木糖、木聚糖,均为试剂级,北京化工厂。
1.1.3 培养基
LB 培养基 蛋白胨10 g/L,酵母浸粉10 g/L,NaCl 5 g/L。
蛋黄分离培养基 NaCl 3 g/L,CaCl21 g/L,MgSO4·7H2O 0.5 g/L,蛋黄10 g/L,琼脂15 g/L。
菌种复筛培养基 NaCl 3 g/L,CaCl21 g/L,MgSO4·7H2O 0.5 g/L,蛋黄50 g/L。
发酵基础培养基 葡萄糖10 g/L,蛋白胨10 g/L,牛肉膏1 g/L,NaCl 3 g/L,CaCl21 g/L,MgSO4·7H2O 0.5 g/L。
1.2 实验仪器
UV759 型紫外可见分光光度计,聚创科技有限公司;HWS-80 型电热恒温培养箱,上海豫明仪器有限公司;TJZH 型超净工作台,北京天宇有限公司;Multiskan FC 型酶标仪,赛默飞世尔科技公司;HZQX100 型恒温振荡培养箱,苏州培英实验设备有限公司;TGL-16 型高速台式离心机,上海医用分析仪器厂。
1.3 实验方法
1.3.1 蛋黄液的制备
将完整鸡蛋浸泡于75%乙醇中15 min,在超净台中取出后吹干,分离蛋黄,用镊子将卵黄膜挑去,将蛋黄液置于无菌的50 mL 离心管中备用。 用于配制培养基时,灭菌后待培养基冷却至50 ℃以下,加入制备的蛋黄液,振荡混匀,备用。
1.3.2 蜡样芽孢杆菌的培养与发酵
挑取单菌落于4 mL LB 培养基中进行种子培养,在37 ℃下培养8 h 后,将对数期的种子液以2%的接种量接入到含50 mL 菌种复筛培养基的250 mL 三角瓶中,于37 ℃、200 r/min 下振荡培养72 h,每6 h 取样,将样品于13 000 r/min 离心5 min后取上清作为粗酶液,测定PLD 酶活性。
1.3.3 PLD 酶活性测定
采用酶联比色法检测PLD 活性。 向Tris-HCl缓冲液(0.02 mol/L,pH=7.2)中加入1% Triton X-100 和0.1 mol/L CaCl2制成底物缓冲液,溶解7 g/L的蛋黄卵磷脂(PC 含量>98%)制成底物溶液。 向1 mol/L 的Tris-HCl 缓冲液中加入0.1 mol/L EDTA,调节pH =8 制成反应终止液,向Tris-HCl 缓冲液(0.1 mol/L,pH=8)中加入0.15%苯酚和0.125%4-氨基安替比林制成显色液。 取400 μL 底物缓冲液和100 μL 底物溶液,加入10 μL 稀释后的粗酶液,于37 ℃反应10 min,立即加入200 μL 反应终止液并煮沸5 min,冷却后加入100 μL 显色液、10 μL胆碱氧化酶溶液(25 U/mL)和5 μL 过氧化物酶溶液(10 U/mL),反应3 h 后,于25 ℃在505 nm 波长处使用酶标仪测定吸光度,按照下式计算PLD 的酶活性。
式中:A为PLD 的酶活性,U/mL;ρ为氯化胆碱的质量浓度,mg/mL,根据标准曲线计算得到;M为氯化胆碱的摩尔质量,g/mol;t为发酵时间,min;N为样品的稀释倍数。
酶活性定义:在上述条件下,以蛋黄卵磷脂(PC含量>98%)为底物,每分钟释放1 μmol 胆碱的PLD 的量为1 个酶活单位(U)。
使用0.2 ~1.0 mg/mL 的氯化胆碱溶液代替粗酶液,在上述条件下反应并测定吸光度,绘制标准曲线,如图1 所示。 结果表明,在本实验的浓度范围内,氯化胆碱的质量浓度与吸光度之间的线性关系良好。
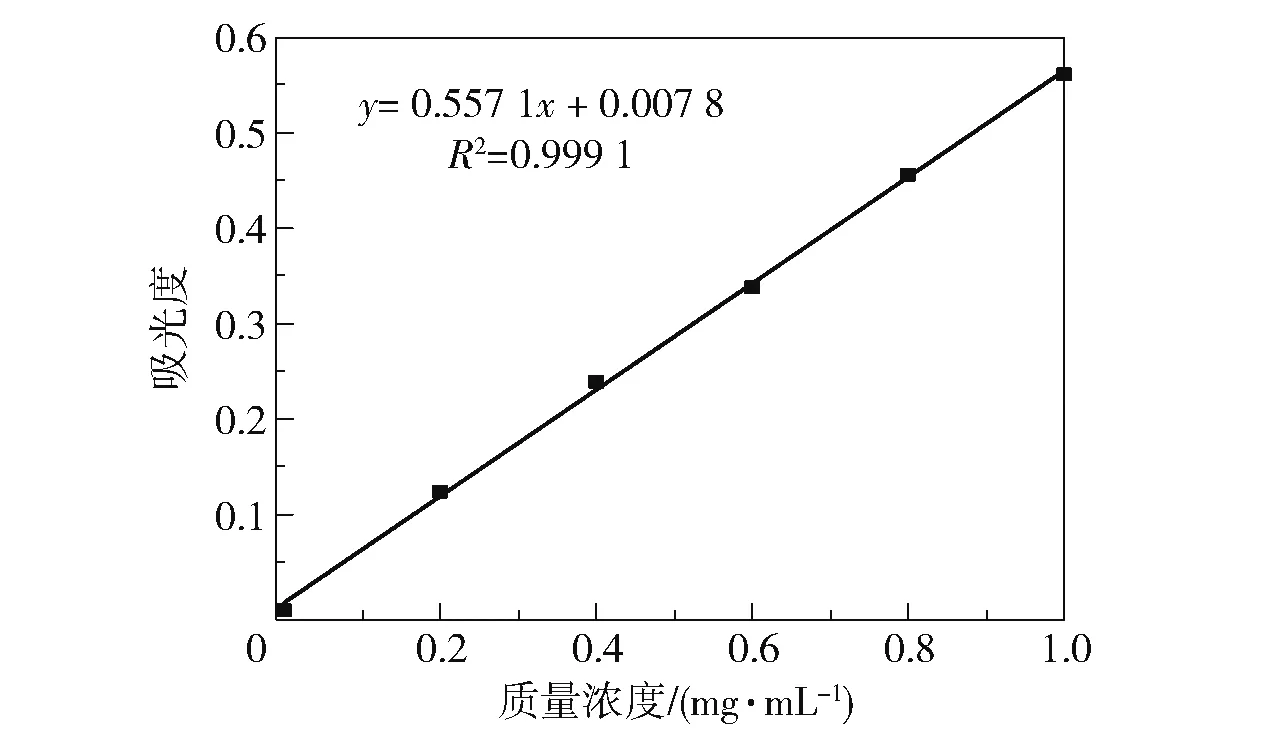
图1 氯化胆碱的标准曲线Fig.1 Standard curve of choline chloride
1.3.4 菌种的诱变
采用紫外线及硫酸二乙酯复合诱变的方法对出发菌B.cereusCICC 20551 进行诱变。 首先,采用紫外线对出发菌株进行诱变处理。 紫外灯预热30 min,取对数生长期的菌液稀释后涂布于含有蛋黄分离培养基的平板中,在距离紫外灯40 cm 处分别垂直照射0、5、10、15、20、25、30、35 s 后,立即关闭紫外灯,避光培养12 h。 以紫外线照射后的平板为实验组,未经照射的平板为对照组,根据实验组与对照组菌落数的比值,计算不同紫外线照射时间下的细菌致死率,以确定最适的诱变时间。 若菌落产生PLD,则可以水解培养基中的蛋黄形成透明圈[17],将具有透明圈的菌落挑取至含有2 mL 菌种复筛培养基的48 孔板中,在37 ℃、200 r/min 下培养48 h,于13 000 r/min 离心5 min 后取上清作为粗酶液,使用本文建立的高效筛选方法测定PLD 活性,以筛选出产酶效果较好的突变菌。
以紫外线诱变筛选后的最优突变体为出发菌,于4 mL LB 培养基中在37 ℃下培养至对数生长期,取一定量的菌体,用0.1 mol/L 的磷酸缓冲液(pH=7.0)稀释至103cfu/mL,在含有4 mL 菌液的试管中,加入80 μL DES 的乙醇溶液(DES 与乙醇的体积比为1∶1),在37 ℃摇床中分别处理10、20、30、40、50、60 min 后,立即加入200 μL 25%硫代硫酸钠溶液,振荡2 min,取100 μL 涂布于蛋黄分离培养基平板中,于37 ℃培养14 ~16 h,计算致死率,以确定最适的诱变时间。 计算最适诱变时间下透明圈直径与菌落直径的比值,挑取比值较大的菌落至含有2 mL菌种复筛培养基的48 孔板中,在37 ℃、200 r/min下培养48 h,于13 000 r/min 离心5 min 后取上清作为粗酶液,使用本文建立的高效筛选方法测定PLD活性。
1.3.5 PLD 酶活性高效筛选方法的建立
在产磷脂酶菌株的筛选方式上,通常采用蛋黄分离平板与硼砂蛋黄牛津杯法相结合的方式[18]。首先,利用菌株产生的PLD 酶在蛋黄分离培养基中产生透明圈的现象,筛除不能产酶的菌株。 然后,利用透明圈直径比较各菌落的产酶效率。 考虑到透明圈直径通常受菌落形状、菌体生长速度等因素的影响较大,因此将筛选的菌落进行培养,取发酵液置于含有硼砂蛋黄固体培养基的牛津杯中,使固体培养基产生形状规则的透明圈,进而根据透明圈大小初步筛选出产酶能力较强的菌株。 使用该方法进行了大量的菌落筛选,但效果不明显,分析其原因主要有两点:(1)发酵液中酶活性与细胞中酶浓度有直接关系,而透明圈大小只能反映发酵液中的酶活性,无法兼顾细胞的生长情况;(2)由于磷脂酶A、C 和D都可以水解磷脂产生透明圈,因此透明圈直径与PLD 活性的相关性较差。 此外,传统的筛选方法还存在实验流程繁琐、筛选通量及效率不高等问题。
为了解决以上问题,本文在酶联比色法的基础上,建立了PLD 酶活性的高效筛选方法。 PLD 水解磷脂酰胆碱产生游离的胆碱,胆碱经胆碱氧化酶氧化后产生H2O2,再经Trinder 反应生成红色醌亚胺化合物,该物质在505 nm 波长下有最大吸光度[19]。当体系中胆碱氧化酶过量时,胆碱一经产生就立即显色,在一定时间内吸光度与PLD 酶活性呈正相关,根据这一原理,本文建立了高效的PLD 酶活性筛选方法。 相比酶联比色法,该方法省去了加反应终止液、煮沸后加显色剂等步骤,且通量大,可在96孔板内直接反应,经酶标仪扫描后可直观地定性比较不同菌株的产酶能力(图2)。
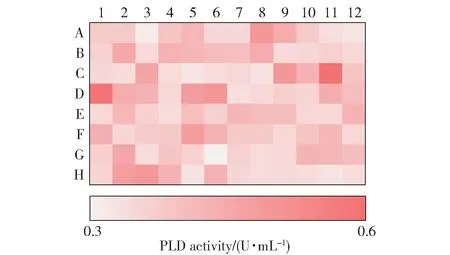
图2 96 孔板的酶活热力图Fig.2 Thermogram of enzyme activity on a 96-well plate
按照表1 的反应体系将各溶液加入96 孔板,立即置于37 ℃的环境中5 min,使用酶标仪在25 ℃、505 nm 波长下检测吸光度,根据吸光度大小筛选出产酶效果较好的突变菌,然后按照式(1)计算其PLD 活性,从而筛选出酶活性最高的突变菌株。

表1 PLD 酶活性高效筛选的反应体系Table 1 Reaction system for efficient screening of PLD enzyme activity
1.3.6 发酵条件优化
为了提高PLD 产量,对筛选出的产酶效果较好的突变菌的发酵条件进行优化。 使用发酵基础培养基,保持其他条件不变,通过单因素实验对诱导产酶时600 nm 波长下的光密度(OD600)、诱导物的种类及添加量、氮源和碳源的种类和添加量进行考察。在37 ℃、200 r/min 的条件下培养48 h,于13 000 r/min离心5 min 后取上清作为粗酶液,使用酶联比色法测定PLD 酶活性。
2 结果与讨论
2.1 蜡样芽胞杆菌的产PLD 性能
对出发菌B.cereusCICC 20551 的产PLD 性能进行了测定,结果如图3 所示。 可以看出,在发酵6 h 后菌株的PLD 活性迅速上升,54 h 时酶活性达到最大(0.32 U/mL)。 继续延长发酵时间,酶活性缓慢下降。 出发菌株的最大产酶量远低于文献报道的结果(3.2 U/mL)[16],表明该菌株的产酶能力较弱,后续需要对其进行诱变筛选以提高菌株的PLD活性。
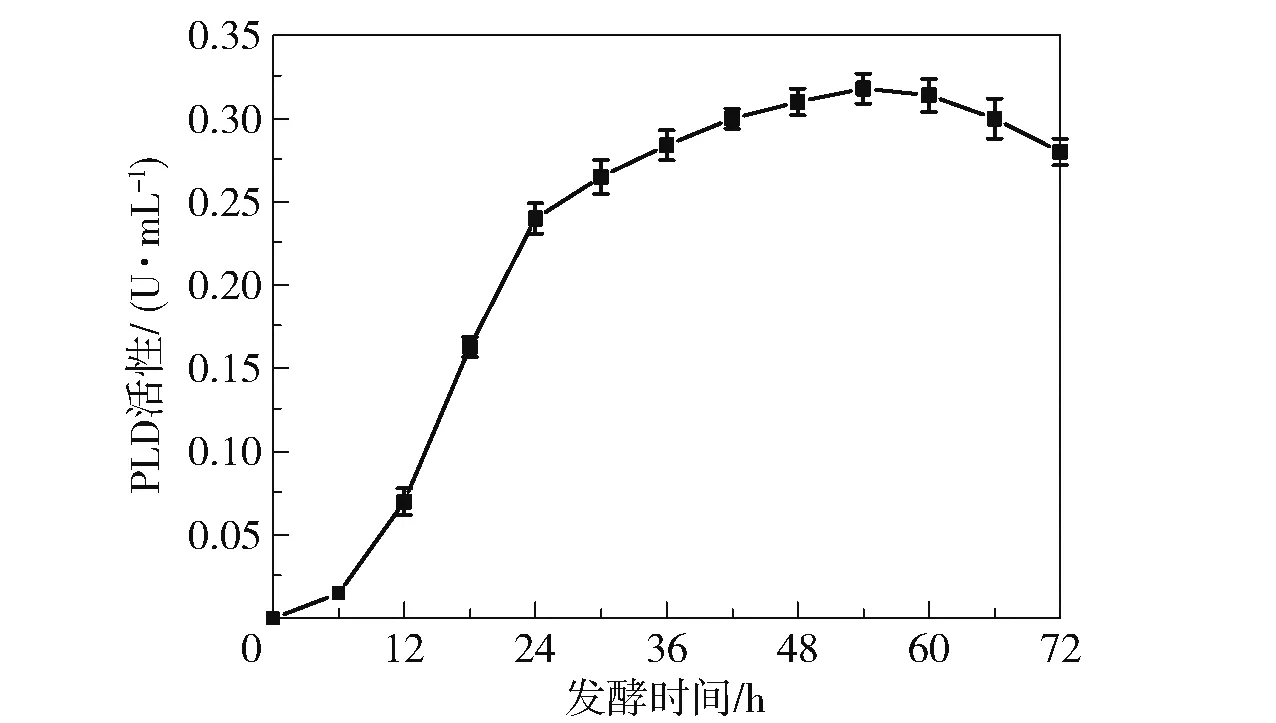
图3 出发菌B.cereus CICC 20551 的PLD 酶活性随发酵时间的变化Fig.3 Changes of PLD enzyme activity of B.cereus CICC 20551 with fermentation time
2.2 紫外线和硫酸二乙酯的最适诱变时间
对野生菌进行诱变处理是获得高产性能的常见手段,紫外线诱变和硫酸二乙酯诱变是常用的诱变方法。 当采用单一诱变手段时,菌株对诱变条件易产生耐受性,导致诱变效果不佳,而复合诱变将两种诱变方法先后使用,具有协同效应,相比单一诱变方法更有优势[20]。 因此,本研究采取紫外线诱变与硫酸二乙酯诱变相结合的方法,即物理诱变与化学诱变相结合的复合诱变方法对蜡样芽胞杆菌进行诱变处理。
为了确定紫外线的最佳照射时间,将紫外线以固定的距离垂直照射涂布蜡样芽孢杆菌的蛋黄分离平板,考察照射时间与细菌致死率的关系,结果如图4(a)所示。 可以看出,蜡样芽孢杆菌的致死率随着照射时间的增加而增大,在20 s 时致死率达到83%,35 s 时致死率达到100%。 考虑到80%左右的致死率通常位于菌株产生较多正突变的区间,本文选择20 s 作为紫外诱变筛选的照射时长。 为了确定硫酸二乙酯DES 的最佳处理时间,使用DES 对菌液处理不同时间,计算细菌致死率,结果如图4(b)所示。可以看出,致死率随着DES 处理时间的增加而增大,在30 min 时致死率达到79.8%,在60 min 时致死率接近100%,本文选取30 min 作为DES 诱变处理的时间。
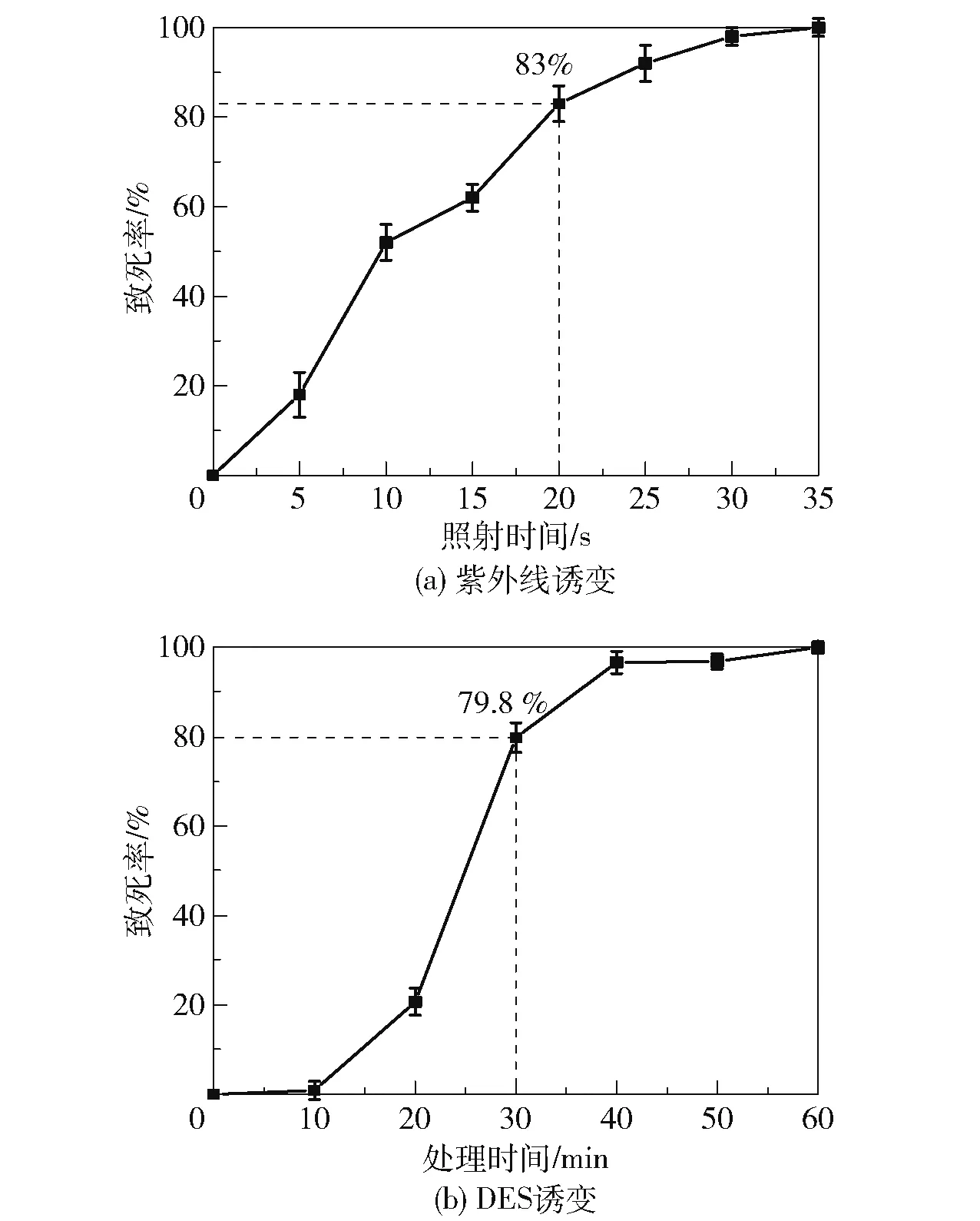
图4 不同诱变方法下B.cereus 的致死率随处理时间的变化Fig.4 Change of death rate of B.cereus with treatment time under different mutagenesis methods
2.3 蜡样芽孢杆菌的诱变筛选结果
采用本文建立的PLD 酶活性高效筛选方法,对紫外线诱变后的菌落进行筛选,共得到约50 批、2 400 个菌落,从中筛选出一株PLD 酶活性提升较大的突变株:S6-U6,其PLD 酶活性达到0.45 U/mL,较出发菌株提高了40.6%,部分突变菌株的筛选结果如表2 所示。 以突变株S6-U6 为出发菌株,进行了DES 复合诱变,共筛选出约10 批、480 个菌落,经过多批次筛选,得到一株高产PLD 的突变株:S6-UD46,其PLD 酶活性达到0.52 U/mL,较突变株S6-U6 提高了约15.6%,部分突变菌株的筛选结果如表3 所示。
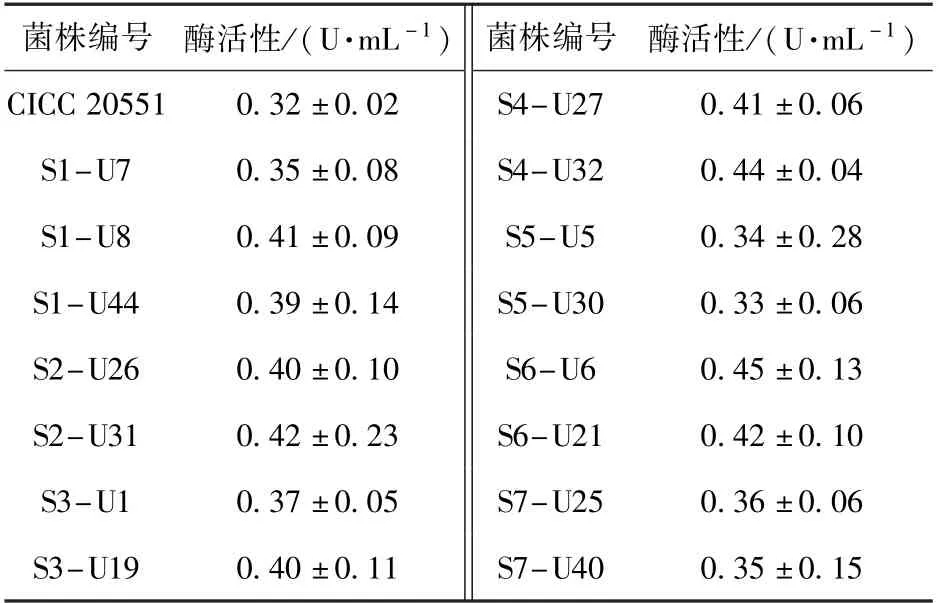
表2 紫外线诱变后部分菌株的酶活性Table 2 Enzyme activities of some strains after ultraviolet mutagenesis
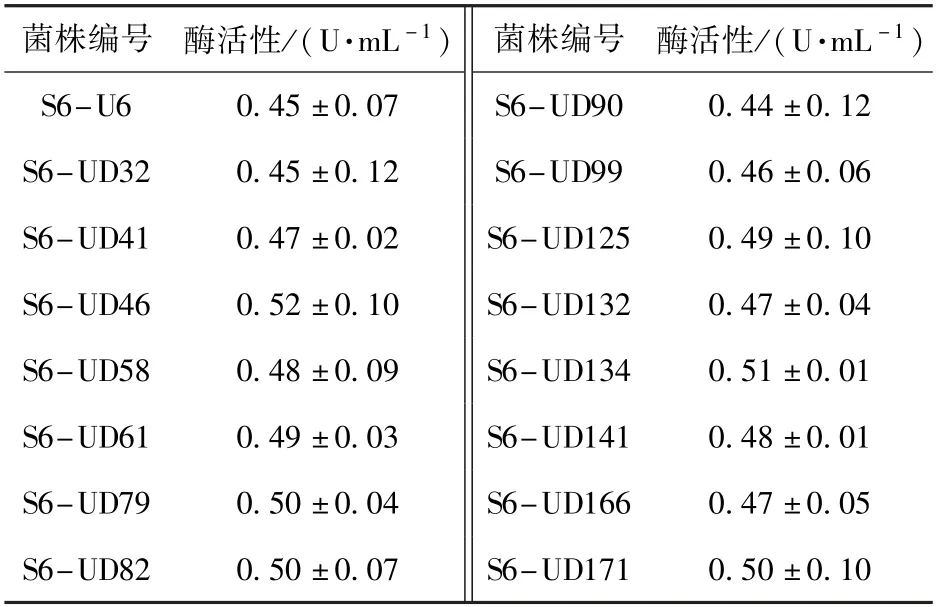
表3 DES 诱变后部分菌株的酶活性Table 3 Enzyme activities of some strains after DES mutagenesis
将原始菌株B.cereusCICC 20551 和突变菌株S6-UD46 在菌种复筛培养基中的发酵情况进行对比,结果如图5 所示。 可以看出,突变菌株S6-UD46 在培养48 h 时产酶量达到最大(0.52 U/mL),相比原始菌株(0.32 U/mL)提高了62.5%,并且突变菌株产酶量达到最大的时间(48 h)比原始菌株(54 h)提前了6 h。 为了考察突变菌株S6-UD46 的传代稳定性,取原代菌株第48 h 的发酵液,以2%的接种量转接至新的发酵基础培养基中,取第48 h 的发酵液样品,测定其PLD 活性,每48 h 转接1 次,分析转接10 代后酶活的变化,结果如图6 所示。 可以看出,该突变菌株经过10 代的传代后产酶能力没有明显变化,每一代的产酶能力都较为稳定,PLD 酶活性仅在0.50 ~0.54 U/mL 的区间内小幅波动,表明该突变菌株的产酶能力较为稳定。
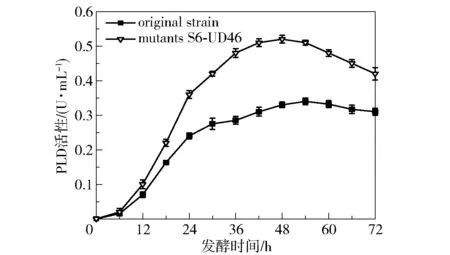
图5 突变菌株S6-UD46 与出发菌株的PLD 活性曲线对比Fig.5 Comparison of PLD activity curves between the mutant strain S6-UD46 and the original strain
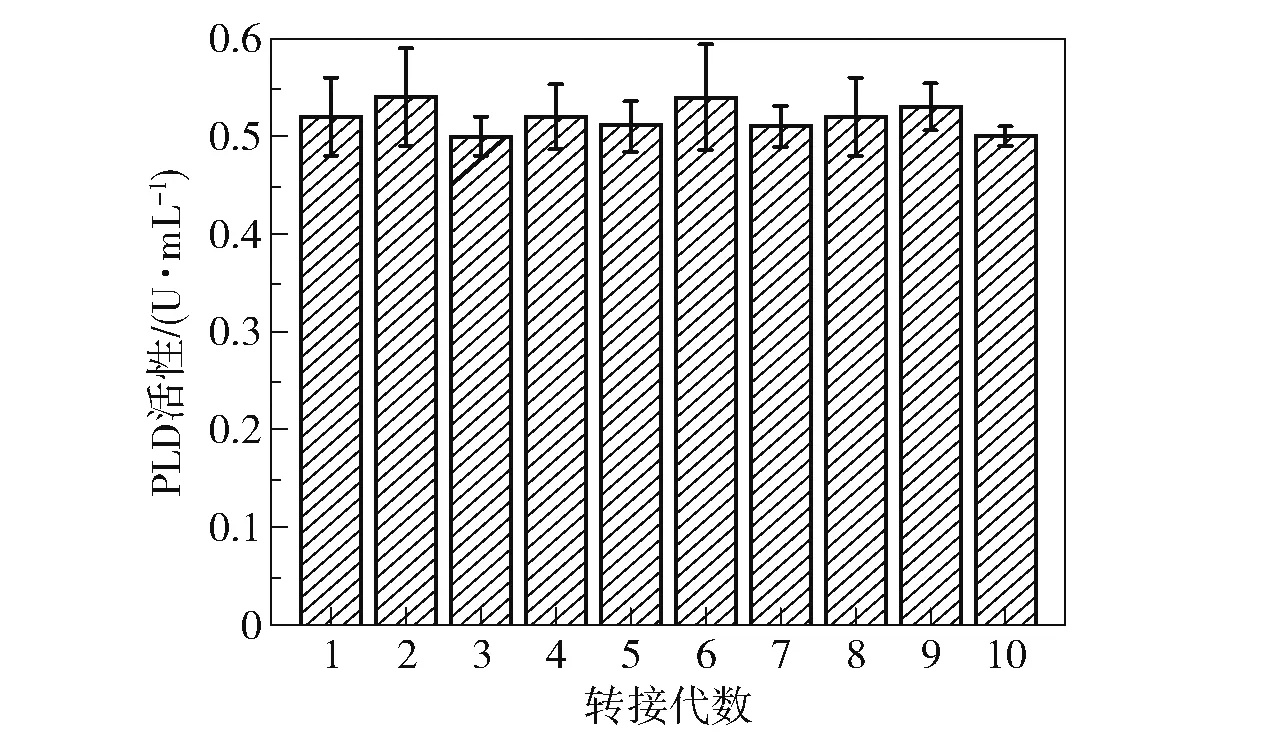
图6 突变菌株S6-UD46 的传代稳定性Fig.6 Generation stability of the mutant strain S6-UD46
2.4 突变菌株S6-UD46 的发酵条件优化结果
2.4.1 OD600
有研究表明,蜡样芽孢杆菌ZY12 产PLD 需要磷脂类物质的诱导[14]。 本课题组在实验中也发现,所筛选出的突变株S6-UD46 在含有磷脂类物质的培养基中才能检测到较高的PLD 活性,即该菌的产酶机制为诱导产酶。 通常菌株的生长与产酶并不是完全耦合的,对于需要诱导产酶的菌株,过早加入诱导剂可能会加重菌株的代谢负担,导致生物量下降;而过晚加入诱导物质,培养基中营养物质即将消耗完全,导致菌株的生长代谢趋于停滞,不利于产酶。
为了确定突变菌株S6-UD46 诱导产酶的最佳时机,通过测定菌液OD600,选取对数生长期的前、中、后3 个时期,分别在发酵基础培养基中加入50 g/L 蛋黄液诱导产酶,使用酶联比色法测定发酵48 h 时不同OD600下的PLD 酶活性,结果如图7 所示。 可以看出,随着加入蛋黄诱导时菌体量的增大,PLD 酶活性出现先增大后减小的趋势,在OD600为4时加入蛋黄,PLD 酶活性达到最大。

图7 在不同OD600下加入50 g/L 蛋黄对PLD 活性的影响Fig.7 Effect of adding 50 g/L yolk at different OD600 on PLD activity
2.4.2 诱导物种类及添加量
不同诱导物对菌株产酶的影响有所不同,将含磷脂的不同诱导物以50 g/L 的添加量加入发酵基础培养基中诱导突变菌株S6-UD46 产酶,并测定PLD 活性,结果如图8 所示。 可以看出,除蛋黄粉外,其余含磷脂的物质都对菌株产酶产生了一定的诱导作用,其中卵磷酯(PC 含量>90%)的诱导产酶效果最好,PLD 酶活性可达2.6 U/mL。 值得注意的是,甘油磷酸胆碱GPC 也获得了较好的诱导效果,GPC 具有磷酸二酯键和胆碱基团,但其不属于传统磷脂(甘油磷脂)物质,这可能表明蜡样芽孢杆菌来源的PLD 具有较广泛的底物特异性。 GPC 溶于水的性质使其比磷脂类的乳浊液更适合后续酶的分离纯化,值得进一步研究。 而添加蛋黄粉几乎未测得酶活,可能是在蛋黄粉的加工过程中破坏了磷脂结构,使其失去了诱导产酶能力。
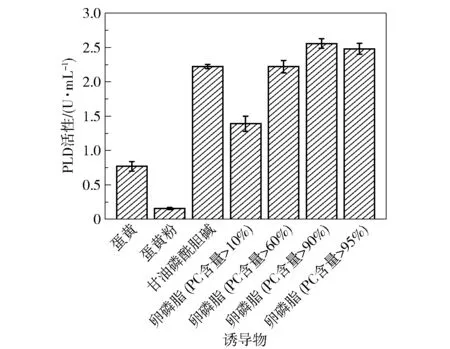
图8 诱导物种类对PLD 活性的影响Fig.8 Effects of different inducers on PLD activity
诱导物的添加量对细胞生长及产酶同样有重要影响。 根据上述结果,选择的最佳诱导物为卵磷脂(PC 含量>90%),为了探究卵磷脂的最适添加量,在发酵基础培养基中分别加入10 ~80 g/L 的卵磷脂(PC 含量>90%),培养48 h 后比较菌株的产酶效果,结果如图9 所示。 可以看出,在添加量为10 g/L 时卵磷脂就得到了较好的诱导效果,随着添加量的增加,PLD 活性逐渐增大,在卵磷脂添加量为40 g/L 时PLD 活性达到最大(2.8 U/mL)。 当添加量超过50 g/L 后,PLD 活性急剧下降,在发酵液中出现了结块现象,这可能是由于培养基过于黏稠,影响了菌体的生长。
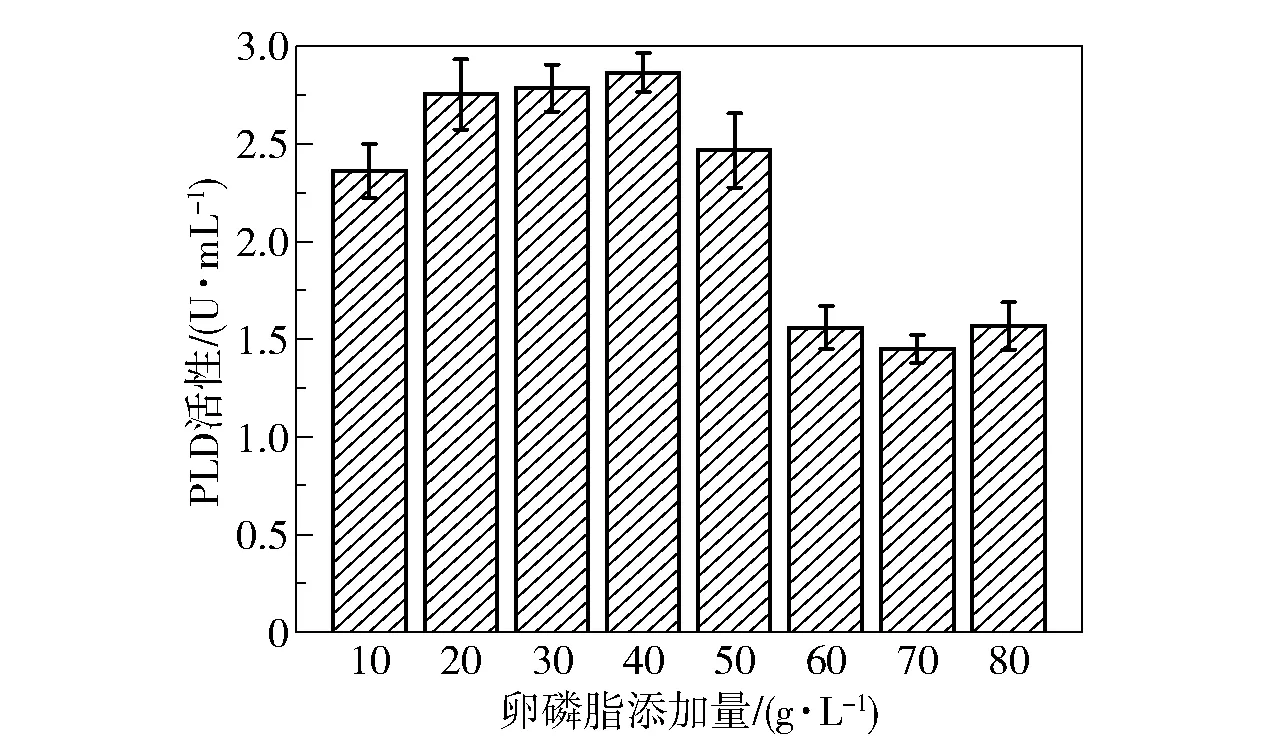
图9 卵磷脂(PC 含量>90%)添加量对PLD 活性的影响Fig.9 Effect of addition amount of lecithin (PC content >90%) on PLD activity
2.4.3 氮源种类及添加量
氮源提供微生物生长所需的最基本营养因子,是菌体合成蛋白质所必需的原料。 在诱导产酶时40 g/L 的卵磷酯(PC 含量>90%)既作为诱导物质又作为氮源,这极大提升了PLD 的酶活性。 蜡样芽孢杆菌可以利用多种氮源,为了筛选出产PLD 的最适氮源,在添加卵磷脂的基础上,本研究比较了5 种有机氮源(蛋白胨、酪蛋白胨、鱼蛋白胨、酵母浸粉和牛肉膏)和2 种无机氮源(尿素和硫酸铵)的产酶效果。 将发酵基础培养基中的氮源(蛋白胨和牛肉膏)分别替换为10 g/L 上述氮源,测定菌株培养48 h 时的PLD 酶活性,结果如图10 所示。 可以看出,在使用牛肉膏作为氮源时,PLD 的酶活性最高,达到2.9 U/mL。 牛肉膏含有多种氨基酸、无机盐、糖以及含氮的肌肉提取物,可以满足蜡样芽孢杆菌生长和产酶的需求。 而无机氮源未能取得很好的产酶效果,这可能是由于无机氮源中缺乏必要的辅因子和氨基酸。
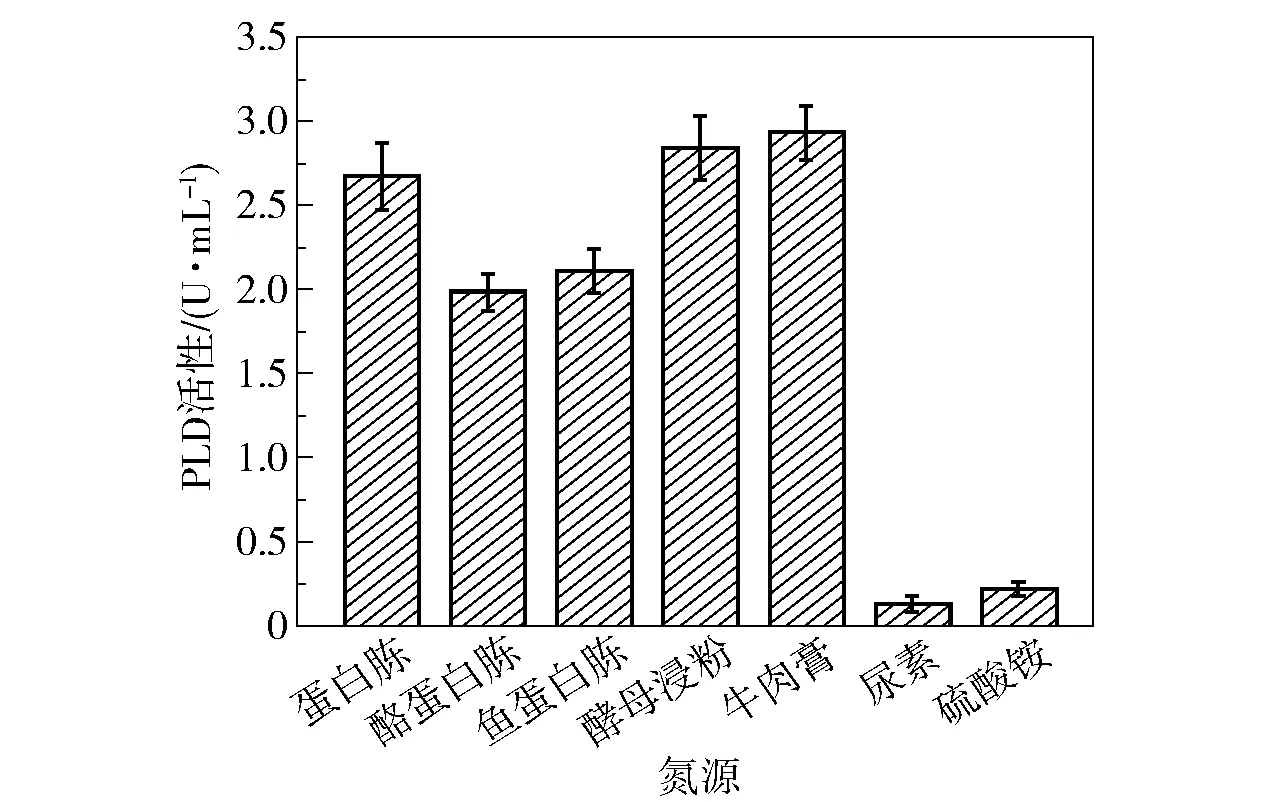
图10 氮源种类对PLD 活性的影响Fig.10 Effect of different nitrogen sources on PLD activity
为了探究牛肉膏的添加量对菌株产酶效果的影响,分别在发酵基础培养基中添加10、20、30、40、50 g/L 的牛肉膏,发酵48 h 时取样,测定PLD 酶活性,结果如图11 所示。 可以看出,牛肉膏的添加量对PLD 酶活性的影响较小,在添加20 g/L 牛肉膏时PLD 酶活性达到最大(3.11 U/mL),继续增加牛肉膏的添加量,酶活性有所降低。
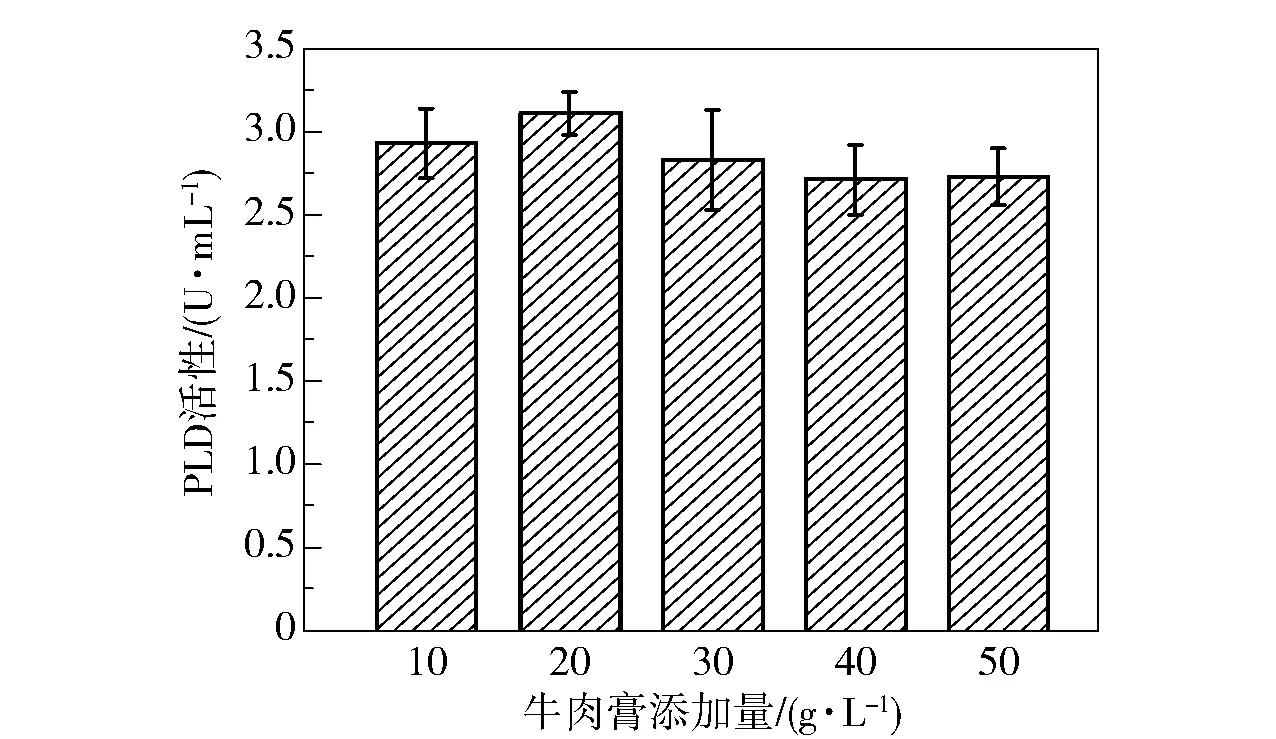
图11 牛肉膏添加量对PLD 活性的影响Fig.11 Effect of addition amount of beef extract on PLD activity
2.4.4 碳源种类及添加量
碳源既作为构成细胞的骨架,也能为菌体生产提供能源。 为了探究不同碳源(葡萄糖、果糖、蔗糖、乳糖、可溶性淀粉、微晶纤维素、木糖和木聚糖)对突变菌株S6-UD46 发酵产PLD 的影响,将发酵基础培养基中碳源替换为10 g/L 上述碳源,在培养48 h 时取样,测定PLD 酶活性,结果如图12 所示。可以看出,许多碳源都取得了较好的产酶效果,其中蔗糖的PLD 酶活性为3.22 U/mL,略高于葡萄糖。此外,S6-UD46 可以利用木糖进行发酵,表明其具有木糖代谢途径,但不能利用木聚糖,原因可能是其产木聚糖酶的水平较低。
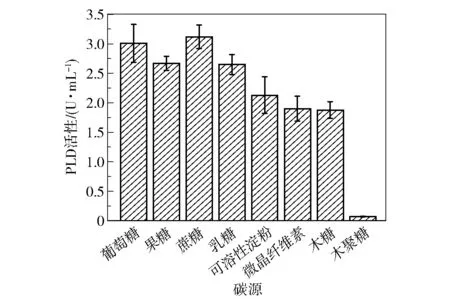
图12 碳源种类对PLD 活性的影响Fig.12 Effect of different carbon sources on PLD activity
为了探究了蔗糖的添加量对菌株产酶效果的影响,分别在发酵基础培养基中添加5、10、15、20、30、40 g/L 的蔗糖作为碳源,发酵48 h 时取样,测定PLD 酶活性,结果如图13 所示。 可以看出,当蔗糖添加量为 10 g/L 时 PLD 的酶活性最大(3.22 U/mL),是优化前(0.52 U/mL)的6.19 倍。继续增大碳源浓度,产酶量没有明显变化,这可能是因为蔗糖浓度增大改变了发酵液的渗透压,影响了细胞生长和产酶效率。
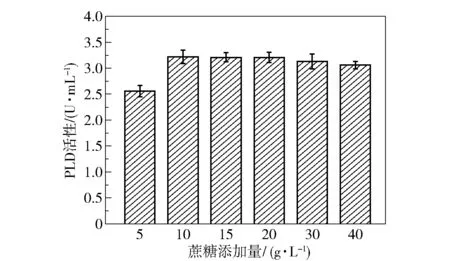
图13 蔗糖添加量对PLD 活性的影响Fig.13 Effect of addition amount of sucrose on PLD activity
3 结论
(1)以蜡样芽孢杆菌B.cereusCICC 20551 为出发菌株,采用紫外线与硫酸二乙酯对其进行复合诱变,同时利用本文建立的PLD 酶活性高效筛选方法,筛选出一株高产PLD 的突变菌株S6-UD46,培养48 h 时该菌株的PLD 产酶量可达0.52 U/mL,与原始菌株相比酶活性提高了62.5%。
(2)对突变菌株S6-UD46 的发酵条件进行了优化,得到最佳发酵条件为:以20 g/L 牛肉膏为氮源,10 g/L 蔗糖为碳源,在OD600达到4 左右时加入40 g/L 卵磷脂(PC 含量>90%)进行诱导产酶,在37 ℃、200 r/min 下培养48 h,PLD 的酶活性可达3.22 U/mL,是优化前的6.19 倍。

