肝纤维化进程中巨噬细胞异质性对肝星状细胞命运的影响
曹越 邹燕婷 宁柳心 徐蓓莉 张顺财 蔡瑜
肝纤维化(hepatic fibrosis,HF)是由各种慢性损伤导致的可逆性病理修复过程,以肝脏中细胞外基质(extracellular matrix,ECM)(如Ⅰ型和Ⅲ型胶原等)的异常产生与过度沉积为特征[1]。肝星状细胞(hepatic stellate cells,HSC)是ECM的主要来源。病因去除后,HF可发生消退并伴随着活化的肝星状细胞(activated hepatic stellate cells,aHSC)的明显减少[2]。aHSC的清除主要有以下4种方式:程序性细胞死亡、衰老、转化为失活状态及自然杀伤细胞(natural killer cells,NKcell)的杀伤[3-6]。来自免疫细胞、肝内常驻细胞和ECM的细胞外信号都能对HSC的激活与aHSC的清除产生重要影响[3]。巨噬细胞具有高度的异质性,是各类急、慢性肝病发病机制中的关键效应细胞,可通过分泌可溶性因子、囊泡、基质金属蛋白酶(matrix metalloproteinase,MMP)等多种方式对HSC的表型转换进行调控[7]。本综述总结了HF进程中,巨噬细胞异质性对HSC命运的影响及其作用途径。
一、肝巨噬细胞的异质性
肝巨噬细胞的异质性常通过不同细胞亚群的起源和迁移行为、极化表型、特殊标志物的表达以及效应功能的差异进行解释。
(一)起源的异质性 根据不同的起源,肝巨噬细胞可分为肝巨噬细胞(Kupffer cells,KC)和单核细胞衍生的巨噬细胞(monocyte-derived macrophages,MoMF)。通常认为肝巨噬细胞亚群的功能与其起源密切相关。KC起源于胚胎卵黄囊或胎肝来源的红系/髓系祖细胞,驻留于肝组织中,依靠巨噬细胞集落刺激因子(macrophage colony stimulating factor,M-CSF)和粒细胞-巨噬细胞集落刺激因子(granulocyte macrophage colony stimulating factor,GM-CSF)维持自我更新。KC具有免疫耐受性,参与铁、胆红素、胆固醇等的代谢,帮助病原微生物、细胞碎片、代谢废物的清除以维持肝脏和全身的稳态[8]。肝脏受损后,KC分泌的炎性细胞因子、趋化因子等生物活性物质,将大量免疫细胞募集到肝脏;在此过程中骨髓间充质干细胞来源的循环单核细胞受到CC趋化因子配体2/CC趋化因子受体2(CC chemokine ligand 2/CC chemokine receptor 2,CCL2/CCR2)或CCL1/CCR5的引导向肝脏浸润,分化为高表达淋巴细胞抗原6复合物C位点(lymphocyte antigen 6 complex locus C,LY-6C)的MoMF,发挥促炎和促纤维化的作用[9]。但是,有研究发现在疾病进程中同一来源的巨噬细胞会发生功能转变,如在肝损伤消退期间,LY-6Chi巨噬细胞吞噬来自凋亡细胞的细胞碎片后,受胞外信号调节激酶(extracellular signal-regulated kinase,ERK)激活,可转换为LY-6Clo的恢复性巨噬细胞[10]。此外,在KC大量死亡或耗竭的情况下,MoMF可向KC表型转换[11]。
(二)极化方向的异质性 依据极化表型巨噬细胞可被分为M1型和M2型。巨噬细胞受到脂多糖(lipopolysaccharide,LPS)、γ干扰素(interferon γ,IFN-γ)或肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)等刺激后向M1型方向极化,参与1型辅助T(type 1 T helper,Th1)细胞型免疫应答,分泌促炎细胞因子,发挥抗原呈递功能,具有促炎、清除病原微生物、降解细胞外基质、抗肿瘤的作用。巨噬细胞受到白细胞介素4(interleukin 4,IL-4)或IL-13等刺激后向M2型方向极化,参与Th2细胞型免疫应答,并可进一步细分为发挥抗炎功能的M2a型、免疫调节功能的M2b型、创伤愈合功能的M2c型和促进肿瘤进展的M2d型[12]。但因巨噬细胞亚群有组织和疾病微环境特异性的基因转录、表观修饰和代谢改变,简单的二分类模型并不能完整地将各个亚群进行归类。另外,具有同样促炎或抑炎功能的巨噬细胞在异质性分类上也并不一一对应,如LY-6ChiMoMF与M1型巨噬细胞及LY-6CloMoMF与M2型巨噬细胞间并无相应的匹配关系。
(三)转录谱的异质性 单细胞测序技术的应用又为巨噬细胞的异质性提供了新的解释。对人体健康肝脏样本的转录组测序分析发现,CD68+巨噬细胞表面胶原样结构巨噬细胞受体(macrophage receptor with collagenous structure,MACRO)表达水平有差异,可分为CD68+MARCO+细胞簇和CD68+MARCO-细胞簇。前者富集了耐受性相关的通路,具有免疫调节特征,而后者则富集了炎症性相关的通路,表现出促炎特征[13]。
因此,用单一的标准对肝巨噬细胞进行分类具有一定的局限性,而以疾病背景下的功能特征为主要标准对巨噬细胞亚群进行归类,有助于我们更好地理解巨噬细胞的异质性,并提供了HF进程中巨噬细胞异质性作用的研究线索。
二、肝巨噬细胞对HSC活化的调节
稳态环境中,静止表型的HSC位于肝细胞与肝窦内皮细胞之间的Disse间隙内,其主要功能是储存维生素A[2]。肝损伤后,HSC被激活,这一过程可分为启动和延续两个阶段,启动阶段HSC对胞外信号作出反应,丢失储存维生素A的脂滴,获得增殖性、收缩性、炎性和趋化性;随后的延续阶段则涉及aHSC向受损部位的迁移、存活以及活化表型的保留与放大[3]。
(一)KC对HSC活化的调节 KC激活后,分泌细胞因子、活性氧、损伤相关分子模式等刺激物质,直接参与HSC激活的启动与延续,从而导致HF的发生与进展(表1)。如在由四氯化碳(carbon tetrachloride,CCl4)诱导的小鼠HF模型中,KC在肝内CXCL6的诱导下分泌转化生长因子-β(transforming growth factor-β,TGF-β),TGF-β可通过与HSC表面的I型受体结合诱导下游SMAD蛋白磷酸化,SMAD3进一步与BRD4相互作用并触发BRD4/C-MYC/EZH2轴的级联信号,最终导致HSC的活化[14]。KC对CCl4造成的肝组织损伤还能产生另一种损伤相关分子模式——高迁移率族蛋白B1(high-mobility group box-1,HMGB1),它能增强HSC中丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPK)信号通路的表达,进而促进I型胶原蛋白α1链(collagen type I alpha 1 chain,Colla1)的产生[15]。血吸虫性肝病小鼠模型中,KC受血吸虫可溶性虫卵抗原的刺激而产生骨桥蛋白(osteopontin,OPN),OPN通过Hedgehog通路促进HSC激活并产生Ⅰ型胶原[16]。
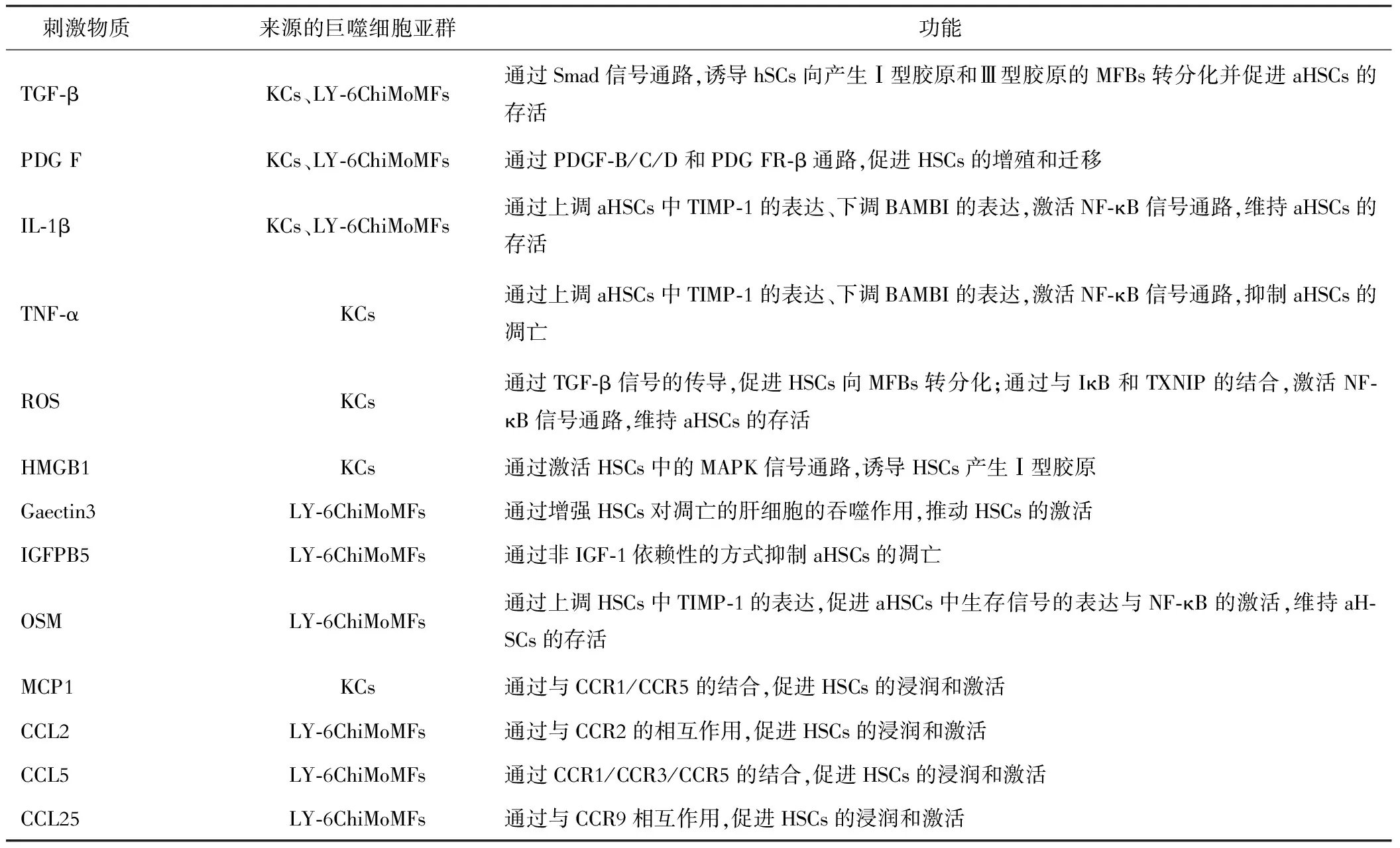
表1 巨噬细胞在HSC活化过程中释放的刺激物质[3,17-22]
KC还可通过受体-配体相互作用的方式调节HSC的活化。如在胆管结扎法(bile duct ligation,BDL)和CCl4诱导的小鼠HF模型中,KC表面的膜结合配体Jagged-1与HSC的Notch受体结合,从而启动Notch1介导的HSC的活化[23]。
(二)骨髓来源的巨噬细胞亚群对HSC活化的调节 HF进展期间,LY-6Chi巨噬细胞亚群在肝脏中占主导地位,通过分泌各类刺激物质,为HSC的活化与存活提供了各类细胞外信号(表1)。如在由缺乏蛋氨酸和胆碱(methionine and choline deficient,MCD)饮食诱导的小鼠纤维化脂肪性肝炎模型中,C3ar1基因在骨髓来源的巨噬细胞(bone marrow-derived macrophages,BMDM)中表达上调,诱导了IL-1β和TGF-β的产生,促使HSC中α-平滑肌动蛋白(α-smooth muscle actin,α-SMA)、纤维发生相关基因(Colla1,TGF-β,Smad2)以及内质网应激标志物(GRP78,IRE1α,PDI)的表达上调[24]。
除了巨噬细胞衍生的各类可溶性因子外,MoMF还能通过其他途径与HSC进行对话。Henderson等[25]借助单细胞转录组测序发现了一群从循环单核细胞中分化出来的TREM2+CD9+瘢痕相关巨噬细胞(scar-associated macrophages,SAMφ) 其表型与小鼠肝损伤模型中的MoMF类似,在人纤维化肝脏中大量扩增。SAMφ表达表皮生长因子受体(epidermal growth factor receptor,EGFR)、间充质细胞有丝分裂原TNFSF12和PDGFB的配体,通过与PDGFRA+瘢痕相关的间充质细胞表面同源受体的交互,促进了HSC中纤维状胶原蛋白的表达。
BMDM对HSC活化的调控也发生在原发性肝病以外的情况中。胰腺导管腺癌背景下,转移相关巨噬细胞(metastasis-associated macrophages,MAM)可通过分泌颗粒蛋白促进静止状态的HSC转分化成分泌骨膜素的MFB,并形成有利于肿瘤细胞向肝脏转移并生长的肝纤维化微环境[26]。
(三)M1型巨噬细胞亚群对HSC活化的调节 Melgert等[27]对HF患者和小鼠肝脏中不同极化表型的巨噬细胞进行定位与定量研究发现,在HF形成阶段M1和M2极化表型的巨噬细胞均大量增殖且都参与了HSC的活化。但由于引起HF的原因各异,其发病机制与病理过程不同,导致占主导地位的巨噬细胞极化表型也不同。如在CCl4诱导的小鼠HF模型中,具有M1表型的F4/80+巨噬细胞可通过分泌IL-1和TNF-α上调核因子-κB(nuclear factor-κB,NF-κB)通路相关基因的表达,阻滞aHSC的凋亡,加重肝脏纤维化,但该路径并不能上调Colla1、Colla2和Acta2等与HSC激活相关的基因的表达,无法直接参与HSC激活的启动阶段[28]。
另外,对M1型巨噬细胞与HSC的对话机制也有很多研究。Lian等[29]发现经LPS和腺嘌呤核苷三磷酸(adenosine triphosphate,ATP)刺激的THP-1(巨噬细胞系)可依靠嘌呤受体P2X配体门控性离子通道7 (purinergic receptor P2X ligand-gated ion channel 7,P2X7R)-Toll样受体4(toll like receptor4,TLR4)-核苷酸结合寡聚化结构式受体3(NLR family pyrin domain containing 3,NLRP3)轴以及IL-1β的分泌参与LX-2(HSC细胞系)激活的启动与延续。Liu等[30]发现在LPS的刺激下THP-1细胞可产生含microRNA-103-3p的外泌体,microRNA-103-3p通过与Kruppel样因子4(Kruppel-like factor 4,KLF4)3’UTR的结合干扰其对α-SMA表达的负性调控作用,从而促进了HSC的增殖与活化。Liu等[31]又将RAW264.7(巨噬细胞系)用LPS进行了处理,发现其也可通过分泌microRNA-500抑制HSC中MFN2基因的表达并上调其下游Smad2/Smad3的磷酸化水平与TGF-β的蛋白质表达水平,最终导致HSC的增殖,以及Ⅰ型、Ⅲ型和Ⅳ型胶原的产生。
(四)M2型巨噬细胞亚群对HSC活化的调节 慢性丙型肝炎病毒(hepatitis C virus,HCV)可在体外诱导MoMF表面表达M2型巨噬细胞的标志物(CD206,CD163,DC-SIGN)并分泌TGF-β,这促使HSC中胶原蛋白、金属蛋白酶组织抑制剂-1(tissue inhibitor of metalloproteinase-1,TIMP-1)和α-SMA的表达上调。在慢性HCV感染者外周血和肝脏中也可观察到循环单核细胞表面M2型相关标志物表达的增加,且其与HF严重程度呈正相关[32]。
在体外细胞培养体系中,亚砷酸盐通过microRNA-21下调第10号染色体缺失性磷酸酶张力蛋白同源物(phosphatase and tensin homolog,PTEN)基因的表达从而诱导THP-1细胞向M2表型极化,并分泌TGF-β等致纤维化细胞因子;将其与LX-2细胞共培养后,LX-2细胞中的α-SMA和胶原蛋白的表达量上调[33]。
三、肝巨噬细胞对aHSC清除的调节
aHSC的清除主要涉及以下4条途径:程序性细胞死亡(凋亡、坏死性凋亡、焦亡、铁死亡、铜死亡和自噬等)、衰老、转化为失活状态以及NK细胞的杀伤[2,34,35]。细胞凋亡是aHSC在HF消退时较为主要的(约50%)一种清除方式[3]。巨噬细胞通过与HSC的对话来调控aHSC的多种清除途径,但目前的研究主要集中在巨噬细胞诱导aHSC凋亡方面。
(一)LY-6Clo巨噬细胞亚群对aHSC凋亡的影响 肝损伤因素去除后,浸润于肝组织中的LY-6ChiMoMF表面CX3CR1的表达上调,与相应配体CX3CL1结合后抑制其自身的促炎特性,并经表型转换衍生出恢复型巨噬细胞——CD11bhiF4/80intLY-6CloMoMF[3]。LY-6Clo巨噬细胞是产生MMP9、MMP12、MMP13的主要来源,其表面表达TNF相关的凋亡诱导配体(TNF-related apoptosis-inducing ligand,TRAIL)[2,3]。LY-6CloMoMF通过MMP9、TRAIL诱导aHSC的凋亡[10]。TIMP可通过促进aHSC的生存信号以及激活NF-κB来维持aHSC的存活;LY-6CloMoMF通过MMP12和MMP13减少了aHSC中TIMP的表达,导致aHSC丧失维持存活的信号,减少aHSC的数目,推动纤维化的消退[36]。
(二)M1型巨噬细胞亚群对aHSC凋亡的影响 在HF消退期间,不同极化表型的巨噬细胞都能驱动aHSC的清除和ECM的降解,但与M2型相比,M1型巨噬细胞发挥了更重要的作用[12]。Miao等[37]在CCl4诱导的大鼠HF模型中,向大鼠腹腔内注射衣霉素诱发KC的内质网应激反应(endoplasmic reticulum,ER);ER通过IRE1α/TRAF2/NF-κB信号通路促进KC向M1表型极化并增加TNF-α的释放;源自M1型巨噬细胞的TNF-α对激活静息态的HSC并无明显的作用,却可触发TNF-R1/caspase 8信号导致HSC的凋亡。在BDL和CCl4诱导的小鼠HF模型中,M1型BMDM可增加纤维化肝脏中NK细胞的总数量,并诱导NK细胞的活化;这些NK细胞通过表达TRAIL促进aHSC的凋亡[38]。
四、总结与展望
HSC的活化与清除对HF的进程起决定性的作用,不同亚群的巨噬细胞可通过各种途径调控HSC的命运,从而影响HF的进程。因此,以巨噬细胞与HSC间的交互为焦点进行探索,有助于我们找到抗HF治疗新靶点。然而,目前尚存在一些问题与挑战。一方面,HF是诸多慢性肝病进展期的共同病理过程,引起肝脏损伤的病因各异,其所形成的肝病微环境也不同,故巨噬细胞与HSC间的交互作用存在疾病特异性的差异,仅用单一的动物模型或体外细胞培养体系进行研究可能会偏离实际情况。另一方面,肝脏中的各种细胞与信号通路间均存在串扰,巨噬细胞与HSC的对话不可避免地会受到其他信号的影响。此外,虽然针对巨噬细胞的异质性已开展了深入的研究,但目前仍缺乏一幅足够清晰的图景来刻画不同亚群的特质。最后,由于人体样本的获取难度高,目前的研究主要在啮齿类动物模型中展开,种属差异使实现临床转化存在一定难度。但随着单细胞测序、活体组织显微成像、生物信息学等研究方法的发展,为明确巨噬细胞在HSC活化与清除中的调节方式和机制带来了可能,并为HF的诊治开发出更多切实有效的新方法提供了研究基础。
利益冲突声明:所有作者均声明不存在利益冲突。