腹腔镜辅助胃癌D2 根治术联合胃背侧系膜近胃端完整系膜切除术治疗进展期胃癌患者的效果分析
陈培浩,黄杰涛,徐鸣山,黄晓明
(广东揭阳市榕城区中心医院外一科,广东揭阳 522031)
胃癌早期通常无明显症状,一经发现大多已处于进展期,具有较高的死亡率[1]。临床上治疗该病主要方法为腹腔镜下胃癌D2 根治术,该手术方式主要是在腹腔镜的辅助下进行肿瘤病灶切除及淋巴清扫,可在一定程度上保证患者生存率[2]。 但有研究表明进展期胃癌的肿瘤细胞除直接扩散、 淋巴结转移等方式,还可能存在系膜转移,即“第五转移”,而腹腔镜下胃癌D2 根治术并不涉及完整胃肠系膜切除, 故可能会增加患者肿瘤复发率[3]。 基于系膜解剖学原理提出的胃背部系膜全切术(CME)是一种能够完全切除癌组织和周边淋巴结的术式,将其与腹腔镜下胃癌D2 根治术联合使用于晚期胃癌患者中,有望减少因系膜转移导致的癌症复发。 基于此,本研究选取我院收治的42例进展期胃癌患者为对象, 将腹腔镜辅助胃癌D2根治术联合胃背侧系膜近胃端CME 应用于进展期胃癌患者,观察其疗效。 现报道如下。
1 资料与方法
1.1 一般资料
选择2021 年2 月—2022 年2 月我院收治的42 例进展期胃癌患者为研究对象。纳入标准:(1)符合原发性胃癌诊断标准[4];(2)行腹腔镜辅助胃癌D2 根治术;(3)肿瘤TNM 分期为Ⅱ~Ⅲ期。排除标准:(1)既往进行过腹部手术;(2)病灶向腹腔及远处转移者;(3)凝血功能障碍。 依据患者所采用手术方式的不同将其分为传统组(n=21)和辅助组(n=21)。 传统组中男15 例,女6 例;肿瘤TNM 分期Ⅱ期13 例,Ⅲ期8例。 辅助组中男14 例,女7 例;肿瘤TNM 分期Ⅱ期14 例,Ⅲ期7 例。 两组患者一般资料对比,差异无统计学意义(P>0.05)。本研究已经院医学伦理委员会批准,所有患者及家属知情同意参与本研究并签署知情同意书。
1.2 方法
所有患者于术前8 h 开始禁食禁饮,且由同一组医生进行手术。 同时于术后接受常规抗感染等治疗。传统组患者予以腹腔镜D2 根治术治疗。 患者取仰卧位,经气管插管全身麻醉,以5 孔法建立气腹,在12~14 mmHg(1 mmHg=0.133 kPa)的气压下,置入腹腔镜,观察肿瘤的位置、大小和周围的解剖结构。离断胃网膜左右动静脉及根部,切除大网膜,离断胃网膜左动静脉,清扫周围淋巴结,剥离横结肠系膜前叶,保护胃网膜右血管,游离小网膜,分离腹段食管,解剖贲门,切断迷走神经,行淋巴结清扫,完成后于上腹正中取5 cm 切口, 从腹腔提出胃体切除肿瘤, 吻合食管胃,重建消化道,留置引流管。
辅助组予以腹腔镜D2 根治术联合CME 治疗。患者取仰卧位, 行气管插管全麻,5 孔法建立CO2气腹,设置压力12~14 mmHg,放置腹腔镜。 术中沿横结肠至结肠脾曲游离大网膜,并找到左网膜与横结肠系膜的交点,行钝性分离,在左网膜根部暴露左网膜血管,夹住血管,用超声刀切断左网膜血管,完成左网膜分离;之后,在右大网膜与横结肠系膜的交界处发现一个“膜桥”样结构,使用超声刀将大网膜右侧网膜沿膜床完全剥离,充分显露“海登干”“凯旋门”等解剖征象,并进行清扫No.6、No.14v 处淋巴结。 用超声刀沿胰腺上缘分离左胃系膜膜床和胃后肠系膜膜床,沿膜层分离,暴露出左胃动静脉、脾动脉和从脾动脉发出的胃后血管,切断左胃血管和胃后血管,完全分离左胃和胃后肠系膜,并进行清扫No.7、No.9、No.11 处淋巴结。寻找胃十二指肠动脉表面朝肝固有动脉的系膜床,分离并暴露右胃血管根部,切断血管,行No.5 处淋巴结清扫,暴露肝固有动脉、门静脉,行No.12a 淋巴结清扫; 继续沿着肝总动脉向左侧胃系膜分离,行No.8a、No.8p 淋巴结清扫,会合左侧胃系膜;重建消化道,留置引流管。
所有患者随访1 年。
1.3 观察指标
(1)手术指标:记录两组患者术中出血量、淋巴结清扫数目及手术所用时间。(2)术后恢复:观察并记录两组患者下床活动、首次排气及住院的时间。(3)术后并发症情况,包括吻合口瘘、切口感染、肠梗阻及腹胀等。(4)术后随访1 年,记录两组患者术后1 年的生存率、复发率、转移率。
1.4 统计方法
采用SPSS 22.0 统计学软件进行数据分析。 计数资料以[n(%)]表示,组间比较采用χ2检验;计量资料以()表示,组间比较采用t 检验。 P<0.05 表示差异有统计学意义。
2 结 果
2.1 两组患者手术指标比较
辅助组术中出血量少于传统组,淋巴结清扫数量多于传统组,手术时间短于传统组,组间差异有统计学意义(P<0.05)。 见表1。
表1 两组进展期胃癌患者手术指标比较()
组别术中出血量(mL)手术时间(min)淋巴结清扫数目(个)辅助组(n=21)传统组(n=21)t 值P 值72.63±18.26 99.86±26.15 3.912 0.000 128.36±21.57 156.35±33.26 3.236 0.003 29.18±8.45 21.57±6.90 3.197 0.003
2.2 两组患者术后恢复情况比较
辅助组下床活动及首次排气时间均早于传统组,住院时间短于传统组,组间差异有统计学意义(P<0.05)。见表2。
表2 两组进展期胃癌患者术后恢复情况比较[(),d]
组别首次排气时间下床活动时间住院时间辅助组(n=21)传统组(n=21)t 值P 值2.03±0.61 2.68±0.73 3.131 0.003 1.29±0.43 1.78±0.51 3.366 0.002 7.21±1.75 9.16±2.11 3.260 0.002
2.3 两组患者术后并发症发生情况比较
辅助组术后并发症发生率低于传统组,差异有统计学意义(P<0.05)。 见表3。
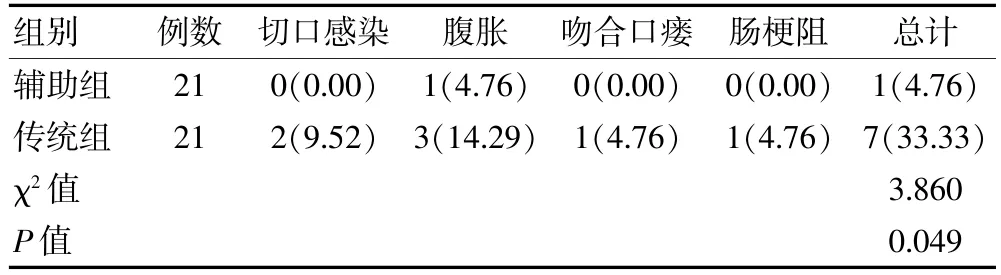
表3 两组进展期胃癌患者术后并发症情况比较[n(%)]
2.4 两组术后1 年的生存率、复发率、转移率比较
随访1 年,无1 例失访。 辅助组术后1 年生存率高于传统组,复发率、转移率均低于传统组,组间差异有统计学意义(P<0.05)。 见表4。
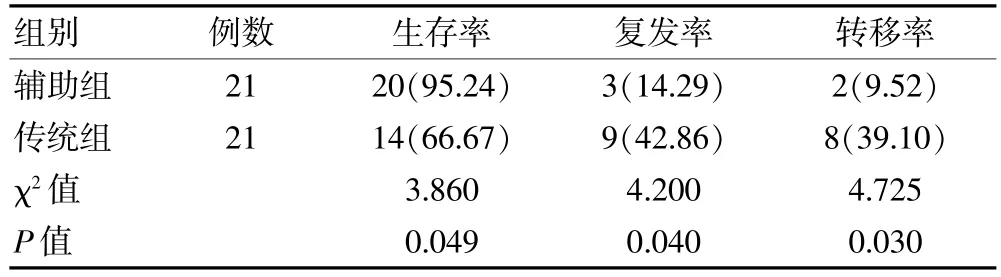
表4 两组进展期胃癌患者术后1 年的生存率、复发率、转移率比较[n(%)]
3 讨 论
因早期症状不明显, 故胃癌早期诊断率较低,往往确诊时已发展为进展期胃癌,严重威胁患者生命安全[5]。 临床多采用腹腔镜胃癌D2 根治术治疗该疾病,该术式主要强调切除病灶及对胃周围淋巴结和脂肪进行清扫,对维持患者近期、远期存活率有一定的效果[6]。 但胃表面被系膜包裹,在进行腹腔镜胃癌D2 根治术时可能会导致肿瘤细胞脱落至系膜上,引起胃局部肿瘤复发,影响患者生存[7]。胃背侧系膜近胃端CME是以膜解剖理论为基础, 进行胃癌完整系膜切除术,最大程度地减少肿瘤细胞脱落,与腹腔镜胃癌D2 根治术联合使用可能更适用于进展期胃癌患者[8]。
本研究结果显示,辅助组患者术中出血量少于传统组,淋巴结清扫数量多于传统组,手术时间短于传统组,组间差异有统计学意义(P<0.05),这说明对进展期胃癌患者实施联合手术有助于减少术中出血、缩短手术时间、更彻底地清扫淋巴结。 CME 根据膜解剖理论进行系膜切除,借助腹腔镜在胃系膜与淋巴管和动静脉筋膜间疏松间隙进行手术操作, 解剖清晰,剥离简单,不但可以避免对无关区域的淋巴结和组织进行过多牵拉,还可以对淋巴结进行彻底清扫,减少肿瘤细胞脱落、移植到其他部位的可能性,从而降低手术的风险, 也可以最大限度地避免对周围的血管、淋巴和系膜等组织造成的损伤, 从而减少术中的失血,缩短手术时间[9]。
在进行胃肠手术时, 会改变原有的胃肠解剖结构,使胃肠道细菌移位,再加之手术创伤,通常会引起机体炎症和应激反应,导致切口感染、胃肠道神经紊乱等情况,引发腹胀、肠梗阻、吻合口瘘等术后并发症。本研究结果显示,与传统组相比,辅助组患者下床活动及首次排气时间更早,住院时间更短,术后并发症的发生率更低,组间差异有统计学意义(P<0.05),这说明进展期胃癌患者应用联合手术方式可促进患者术后早日恢复,降低术后并发症风险。 腹腔镜下胃癌D2 根治术联合胃背侧系膜近胃端CME 术式,在腹腔镜下,医生可以清晰地看到系膜、血管、神经等解剖结构,大大简化了操作步骤,减少了不必要的创伤,降低了手术风险。 此外,该术式依据胃系膜解剖学原理,以胃系膜为切入点,避免了过多的牵引力,有助于术后胃肠道功能的迅速恢复和减少并发症的发生。
肿瘤复发和转移可对进展期癌症患者生存率产生较大影响[10]。 本研究结果显示,辅助组患者的术后1年生存率明显高于传统组,复发率、转移率明显低于传统组,组间差异有统计学意义(P<0.05),这说明进展期胃癌患者应用联合手术有助于降低肿瘤复发率及转移率,提高生存率。胃周围是一个完整的肠系膜,肠系膜表面由固有筋膜和腹膜脏层共同环绕整个消化系统,并与周围血管、结缔组织和淋巴组织形成空腔结构。 进行腹腔镜下胃癌D2 根治术时,除了直接浸润、腹膜播散、血行转移、淋巴结转移之外,还存在着大量的肿瘤细胞,这些肿瘤细胞可以从不同的路径进入到空腔内,从而形成“第五转移”,这是腹腔镜下胃癌D2 根治术后肿瘤复发、转移的主要原因。 而腹腔镜下D2 根治术联合CME 在切除病灶和清扫淋巴组织的基础上,强调胃系膜解剖理论,可沿胃背侧系膜解剖学边界行近胃端CME, 可避免空腔结构或系膜内癌细胞遗漏和散落而引起的肿瘤复发或转移,有效降低复发率及转移率,提高生存率。
综上所述,对进展期胃癌患者实施腹腔镜下胃癌D2 根治术联合胃背侧系膜近胃端CME,可有效降低患者在术中的出血量,提高淋巴结清除效果,缩短患者的手术时间,促进患者早日恢复,减少术后并发症发生,降低复发率及转移率,提高生存率。

