糖含量对大豆蛋白起泡性的影响
薛远,宋春丽*,任 健
(1 齐齐哈尔大学食品与生物工程学院 黑龙江齐齐哈尔161006 2植物性食品加工技术教育部工程研究中心 黑龙江齐齐哈尔 161006)
大豆蛋白营养价值高,必需氨基酸种类齐全,接近动物蛋白,是一种优质植物蛋白[1]。此外,该蛋白作为重要的蛋白质配料而广泛应用于食品加工领域[2]。蛋白质的起泡性是赋予食品良好的质构、稳定性和加工特性的重要内在因素。例如,利用蛋白质包裹的方式保留住空气,赋予面包、蛋糕、饼干、蛋白霜、冰淇淋和一些烘焙产品理想的结构属性[3-4]。然而,天然食品蛋白质的溶解性、起泡性等性质常常不能满足产品的需求[5-6]。因此,有必要对食品蛋白质进行改性处理,以获得理想的功能性质。
美拉德反应在一定温度和湿度条件下,能够改变蛋白质分子结构,将糖分子的亲水性羰基引入蛋白质分子之中,该反应无需加入化学试剂,安全性高。国内外许多学者利用美拉德反应显著提高了大豆蛋白的起泡性,探索不同种类糖基的导入对蛋白质功能性质的影响规律[7-9]。值得注意的是,在利用美拉德糖基化反应实现蛋白质糖基化的同时,会伴随着蛋白质自交联反应[10]。在剖析蛋白质糖基化对功能性质的影响规律时,无法充分界定导入糖分子含量变化本身所带来的影响。
本研究采用美拉德反应获得大豆蛋白糖基化产物,利用β-淀粉酶依次断裂导入糖基的麦芽糖单位,改变糖基化产物侧链糖基含量,从而获得具有不同糖含量的大豆蛋白。构建出自交联程度相同,而侧链糖基不同的糖基化产物模型,通过对各指标的分析和评估,确定、剖析糖基化产物的起泡性变化,从而为定向开发具有特定功能的蛋白质提供理论参考。
1 材料与方法
1.1 材料与试剂
脱脂豆粕,哈尔滨市宾县禹王植物蛋白有限公司;麦芽糊精(Maltodextrin,MD,DE 值:8~10),山东禹城保龄宝生物有限公司;β-淀粉酶(30 U/mg),上海麦克林生物有限公司;十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(Sodium dodecyl sulfatepolyacrylamide gel electrophoresis,SDS-PAGE)预制胶片,金斯瑞生物科技公司;低分子质量标准蛋白质,北京欣经科生物技术有限公司;考马斯亮蓝R-250,美国Sigma 公司;其它试剂均为分析纯级。
1.2 仪器与设备
XW-80A 型涡旋混合器,上海青浦沪西仪器厂;T25 型均质机,德国IKA 公司;RF-530IPC 型荧光分光光度计,日本岛津公司;Nano-ZS90 型纳米粒度、Zeta 电位分析仪,英国Malvern 公司;DYY-10 型三恒电泳仪,北京市六一仪器厂。
1.3 方法
1.3.1 大豆蛋白的提取 将脱脂豆粕与蒸馏水按1∶10(m/V)的比例低温溶胀过夜,使其充分水合,然后用2 mol/L 的NaOH 调节pH 值 至8.5,50 ℃水浴搅拌2 h,转速为30~35 r/min。随后将混合物在3 000 r/min 离心20 min,收集上清液。用2 mol/L 的HCl 将pH 值调至4.5,将其4 ℃放置分层后3 000 r/min 离心20 min,收集沉淀,用蒸馏水(pH 4.5)水洗2 次后,用2 mol/L 的NaOH 调节pH 值至8.0。随后冷冻干燥48 h,制得SPI,蛋白质含量为91.36%。
1.3.2 糖基化产物的制备 制备SPI 分散液(70 mg/mL,pH 8.0),将SPI 溶液与麦芽糊精溶液(pH 8.0)按一定比例充分混合,进行美拉德反应(4%SPI,40 min,质量比1∶2),得到反应产物。将反应产物的pH 值调至4.5,3 000 r/min 离心10 min,收集沉淀,加蒸馏水溶解并调节pH 值至7.0。在4℃下透析(8~14 ku)24 h,除去游离的麦芽糊精分子,将透析产物(M0)冷冻干燥,备用。
1.3.3 不同糖含量糖基化修饰产物的制备 制备蛋白质分散液(M0,40 mg/mL,pH 7.0)于50 ℃时添加150 U/g(以蛋白质质量为基准)β-淀粉酶,恒温振荡不同时间(5,40,80 min)。反应结束后,立刻取出,于95 ℃灭酶5 min,冷冻干燥,得到修饰产物M1(反应5 min)、M2(反应40 min)和M3(反应80 min)。将其在4 ℃其下透析(8~14 ku)24 h,除去游离的麦芽糊精,将糖基化修饰产物冷冻干燥,备用。
1.3.4 糖基化修饰产物中糖含量的测定 多糖在硫酸的作用下先水解成单糖,并迅速脱水生成糖醛衍生物,最后与苯酚生成橙黄色化合物,以比色法测定。
葡萄糖标准曲线的绘制:配制0.1 mg/mL 葡萄糖标准溶液,分别取0,0.2,0.4,0.6,0.8,1.0 mL 葡萄糖标准溶液于具塞试管中,用蒸馏水补至1.0 mL,再分别加入1.0 mL 的5%苯酚溶液,然后快速加入5.0 mL 浓硫酸,摇匀后静止10 min。随后30℃水浴处理20 min。反应液在490 nm 波长处测定吸光度。标准曲线的横坐标为葡萄糖质量浓度,纵坐标为吸光度。
样品的测定:将样品(40 mg/mL)稀释100 倍,取1 mL 样品溶液同法测定样品的吸光度,SPI 作为空白对照组(4.06 g/100 g 大豆蛋白)。
1.3.5 SDS-PAGE 电泳 参照Song 等[11]的方法稍作修改,配制3 mg/mL 蛋白溶液,取100 μL 样品溶液和等量的样品缓冲液进行混合,离心后取上清液煮沸5 min,冷却待用。分离胶含量120 mg/mL,浓缩胶含量50 mg/mL。上样量12 μL,电压调为120 V,随着溴酚蓝进入,待溴酚蓝距下缘0.5~
1.0 cm 时,结束电泳。
蛋白染色:电泳结束后,取出胶片放入考马斯亮蓝染色液中染色30 min,随后用脱色液进行脱色,至背景色完全褪去为止。
糖蛋白染色:电泳结束后,用12.5%三氯乙酸溶液固定胶片15 min 后用双蒸水振荡水洗3 次(每次5 min),再用1%的高碘酸浸泡胶片15 min,将浸泡后的胶片用双蒸水振荡水洗4 次(每次10 min);将水洗后的胶片放入Schiff 试剂避光染色30 min 后,再用0.5%偏重亚硫酸钠振荡水洗,直至被染色的粉色糖蛋白条带出现。
1.3.6 内源荧光光谱分析 参照Liu 等[12]的方法,进行内源荧光光谱的测定。将蛋白质样品溶于0.01 mol/L 磷酸盐缓冲溶液(pH 7.0)配制成1 mg/mL 的蛋白样品溶液,随后在10 000 r/min 的条件下离心15 min 后,取上清液4 mL,在发射波长为290 nm,激发和发射狭缝光度为5 nm 条件下,扫描300~400 nm 范围的发射光谱。以波长为横坐标,相对荧光强度为纵坐标作图。
1.3.7 起泡性及泡沫稳定性 将蛋白质样品溶于磷酸盐缓冲液(pH 7.0)中,配制质量浓度为10 g/L的蛋白质溶液。取100 mL 该溶液,以12 000 r/min的转速搅打1 min,记录数据,平行测定3 次[13]。蛋白质的起泡性(FC)和泡沫稳定性(FS)的计算方法见式(1)和式(2)。
式中,VL——搅打前液体的体积(mL);V0——搅打刚停止时泡沫的体积(mL);V30——搅打后静置30 min 时泡沫的体积(mL)。
1.3.8 溶解性 参照Peng 等[14]的方法测定蛋白质的溶解性。将蛋白质样品溶于pH 值为7.0 的缓冲液,配制成2 g/L 蛋白质溶液。涡旋后4 ℃存放,使其充分水合。次日8 000 r/min 离心20 min,收集上清液,采用福林酚法测定其可溶性蛋白的含量。以待测样品中可溶性蛋白质含量的占比表示蛋白质溶解性。
1.3.9 水合粒径分布和Zeta 电位 参照Hayakawa等[15]的方法,配制一定浓度的蛋白质分散液并将浓度稀释至0.1 mg/mL,用0.45 μm 水膜过滤,随后用粒度分析仪测定样品的水合粒径分布和Zeta电位,平行测定3 次。
1.3.10 表观黏度的测定 参照Gu 等[16]的方法用马尔文流变仪测定蛋白质的表观黏度。配制质量浓度为40 mg/mL 蛋白样品溶液(pH 7.0)。测定时,将样品分散液缓慢注入、充满夹具(直径为60 mm,锥角为0.5°的锥板)。在温度25 ℃,频率0.1~100 s-1时,测试样品的表观黏度。
2 结果与分析
2.1 糖基化修饰产物的糖含量
控制β-淀粉酶对SPI 美拉德产物(M0)的水解时间(分别为5,40,80 min)得到糖含量不同的修饰产物,其糖含量分别为8.10,4.88,2.21 g/100 g大豆蛋白。与M0(12.44 g/100 g 大豆蛋白)相比,修饰产物糖含量均存在显著性差异(P〈0.05)。

表1 4 种糖基化修饰产物的糖含量分析结果Table 1 Glycan contents of the modified soy protein isolates
2.2 SDS-PAGE 电泳
由图1a 可以看出,与SPI(泳道1)相比,糖基化修饰产物(泳道2~5)的7S 亚基α 和β 谱带以及11S 亚基的B 谱带显色反应减弱,高分子区域显色反应明显增强,且出现了新的谱带。表明大豆蛋白的7S 亚基和11S 亚基成分与麦芽糊精发生共价结合,形成了高分子共聚物,并且被截留在分离胶顶部[17]。

图1 大豆蛋白及其糖基化修饰产物的SDS-PAGE 电泳图Fig.1 SDS-PAGE of soy protein isolates and its glycated products
由图1b 可以看出,糖基化修饰产物(泳道2~5)在分离胶顶端有一条明显的条带,而且与阳性对照辣根过氧化物酶(糖蛋白,泳道L)相似,具有明显的糖染色现象。SDS-PAGE 分析结果显示大豆蛋白修饰产物是一个交联的大豆蛋白,而且含有糖基。结果表明,大豆蛋白与麦芽糊精发生了美拉德反应,生成了蛋白质共聚物,且该物质为糖蛋白。这直接证实了通过美拉德反应,可以将麦芽糊精导入到大豆蛋白分子中[18]。
2.3 内源荧光光谱分析
内源荧光光谱是对蛋白质分子的内源性荧光发色团(色氨酸、酪氨酸残基等)的研究[19]。SPI 及糖基化修饰产物的荧光光谱如图2 所示。

图2 大豆蛋白及其糖基化修饰产物的内源荧光光谱图Fig.2 Internal fluorescence spectrum of soy protein isolates and its glycated products
从图2 可以看出,SPI 的最大激发波长(λmax)是337 nm,是典型的色氨酸荧光光谱[20]。与SPI 相比,糖基化修饰产物的最大激发波长分别增加到346 nm(M0),343 nm(M1),343 nm(M2),342 nm(M3),表示荧光吸收呈现红移现象,表明糖基化修饰产物具有更疏松的蛋白质三级结构。这是因为蛋白质的色氨酸残基随反应的进行暴露在极性环境中,同时蛋白质分子与糖分子的共价结合也使环境极性增强[21]。同时由于β-淀粉酶作用位点的不同,产生不同空间位阻作用,也对大豆蛋白微环境造成不同影响[22]。
2.4 起泡性及泡沫稳定性
SPI 及糖基化修饰产物的起泡性及泡沫稳定性如图3 所示。SPI 的起泡能力为84.48%,M0 的起泡能力最高,为136.62%。由于糖基的导入显著提高了大豆蛋白的溶解性,糖基化修饰产物亲水性增强,当受到急速搅打时,混入大量气体,从而形成气液薄膜[23],表现为起泡性增强[24]。修饰产物随着糖含量变化起泡能力分别达到98.66%(M1),96.08%(M2),91.36%(M3),且差异显著。结果表明,修饰产物的糖含量对大豆蛋白的起泡性影响显著。
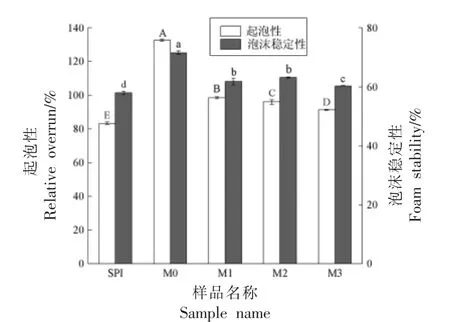
图3 大豆蛋白及其糖基化修饰产物的起泡性及泡沫稳定性Fig.3 Relative overrun and foam stability of soy protein isolates and its glycated products
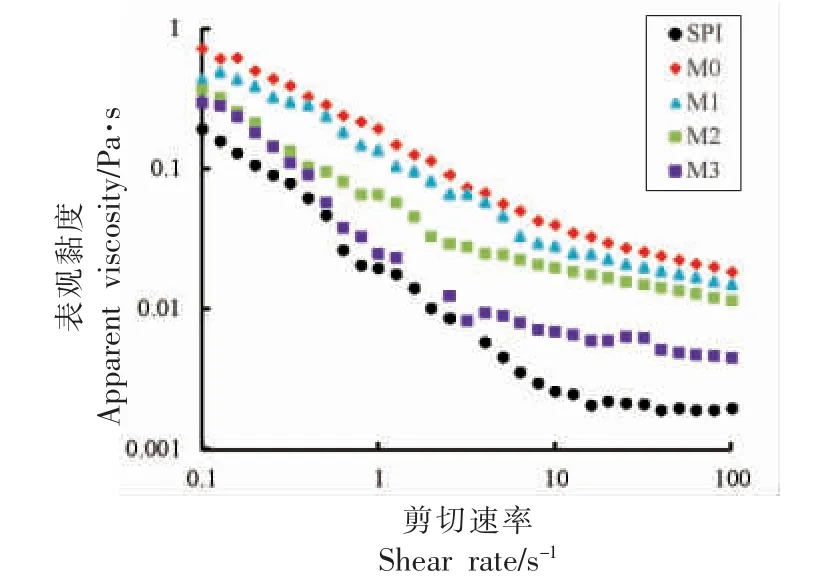
图4 大豆蛋白及其糖基化修饰产物的表观黏度Fig.4 Apparent viscosity of soy protein isolates and its glycated products
与SPI(57.05%)相比,M0 泡沫稳定性最高,为71.56%,修饰产物的泡沫稳定性均显著增强。这可能是蛋白质肽链受热展开,疏水基团暴露出来,增强了蛋白质分子在气液界面的张力,形成厚度高于SPI 的气液薄膜,从而增加泡沫稳定性[25]。此外,糖含量为4.88~8.10 g/100 g 大豆蛋白时,对泡沫稳定性影响不显著。
2.5 水合粒径分布、Zeta 电位及溶解性分析
水合粒径反映了糖基化修饰产物的聚集行为。如表2 所示,糖基化修饰产物的水合粒径由SPI 的134.4 nm 分别增大到169.4,165.4,162.6,151.2 nm。由于SPI 的游离氨基与麦芽糊精的羰基发生了结合,糖基化修饰产物的糖含量升高,水合能力增强,表现为平均粒径增大。

表2 大豆蛋白及其糖基化修饰产物的水合粒径分布、电位及溶解性Table 2 Hydrodynamic size distribution,zeta-potential and solubility of soy protein isolates and its glycated products
溶液稳定性与溶液形成的界面面积有关,进而表现出不同的泡沫稳定性。Zeta 电位是在蛋白质溶液中带电粒子剪切面的电势,通常电势被用来度量粒子之间的相互吸引力和相互排斥力;也是对体系分散稳定性度量的重要参数之一。糖基化修饰产物的电位绝对值增大(从18.3 增大到30.9)。这是因为SPI 经过糖基化改性后,空间结构发生变化,带电基团暴露出来,导致Zeta 电位绝对值进一步增大。此外,随着糖含量的减少,电位的绝对值逐渐减小(30.3,29.4,28.7)。电位的绝对值越大,粒子之间的排斥作用越显著[26],糖含量减少,粒子之间排斥力减小,导致溶液的稳定性降低。
在pH 值为7.0 时,糖基化修饰产物的溶解性显著升高。美拉德反应引起的SPI 分子结构变化会产生特定的表面特性和功能特性。通过美拉德反应,糖分子上的亲水性羟基与蛋白质的游离氨基相结合,将大量的亲水基团导入蛋白质分子之中,蛋白质分子的空间稳定[27]。蛋白质分子结构伸展且空间稳定,溶液受到搅拌时,迅速与水分子反应且产生大而稳定的界面面积,进而表现为起泡能力以及泡沫稳定性增强。
2.6 表观黏度
当蛋白质溶液受到急速较搅打时,会形成气液薄膜产生泡沫,气液薄膜的黏性与蛋白质溶液的泡沫稳定性有关。表观黏度可以评价流体黏稠度,用于表征液体中分子间吸引力[28]。SPI 及其糖基化修饰产物的表观黏度测定结果如图6 所示。与SPI 相比,糖基修饰化产物分散液的表观黏度均显著增加,且表现出非牛顿流体的特征(随剪切速率的增加,表观黏度逐渐降低)。可能是蛋白质游离氨基与糖的亲水性羰基结合生成大分子物质,糖基化修饰产物的相对分子质量、水合粒径和亲水性增加,因此M0 表观黏度增加[29]。随着糖基化修饰产物侧链糖基含量变少,水合作用变小,糖基化修饰产物的表观黏度逐渐减小,然而仍高于SPI。当体系的黏度增大,溶液被急速搅打时,蛋白质分子迅速吸附在气液薄膜上,表面张力降低,形成一个有较强凝聚力和黏性的气液薄膜,泡沫稳定性显著增强。
3 结论
美拉德反应协同β-淀粉酶定向断裂共聚糖链,能够构建出自交联程度相同,而侧链糖含量不同的糖基化大豆蛋白。该反应显著提高了SPI 的起泡性及泡沫稳定性;起泡性从83.48%提高到132.63%;泡沫稳定性从57.95%提高到71.56%。糖含量对SPI 的起泡性有显著影响,而且随糖含量的增加,起泡性逐渐增大;然而糖含量变化(4.88~8.10 g/100 g 大豆蛋白)对SPI 的的泡沫稳定性影响不显著。相应的,随着糖含量减少,糖基化产物的水合粒径、Zeta 电位绝对值、溶解性逐渐减小,表观黏度逐渐降低。研究结果为定向开发特定功能的大豆蛋白功能性配料提供理论支撑。

