肉桂醛熏蒸对金黄色葡萄球菌胞内生物大分子的影响
段雪娟,黄煜强,张 潼,韩雅莉,吴克刚*,黄庶识
(1 广东工业大学轻工化工学院 广州510006 2 广东工业大学生物医药学院 广州510006 3 广西科学院 广西海洋天然产物与组合生物合成化学重点实验室 南宁 530007)
金黄色葡萄球菌是一种常见的食源性致病菌[1],在自然界广泛分布,它不仅引起食品污染,还对人类健康造成威胁,是人畜共患病原微生物[2-3]。在中国,细菌性食物中毒事件中,由金黄色葡萄球菌引起的食物中毒占较大比例[4],因此杀灭金黄色葡萄球菌这一类致病菌成为防控食品中毒和空气致病菌的重要途径。
我国肉桂资源丰富,传统上作为抗菌防腐材料使用,其中主要是肉桂精油起作用。而肉桂醛是肉桂精油的主要成分[5],具有独特的肉桂香味和风味,它也是一种广谱抗菌剂,对大肠杆菌、沙门氏菌、金黄色葡萄球菌和芽孢杆菌等均有很好的抑制作用[6-8]。《食品安全国家标准 食品添加剂使用标准》(GB 2760-2014)中将肉桂醛批准为可在食品中使用的天然防腐剂[9]。美国食品药品管理局也将肉桂醛认定为一种安全的添加剂[6]。将肉桂醛用于食品和空气中来抑制、杀灭金黄色葡萄球菌,对食品等行业具有重要意义。
大多数抗菌研究是关于接触抑菌[10]。有研究证实[11]与接触抑菌相比,精油的气相抗菌效果更强。在相对较低的浓度下,气相精油可以抑制常见的致病菌,从而对食品的感官特性[10]及环境影响最小,还可以节约成本。对于抑菌机理的研究大多是对菌落群体抑菌机理的研究,很少针对单个菌体进行研究。激光镊子拉曼光谱(Laser tweezers Raman spectroscopy,LTRS)技术是一种将激光捕获和共聚焦拉曼光谱结合在一起,同时实现在悬浮液中对单细胞的捕获和拉曼测量的技术[12]。LTRS 技术最早于2002 年由黎永青教授用于生命科学的研究[13],目前它的应用主要集中在红细胞[14]、酵母细胞[15-16]、癌细胞[17],以及产物的动态变化[18]等方面研究,而LTRS 应用于精油抑菌机理的研究几乎没有。
本文用肉桂醛对金黄色葡萄球菌进行气相抗菌研究,用透射电镜观测单个菌体形态变化,对菌体进行激光镊子拉曼光谱检测,研究肉桂醛处理后菌体内生物大分子的动态变化。研究结果是基于单个细菌分子的平均数据,而非细菌群体数据。本研究同时为精油的抗菌机理提供一种新的思路。
1 材料与方法
1.1 材料与试剂
金黄色葡萄球菌ATCC 6538(Staphylococcus aureus),广东环凯微生物科技有限公司;营养琼脂,广东环凯微生物科技有限公司;肉桂醛,广州日化化工有限公司;Percoll 母液,Sigma 公司;Tris缓冲溶液,国药集团化学试剂有限公司。
1.2 仪器与设备
YXQ-50G 立式压力蒸汽高压灭菌机,上海博讯医疗生物仪器股份有限公司;SW-CJ-1FD 超净工作台,苏州智净精华设备有限公司;高速离心机(带角式转头),德国Hettich 科学仪器有限公司;激光镊子拉曼光谱系统,如文献[19]所述,由半导体激光器(SACHER,775~790 nm,500 mW)、倒置生物显微镜(TE2000U,Nikon)、拉曼光谱仪(SpectraPro2300i,Acton)、电荷耦 合器件(Spec-10,Princeton Instruments)、干涉陷波滤波器、摄照像机系统、台式电脑、系列透镜及监视显示器组成。
1.3 试验方法
1.3.1 菌种活化与等渗液制备 取金黄色葡萄球菌接种于固体培养基中,置于37 ℃的恒温培养箱中培养24 h,划线培养使得单个菌落在营养琼脂平板上分离,挑取单个菌落配制成0.5 麦氏单位(1.5×108CFU/mL)的菌悬液。
Percoll 母液与1.5 mol/L 无菌NaCl 溶液按9∶1(体积比)配制成Percoll 等渗贮备液,备用。
1.3.2 肉桂醛对金黄色葡萄球菌的气相熏蒸处理
将50 μL 金黄色葡萄球菌菌悬液加入冷却凝固的营养琼脂培养基,用涂布棒涂布均匀,然后将培养基放入37 ℃的培养箱中倒置培养24 h,此时,平板长满菌落,吸取0.40 mL 不同浓度的肉桂醛(1,2-丙二醇稀释)滴加到培养皿的皿盖中央,使肉桂醛在培养皿中达到不同的空间浓度,培养皿用封口膜密封,置于37 ℃的培养箱中倒置培养不同时间后,用Tris 缓冲溶液收集分离菌体并做后续检测,空白对比用1,2-丙二醇代替肉桂醛。
1.3.3 肉桂醛气相熏蒸金黄色葡萄球菌活性的测定 利用1.3.2 节方法并参考文献[20],通过平板涂布方法和菌块测定肉桂醛气相作用于金黄色葡萄球菌的最低抑菌浓度(Minimum inhibitory concentration,MIC)与最低杀菌浓度(Minimum bactericidal concentration,MBC)。
1.3.4 肉桂醛气相熏蒸金黄色葡萄球菌透射电镜(TEM)试验 金黄色葡萄球菌经过肉桂醛熏蒸后,参考文献[20]进行处理,利用TEM 对金黄色葡萄球菌的微观结构进行观察并拍照。
1.3.5 菌液收集与细胞分离 利用改良的Percoll连续密度梯度离心方法分离同步化金黄色葡萄球菌[16],首先以Percoll 等贮备液为100%原液,在Percoll 等渗液中分别加入Tris 溶液(pH 7.5,50 mmol/L),配成90%,80%,70%,60%,50%,40%,30%,20%的系列梯度Percoll 溶液作为分离介质,测试结果表明,在90%的Percoll 溶液中能够得到金黄色葡萄球菌有效的分层细菌。吸取100 μL 收集的菌液缓慢平铺到90%的Percoll 分离介质上,400×g 下离心30 min。离心后Percoll 溶液分为上、下两层,用注射器插入离心管下端,缓慢吸取Percoll 溶液的下层溶液至2 mL 离心管中,加入Tris溶液,20 ℃下12 000 r/min 离心3 min,倒掉上清液,保留沉淀,重新加入Tris 溶液混匀,重复上述离心洗涤过程3 次,最终加入Tris 溶液悬浮,并放4 ℃冰箱保存,作为同步化的待测菌体。
1.3.6 拉曼信号的测定 参考文献[16]的方法,打开激光拉曼系统,吸取一定样品到载玻片上,并将样品放入载物台。拉曼光谱系统以15 mW 的激发功率和780 nm 的波长激发,激光经过滤波后进入显微镜,在100 倍物镜下进行拉曼光谱测量。在系统没有抓取任何颗粒的状态下,收集5 个背景光谱,并计算背景的平均光谱曲线。再移动载物台在样品池内抓取细胞进行测量,每个细胞的扫描时间为60 s,每组收集30 个同步细胞的拉曼光谱,计算平均拉曼光谱,此时的光谱曲线减去背景平均光谱曲线即为该细胞的拉曼光谱曲线。
1.3.7 拉曼光谱图的数据处理 用激光镊子拉曼系统自带软件WinSpec32 将测量得到的数据转换为ASCII 数据并导出。用Matlab 自编程序和Raman Baseline 程序对数据基线进行校正,将校正后的数据导入Origin 2018 处理并绘制菌体平均光谱曲线。
2 结果与分析
2.1 肉桂醛对金黄色葡萄球菌气相抗菌活性的研究
根据试验方法,平板长菌情况如表1 所示。

表1 肉桂醛对金黄色葡萄球菌的气相抑制作用Table 1 Gas-phase inhibitory effect of cinnamaldehyde on S.aureus
由表1 可知,肉桂醛气相熏蒸金黄色葡萄球菌的最低抑菌浓度(MIC)为0.25 μL/mL。根据试验方法,采用菌块转移法得到肉桂醛浓度为0.25 μL/mL 对应的菌块菌斑为6.5 mm,而肉桂醛浓度为0.5 μL/mL 及以上浓度对应的菌块菌斑依然是6 mm,由此可知,肉桂醛气相熏蒸金黄色葡萄球菌的最低杀菌浓度(MBC)为0.5 μL/mL。这与张赟彬等[21]的研究结果一致。
2.2 肉桂醛气相熏蒸金黄色葡萄球菌透射电镜(TEM)分析
由图1 可知,图1a 为未经处理的金黄色葡萄球菌透镜图,图中清晰可见未经肉桂醛处理的菌体胞膜光滑,细胞饱满,内容物均匀致密。图1b、1c 分别是经过1MIC、2MBC 的肉桂醛熏蒸处理的金黄色葡萄球菌透射电镜图,图中可见部分菌体胞膜皱缩,部分细胞内容物不均匀。有文献表明,肉桂醛是疏水性的,它可以透过细胞壁,从而破坏细胞质膜的结构[21]。正如透射电镜结果显示,肉桂醛改变了细胞膜的平滑形态,使菌体发生皱缩,而细胞膜结构的一点微小变化就可能引起生理代谢活动的变化[22],从而抑制细胞生长甚至导致死亡,这从形态学方面展示了肉桂醛对金黄色葡萄球菌的抗菌机理。

图1 不同浓度肉桂醛熏蒸处理的金黄色葡萄球菌透射电镜图Fig.1 TEM microgragh of S.aureus treated with different concentration of cinnamaldehyde
2.3 不同浓度的肉桂醛气相熏蒸对单个金黄色葡萄球菌菌体的影响
利用不同浓度的肉桂醛(空间浓度为0.25,0.5,1.0 μL/mL)处理金黄色葡萄球菌,处理时间为24 h,选择拉曼位移为600~1 800 cm-1的数据,用Origin 绘制拉曼光谱图并对峰进行标记,不同浓度肉桂醛处理与空白对照的金黄色葡萄球菌激光镊子拉曼光谱如图2 所示。
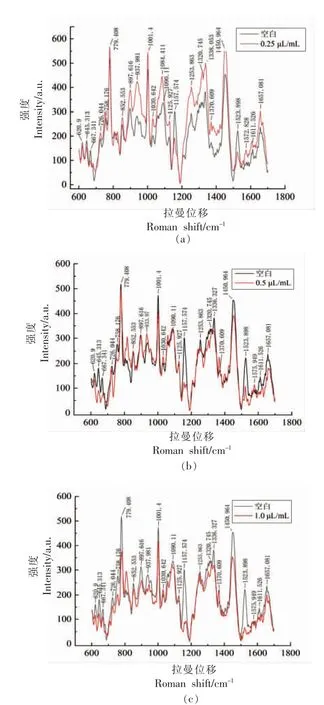
图2 不同浓度肉桂醛熏蒸下的金黄色葡萄球菌平均拉曼光谱图Fig.2 Average Raman spectra of S.aureus treated with different concentration of vapor phase cinnamaldehyde
图2 中的空白曲线是经过正常生长48 h 的金黄色葡萄球菌的拉曼光谱曲线,试验组分别是培养24 h 后再经过不同空间浓度(0.25,0.5,1.0 μL/mL)肉桂醛熏蒸24 h 的金黄色葡萄球菌的拉曼光谱曲线。对图中金黄色葡萄球菌的拉曼特征峰进行归属[15,18,23-25],如表2 所示。

表2 金黄色葡萄球菌主要拉曼光谱信号归属Table 2 Main Raman spectral signal assignment of S.aureus
2.3.1 金黄色葡萄球菌胞内生物大分子的变化细胞内每种生物大分子的不同基团都可能产生拉曼散射,且拉曼散射强度与激发区域内物质分子的含量成正比[26]。由表2 可知,归属于蛋白质的特征峰有:620,645,667,726,758,852,897,938,1 001,1 030,1 126,1 254,1 320,1 336,1 370,1 450,1611,1 657 cm-1。拉曼光谱中蛋白质主链构象主要由CC 骨架振动、C-N 伸缩振动以及C-H 变形和CH2弯曲振动引起,侧链构象则是来自芳香族氨基酸残基,例如色氨酸和酪氨酸的呼吸振动、脯氨酸侧链振动以及C-S 的伸缩振动,在众多的特征峰中,1 001 cm-1是反映菌株细胞体内生物大分子含量变化的重要参考,该特征峰由苯丙氨酸残基产生,吸收强度高,易于辨认,在800~1 200 cm-1并无类似特别突出的峰值,是判断菌细胞体内蛋白质变化的重要依据;归属于核酸的特征峰有:667,726,758,779,898,1 090,1 158,1 320,1 336,1524,1576 cm-1;归属于脂类的特征峰有:1 090,1 126,1 450 cm-1;归属于碳水化合物的特征峰有:852,898,1 090,1 126,1 370 cm-1。
图2a 知,经过24 h,0.25 μL/mL 的肉桂醛气相熏蒸的金黄色葡萄球菌拉曼谱图中,除了归属于蛋白质和核酸的645,667,1 158,1 524 cm-1几处峰强比空白组低,其余所有的特征峰峰强都比空白组高;图2b 中,经过0.5 μL/mL 的肉桂醛气相熏蒸的菌体拉曼光谱,在852,1126,1 370,1 576 cm-1处的特征峰高于空白组,其余特征峰的峰强都低于空白组;图2c 中,经过1 μL/mL 的肉桂醛气相熏蒸的菌体拉曼光谱,除了1 030,1 370 cm-1处特征峰强度比空白组高,其余特征峰的峰强都明显低于空白组。由此可见,金黄色葡萄球菌体内的蛋白质、脂类、核酸以及碳水化合物经过不同浓度肉桂醛熏蒸后,几种大分子含量变化趋势大体一致。
有研究表明[27],在存在亚致死浓度的精油或其它抗菌化合物时,微生物通过增加应激反应蛋白的表达来进行反应,以修复受损蛋白。由此推断,低浓度的肉桂醛熏蒸金黄色葡萄球菌时,细菌的生长环境发生了改变,胞内大分子随着生长环境的变化而变化,蛋白等大分子含量升高是细菌对生长环境做出的应激反应。而当精油或其它天然抗菌剂的浓度较高时,这种反应无法防止细胞死亡。随着肉桂醛熏蒸浓度的增加,金黄色葡萄球菌在最低杀菌浓度(0.5 μL/mL)处理下,生长和代谢活动都受到了肉桂醛的影响,胞内大分子的正常生理活动被抑制,细胞出现死亡,故所测得的大分子含量比正常培养情况下低。Zhang 等[28]研究表明,肉桂醛处理可能导致金黄色葡萄球菌的细胞膜裂解,使得胞内物质泄漏,这可能也是拉曼图谱测得几种大分子含量明显降低的原因。图2c 中,肉桂醛熏蒸浓度越高(1.0 μL/mL),菌体的拉曼峰强度越低,说明对应的生物大分子含量更低,揭示了高浓度的肉桂醛气熏使得胞内物质流失越多,可能由于细胞膜损伤更严重。
2.3.2 金黄色葡萄球菌胞内生物大分子特征拉曼光谱分析 由图2 和表2 可知,归属于色氨酸的吲哚环在1 370 cm-1处的谱线在肉桂醛处理前、后均呈现出小而尖锐的峰形,说明色氨酸残基是“埋藏”的,经过肉桂醛处理后,菌体拉曼谱线强度均比空白要高,说明色氨酸经处理后更趋于“埋藏”态。酪氨酸的对羟基苯基环的呼吸振动和环平面外弯曲振动的倍频之间的费米共振引起的850 cm-1和830 cm-1的双峰是构象灵敏的谱线,随侧链微环境而变[23]。由图2 可明显观察到肉桂醛处理前、后强度比I850/830的比值≥1 时,说明酪氨酸是“暴露”的,经过计算发现,肉桂醛杀菌浓度以上处理后,I850/830的比值比空白要低,说明菌体被肉桂醛杀灭时酪氨酸更趋于“埋藏”态。研究表明[29-30],拉曼峰1 450 cm-1处强度降低与脂肪族氨基酸暴露有关,由图2 可知,在肉桂醛杀菌浓度以上处理后,1 450 cm-1的峰强低于空白,表明肉桂醛处理后更趋于“暴露”态。上述结果表明经肉桂醛处理后,氨基酸残基可能参与了分子间或分子内的相互作用,使蛋白质的三级结构发生改变,从而使部分菌体蛋白质变性。其余归属于菌体蛋白质主链构象和侧链构象的拉曼光谱强度均有不同程度的改变,也说明经过肉桂醛熏蒸后的菌体蛋白主链、氢键体系以及空间结构发生变化。
归属于菌体DNA 磷酸离子PO2-对称伸缩振动谱线1 090 cm-1是构象不灵敏的谱线,可以作为内标使用[31],经过肉桂醛杀菌以上浓度熏蒸后,其强度下降并且位移到1 084 cm-1处,说明DNA 发生单、双链的断裂;属于DNA 磷酸二酯PO2对称伸缩振动谱线779 cm-1是构象灵敏的,经过肉桂醛杀菌以上浓度熏蒸,其强度也有所下降,同样表明了DNA 发生单、双链的断裂。归属于鸟嘌呤和腺嘌呤环的C=C,C=N 伸张振动的谱线强度1 573 cm-1经过肉桂醛熏蒸后位移到1 576 cm-1,并且在最低杀菌浓度熏蒸下,强度变化率为正值,可能是由于精油损害了垂直的碱基-碱基堆积相互作用的结果[23]。其余归属于核酸的拉曼谱线强度经过肉桂醛杀菌以上浓度熏蒸后均有不同程度的下降,且随浓度增加拉曼峰强度下降的更多,表明肉桂醛对大部分核酸的损伤程度因浓度增加而增大。
同样也归属于碳水化合物C-O-C 糖苷键的谱线1 090 cm-1经过肉桂醛杀菌以上浓度熏蒸后,强度下降并且发生位移,说明碳水化合物中的CO-C 糖苷键可能被修饰,其余归属于碳水化合物谱线的强度经肉桂醛处理后,也有不同程度的变化,说明肉桂醛可引起单糖或多糖C-C 键,C-OC 糖苷键等的变化,从而对菌体的信息传递或代谢免疫造成影响[23]。
归属于类脂的CH2、CH3弯曲振动在1 450 cm-1的谱线是构象不灵敏的,当肉桂醛抑菌浓度处理菌体时,1 450 cm-1处强度高于空白,说明脂酰基链骨架发生了交联,当肉桂醛杀菌及以上浓度处理菌体时,1 450 cm-1处强度低于空白,说明脂酰基链骨架发生了断裂。1 126,1 090 cm-1归属于C-C 骨架全反式键振动模式和扭曲旋转,它们的强度比反映出脂双层的纵向有序度[23],代入公式(Strans=(I1126/I1090)/1.77)计算出纵向有序度参数Strans分别为0.332(空白),0.334(0.25 μL/mL),0.35(0.5 μL/mL),0.305(1 μL/mL),随着肉桂醛处理浓度的增加,菌体脂双层的有序度升高,流动性降低,而当肉桂醛浓度为2MBC 时,脂双层有序度降低,膜流动性升高。
2.4 金黄色葡萄球菌蛋白二级结构特征拉曼光谱分析
对于蛋白质的拉曼谱图,其二级结构的归属主要分为:1 645~1 660 cm-1是α-螺旋,1 680~1 690 cm-1是β-转角,1 670~1 680 cm-1是β-折叠,1 660~1 670 cm-1是无规则卷曲[32]。将拉曼光谱经过拟合后,根据不同位移对应的面积区域,可以计算出蛋白二级结构的相对含量,表3 是经过肉桂醛熏蒸的金黄色葡萄球菌菌体蛋白二级结构含量。
二级结构是肽链主链骨架原子的相对空间位置,不涉及残基侧链,维系二级结构的化学键主要是氢键[33]。由表3 可知,经过0.25 μL/mL 肉桂醛熏蒸,金黄色葡萄球菌菌体蛋白中α-螺旋含量有一个明显的升高,反映了在抑菌浓度下,经过肉桂醛熏蒸后的金黄色葡萄球菌蛋白质分子趋于致密[20],之后,随着熏蒸浓度的升高,α-螺旋含量降低;β-折叠经肉桂醛熏蒸其含量均高于空白,β-转角则随着气熏浓度升高,其含量有一个逐渐上升的变化趋势,无规则卷曲经肉桂醛熏蒸,其含量均低于空白。由此可知,经过肉桂醛的熏蒸,金黄色葡萄球菌蛋白二级结构发生了改变,氢键体系发生变化,分子主链的有序结构改变,无规则卷曲减少,β-折叠和β-转角增加,二级结构的改变必然进一步影响蛋白质三级结构,从而影响蛋白质的功能。
2.5 肉桂醛不同熏蒸时间对金黄色葡萄球菌胞内生物大分子的影响
肉桂醛在空间浓度MIC(0.25 μL/mL)和MBC(0.50 μL/mL)下熏蒸金黄色葡萄球菌,每6 h 采集1 次拉曼信号,观察其细胞体内生物大分子的含量变化,分别绘制拉曼光谱曲线如图3 所示。
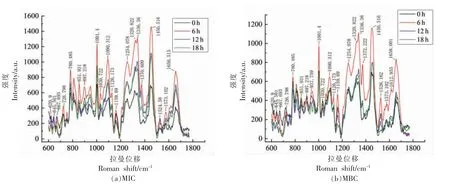
图3 金黄色葡萄球菌在不同浓度肉桂醛熏蒸下不同时间的平均拉曼光谱图Fig.3 Average Raman spectra of S.aureus treated with different concentration of vapor phase cinnamaldehyde at different times
特征峰吸收强度越高,其代表的分子含量越高。从图3 可以看出,随着肉桂醛熏蒸时间的延长,金黄色葡萄球菌在两种熏蒸浓度下,拉曼峰值均呈先升后降的趋势,在肉桂醛熏蒸6 h 时,菌体的拉曼曲线峰值大部分比初始有所升高,推断菌体受到肉桂醛熏蒸后,在6 h 左右发生应激反应,快速合成新陈代谢所需的各类物质,导致几种生物大分子含量增加。当肉桂醛熏蒸时间达到12 h以上时,各拉曼峰值都出现了显著降低,推测MBC 和MIC 下,肉桂醛对菌体的破坏已经不能进行逆转,菌体细胞膜受损,导致胞内大分子物质流出,从而使其含量降低。作用12 h 与18 h 的拉曼强度变化相对较小,由此推断,熏蒸6~12 h 是肉桂醛气相抑制或杀死细菌的关键作用时间段。
3 结论
关于肉桂醛抗菌机理的研究很多,米嘉琦等[34]认为肉桂醛的抑制机理是通过影响细胞膜的通透性和完整性,进而导致细胞死亡。何学文等[35]的研究表明,肉桂醛抑制菌体蛋白质代谢,破坏菌体正常形态,增加细胞膜和细胞壁通透性。Rogiers等[36-38]的研究表明,肉桂醛能影响细菌细胞膜上脂肪酸的分布和连接,改变膜流动性,抑制生物膜形成。这些研究大都是对肉桂醛的直接接触抗菌机理的研究,很少涉及到气相抗菌机理的研究,且大部分是针对微生物群体的研究。本文研究了肉桂醛的气相抗菌机理,分离同步细胞,对研究的菌体进行了统一,且通过激光镊子拉曼捕获的是单个菌体细胞的拉曼信号。
本文通过气相熏蒸与菌块转移方法,研究了肉桂醛对金黄色葡萄球菌的气相抗菌作用,通过TEM 检测发现,肉桂醛处理可导致菌体细胞形态发生改变,通过拉曼光谱位移与峰强分析,肉桂醛气相熏蒸可导致金黄色葡萄球菌菌体蛋白质、核酸、碳水化合物、脂类等大分子的含量与结构发生变化,通过归属峰的分析可知,精油处理导致菌体蛋白主链、氢键体系以及空间结构的变化,DNA发生单、双链的断裂,脂酰基链骨架发生断裂或交联,同时,菌体脂双层的有序度也因精油的不同浓度处理而发生改变,从而影响膜的流动性。结果表明,利用激光镊子拉曼光谱研究精油的抗菌机理是可行的,可以从分子含量和结构变化分析菌体的变化,从而得出可能的抗菌机理。

