藤黄健骨胶囊通过SIRT1/NF-κB/NLRP3信号通路调节绝经后骨质疏松大鼠破骨细胞分化*
安方玉, 颜春鲁, 孙柏, 汪春梅, 柳颖, 王霞霞, 马海珍, 张蕊, 陈振东
(甘肃中医药大学,甘肃 兰州 730000)
绝经后骨质疏松症(postmenopausal osteoporosis, PMOP)是一种骨折发生率极高的常见骨病[1-2]。围绝经期的女性由于卵巢功能下降使雌激素分泌急剧下降,而雌激素分泌急剧下降导致骨吸收加速和骨形成减少可能是诱发PMOP发生的关键病机[3-4]。
研究表明,沉默信息调节因子1(silent information regulator 1, SIRT1)能够参与机体的骨代谢、自噬、细胞凋亡和衰老等生物学过程[5-6]。另有研究表明SIRT1具有类雌激素的作用,在多种骨系细胞(破骨细胞、成骨细胞和骨细胞等)中均有表达[7],抑制SIRT1表达可以促进核因子κB受体活化因子配体(receptor activator of nuclear factor-κB ligand, RANKL)诱导的骨髓巨噬细胞(bone marrow-derived macrophages,BMM)向破骨细胞分化[8],而破骨细胞祖细胞中的SIRT1还能够通过抑制核因子κB(nuclear factor-κB, NF-κB)活性来抑制其自身分化[9]。其他研究进一步发现,SIRT1对破骨细胞生成的抑制是通过NF-κB通路和氧化应激相互作用而介导的,这些途径最终激活活化T细胞核因子胞浆1型(nuclear factor of activated T-cells cytoplasmic 1,NFATc1)以诱导破骨细胞生成和破骨细胞融合。还有研究证明,NF-κB抑制剂显著降低核苷酸结合寡聚化结构域样受体蛋白3(nucleotide-binding oligomerization domainlike receptor protein 3, NLRP3)炎症小体表达水平,缓解骨吸收[10]。上述研究提示SIRT1/NF-κB/NLRP3介导的破骨细胞分化可能是治疗PMOP潜在靶点。
藤黄健骨胶囊[Tenghuang-Jiangu capsule, TJC;熟地黄、鹿衔草、骨碎补(烫)、肉苁蓉、淫羊藿、鸡血藤和莱菔子]具有补肾活血之功效。临床研究发现,TJC通过提高PMOP患者的骨密度和抑制骨转换来改善患者的中医临床症状积分,达到治疗PMOP的目的,且临床疗效明显[11-12]。也有研究报道,TJC可提高血钙水平,还可降低血液黏稠度,抑制血小板聚集,从而提高骨密度,也可能通过降低破骨细胞的活性、功能抑制骨吸收、促进成骨细胞形成来治疗骨质疏松症、膝骨关节炎及腰椎间盘突出等疾病[13-15]。上述文献结果证明TJC对PMOP有明确疗效。基于此,我们提出如下假设:TJC可能通过抑制SIRT1/NF-κB/NLRP3信号通路来抑制PMOP的炎症反应,进而来抑制破骨细胞分化,从而发挥对PMOP的潜在疗效。因此,本研究通过建立PMOP大鼠模型,旨在探讨TJC对PMOP大鼠SIRT1/NF-κB/NLRP3信号通路关键蛋白表达的影响及可能的分子机制。
材料和方法
1 动物
70只SPF级SD雌性大鼠,体质量(180±20) g,购自甘肃中医药大学科研实验动物中心,许可证号为SCXK(甘)2020-0001。饲养于甘肃中医药大学动物实验中心SPF级实验室,实验过程中所有动物均自由饮水、摄食。
2 主要试剂
戊酸雌二醇(estradiol valerate, ESV)片购自拜耳医药保健有限公司;TJC购自甘肃省西峰制药有限公司;SIRT1抑制剂EX-527购自MedChemExpress;SIRT1兔单克隆抗体购自Abcam;NF-κB p65兔单克隆抗体购自GeneTex;NLRP3兔单克隆抗体和GAPDH兔单克隆抗体购自Immunoway;NFATc1兔单克隆抗体购自Abclonal;ECL化学发光显色试剂盒购自YEASEN;白细胞介素1β(interleukin-1β, IL-1β)ELISA试剂盒、IL-18 ELISA试剂盒和肿瘤坏死因子α(tumor necrosis factor-α, TNF-α) ELISA试剂盒购自FEIYA。
3 主要方法
3.1 实验动物分组及给药 选取60只SPF级SD雌性大鼠,适应性饲养1周,随机分为假手术组(sham组)、模型组[卵巢切除术(ovariectomy, OVX)组]、SIRT1抑制剂组(EX-527+OVX组)、阳性药物对照组(ESV+OVX组)、高剂量(0.36 g/kg)TJC(high-dose TJC, TJC-H)组、中剂量(0.18 g/kg)TJC(mediumdose TJC, TJC-M)组和低剂量(0.09 g/kg)TJC(lowdose TJC, TJC-L)组,每组10只。大鼠麻醉后,采取俯卧位,备皮后消毒手术区皮肤;沿背部后正中线作纵形切口长约1.0~1.5 cm,在乳白色的脂肪团中找到卵巢,结扎子宫角后摘除卵巢,然后伤口逐层缝合,同样方式切除对侧卵巢,而sham组大鼠只切卵巢附近白色脂肪组织,注意术后保温[16]。造模8周后,ESV+OVX组给予ESV片(0.09 mg/kg)灌胃治疗,TJC-H+OVX组、TJC-M+OVX组和TJC-L+OVX组给予TJC(0.36、0.18和0.09 g/kg)灌胃治疗,sham组和OVX组给予等体积蒸馏水,EX-527+OVX组给予等体积蒸馏水并腹腔注射1 mg/kg EX-527[17],每日1次,连续8周[18]。给药结束后进行股动脉取血,离心血清,处死大鼠,进行标本采集,部分股骨组织用4%多聚甲醛固定液固定,部分股骨组织于-80 ℃冰箱冻存、备用。
3.2 实验大鼠一般状态及体重的观察 观察并记录各组大鼠的饮水进食、活动情况、精神状态、毛色变化等一般情况,定期称重并记录大鼠体重。
3.3 ELISA法检测血清中炎症因子的含量 将采集的股动脉血静置2 h后再置于冰箱4 ℃过夜,1 500~2 000 r/min离心5 min,取上清测定血清IL-1β、IL-18和TNF-α水平变化。根据IL-1β、IL-18和TNF-α大鼠ELISA检测试剂盒说明书,首先分别设置空白孔(不加样品和酶标记试剂)、标准孔(标准品50 μL)和样品孔(样品10 μL+样品稀释剂40 μL),37 ℃恒温箱中恒温孵育30 min并洗涤,然后每孔加入50 μL酶标试剂,37 ℃恒温箱中再次恒温孵育30 min并洗涤并洗涤,每孔均加入显色剂A(50 μL)和显色剂B(50 μL),37 ℃恒温箱内避光孵育10 min后加入终止液(50 μL),450 nm波长处检测各孔的吸光度(A值)。依据标准品绘制出标准曲线,再根据标准曲线和A值算出IL-1β、IL-18和TNF-α的含量。
3.4 双重免疫荧光观察破骨细胞中SIRT1、NF-κB p65和NLRP3蛋白表达 TRAP为破骨细胞特异性标志物,故采用双重免疫荧光双染的方法分别检测各组大鼠股骨组织中TRAP蛋白分别与SIRT1、NF-κB p65和NLRP3蛋白共表达的情况,来反映破骨细胞中SIRT1、NF-κB、NLRP3蛋白的表达,具体操作方法如下:3%的H2O2避光10 min,PBS-Triton洗3次,每次3 min;100 mmol甘氨酸中和15 min,PBS-Triton洗3次,每次3 min;滴加封闭液,室温封闭1 h;弃去封闭液后,在切片组织上同时滴加TRAP抗体(1∶100)和SIRT1(1∶100)/NF-κB p65(1∶500)/NLRP3(1∶200)抗体后4 ℃孵育过夜;用PBS-Triton洗3次,每次3 min,在切片组织上滴加Ⅱ抗,室温避光孵育l h,再用PBS-Triton洗3次,每次3 min;然后用DAPI染核3 min,再用PBS-Triton洗3次,每次3 min;最后用抗荧光淬灭剂封片;荧光倒置扫描显微镜观察并拍照,ImageJ分析数据。TRAP呈绿色,SIRT1/NF-κB p65/NLRP3呈红色,DAPI细胞核呈蓝色,双染的共定位阳性细胞经叠加后呈黄色。
3.5 RT-qPCR检测股骨组织中NF-κB p65、NLRP3和NFATc1的mRNA表达 往100 mg大鼠股骨组织中加入Trizol试剂以制备RNA,逆转录试剂盒合成cDNA,在7500型实时PCR系统上使用实时荧光定量试剂盒进行RT-qPCR。PCR扩增条件设置为:95 ℃ 5 min;95 ℃ 10 s,55 ℃ 20 s,72 ℃ 20 s,循环40次。根据各组Ct值,通过2-ΔΔCt计算各组mRNA相对表达量,重复3次。引物序列见表1。

表1 引物序列Table 1. Sequences of the primers
3.6 Western blot检测股骨组织中各组NF-κB p65、NLRP3和NFATc1的蛋白表达 往100 mg大鼠股骨组织加入蛋白裂解液提取其总蛋白,后用BCA法测浓度,继之间上述蛋白样品进行电泳、转膜、封闭及加入Ⅰ抗(NF-κB p65、NLRP3和NFATc1抗体)摇床上孵育过夜,孵育条件设置为4 ℃;次日TBST洗膜后加入Ⅱ抗孵育,孵育条件设置为37 ℃ 1 h;TBST洗膜后按1∶1的比例在PVDF膜上滴加显影液,用凝胶成像分析系统拍照。用ImageJ软件进行处理与分析。
4 统计学处理
用GraphPad Prism 9软件进行统计分析。数据以均数±标准差(mean±SD)表示。符合正态分布和方差齐性检验的数据选择单因素方差分析;不符合正态检验条件的数据采用秩和检验。以P<0.05为差异有统计学意义。
结果
1 TJC对PMOP大鼠一般状况和体重的影响
造模8周后(首次给药前),sham组饮食饮水如常,活动如常,反应灵敏,毛色光亮;OVX、EX-527+OVX、ESV+OVX、TJC-H+OVX、TJC-M+OVX和TJCL+OVX组大鼠进食饮水频繁、活动频率降低、反应欠灵敏(如抓取时)、垫料更换后浸湿速度增快。造模16周后(TJC干预8周后即末次给药后),sham组饮食饮水如常,活动如常,反应灵敏,毛色光亮;OVX、EX-527+OVX、ESV+OVX、TJC-H+OVX、TJC-M+OVX和TJC-L+OVX组大鼠活动频率明显减少,其中OVX、EX-527+OVX和TJC-L+OVX组大鼠毛发欠光泽、部分大鼠颈部背侧毛发出现脱落,ESV+OVX、TJC-H+OVX和TJC-M+OVX组大鼠反应较好,毛发无明显脱落,进食量和饮水量饮水量稍有减少,尤以ESV+OVX组及TJC-H+OVX组大鼠上述一般状况的改善程度最为明显。
造模8周后(首次给药前),与sham组相比,OVX、EX-527+OVX、ESV+OVX、TJC-H+OVX、TJCM+OVX和TJC-L+OVX组大鼠体重均显著增加(P<0.05)。造模16周后(TJC干预8周后即末次给药后),与sham组相比,OVX和EX-527+OVX组大鼠体重显著增加(P<0.05);与OVX组相比,ESV+OVX和TJC-H+OVX组大鼠体重均显著降低(P<0.05);与EX-527+OVX组相比,ESV+OVX、TJC-H+OVX和TJC-M+OVX组大鼠体重均显著降低(P<0.05)。见图1。

Figure 1. Body weight changes of the rats in each group. Mean±SD. n=10. △P<0.05, △△P<0.01 vs sham group; *P<0.05, **P<0.01 vs OVX group; ▲P<0.05, ▲▲P<0.01 vs EX-527+OVX group.图1 各组大鼠体重变化结果
2 TJC对PMOP大鼠炎症因子含量的影响
与sham组相比,OVX和EX-527+OVX组大鼠血清IL-1β、IL-18和TNF-α含量显著增加(P<0.01);与OVX组相比,ESV+OVX和TJC-H+OVX组大鼠血清IL-1β含量显著降低,ESV+OVX、TJC-H+OVX和TJCM+OVX组大鼠血清IL-18含量显著降低,ESV+OVX、TJC-H+OVX、TJC-M+OVX和TJC-L+OVX组大鼠血清TNF-α含量显著降低(P<0.05);与EX-527+OVX组相比,ESV+OVX、TJC-H+OVX和TJC-M+OVX组大鼠血清IL-1β和IL-18含量显著降低,ESV+OVX、TJC-H+OVX、TJC-M+OVX和TJC-L+OVX组大鼠血清TNF-α含量也显著降低(P<0.05),见表2。
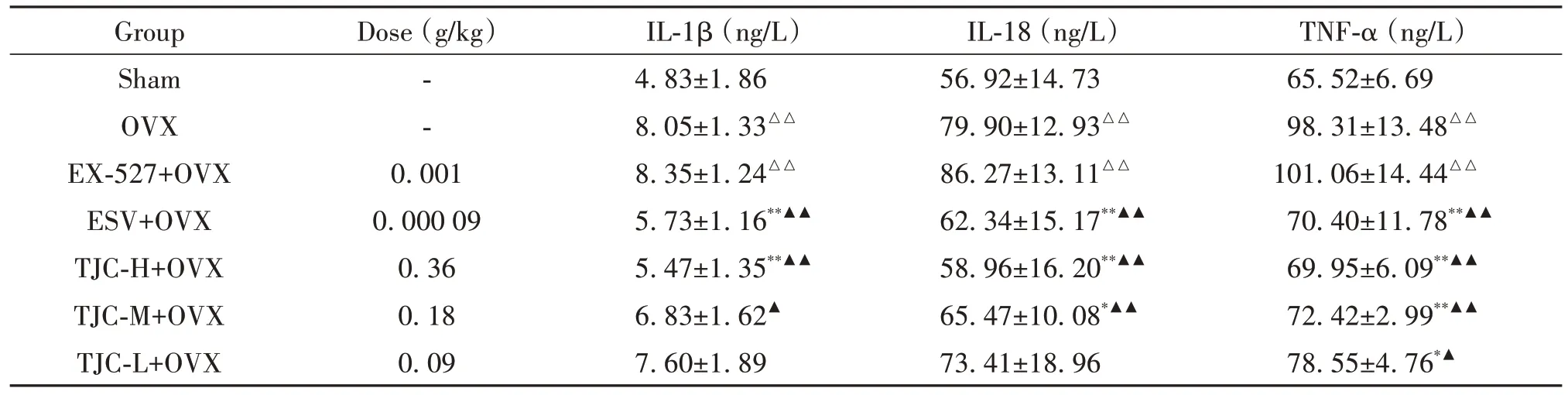
表2 各组大鼠血清炎症因子含量变化比较Table 2. Comparison of serum content of inflammatory factors in each group (Mean±SD. n=10)
3 TJC对PMOP大鼠破骨细胞SIRT1、NF-κB p65和NLRP3荧光表达强度的影响
与sham组相比,OVX和EX-527+OVX组大鼠破骨细胞中SIRT1表达荧光面积显著降低,而NF-κB p65和NLRP3表达荧光面积显著升高(P<0.01);与OVX组相比,ESV+OVX、TJC-H+OVX、TJC-M+OVX和TJC-L+OVX组大鼠破骨细胞中SIRT1表达荧光面积显著升高,而NF-κB p65和NLRP3表达荧光面积显著降低(P<0.01);与EX-527+OVX组相比,ESV+OVX、TJC-H+OVX、TJC-M+OVX和TJC-L+OVX组大鼠破骨细胞中SIRT1表达荧光面积显著升高,而NF-κB p65和NLRP3表达荧光面积显著降低(P<0.01),见图2。

Figure 2. Immunofluorescence intensity changes of SIRT1, NF-κB p65 and NLRP3 in the osteoclast of each group. The scale bar=50 μm. Mean±SD. n=3. △△P<0.01 vs sham group; **P<0.01 vs OVX group; ▲▲P<0.01 vs EX-527+OVX group.图2 各组大鼠破骨细胞中SIRT1、NF-κB p65和NLRP3免疫荧光强度变化
4 TJC对PMOP大鼠股骨组织NF-κB p65、NLRP3和NFATc1 mRNA表达的影响
与sham组相比,OVX和EX-527+OVX组股骨组织中NF-κB p65、NLRP3和NFATc1的mRNA表达水平显著升高(P<0.01);与OVX组相比,ESV+OVX、TJC-H+OVX、TJC-M+OVX和TJC-L+OVX组NF-κB p65、NLRP3和NFATc1的mRNA表达水平显著降低(P<0.01);与EX-527组相比,ESV+OVX、TJC-H+OVX、TJC-M+OVX和TJC-L+OVX组NF-κB p65、NLRP3和NFATc1的mRNA表达水平显著降低(P<0.01),见图3。

Figure 3. The mRNA expression of NF-κB p65, NLRP3 and NFATc1 in the femoral tissue of each group. Mean±SD. n=3. △△P<0.01 vs sham group; **P<0.01 vs OVX group; ▲▲P<0.01 vs EX-527+OVX group.图3 各组大鼠股骨组织中NF-κB p65、NLRP3和NFATc1 mRNA表达变化结果
5 TJC对PMOP大鼠股骨组织NF-κB p65、NLRP3和NFATc1蛋白表达的影响
与sham组相比,OVX组和EX-527+OVX组股骨组织中NF-κB p65、NLRP3和NFATc1蛋白表达明显升高(P<0.01);与OVX组相比,ESV+OVX组和TJCH+OVX组NLRP3蛋白表达明显降低,ESV+OVX组和TJC-H+OVX、TJC-M+OVX组NF-κB p65和NFATc1蛋白表达也均明显降低(P<0.05);与EX-527+OVX组相比,ESV+OVX组和TJC-H+OVX NLRP3蛋白表达明显降低,ESV+OVX组和TJC-H+OVX、TJC-M+OVX组NF-κB p65和NFATc1蛋白表达也均明显降低(P<0.05),见图4。
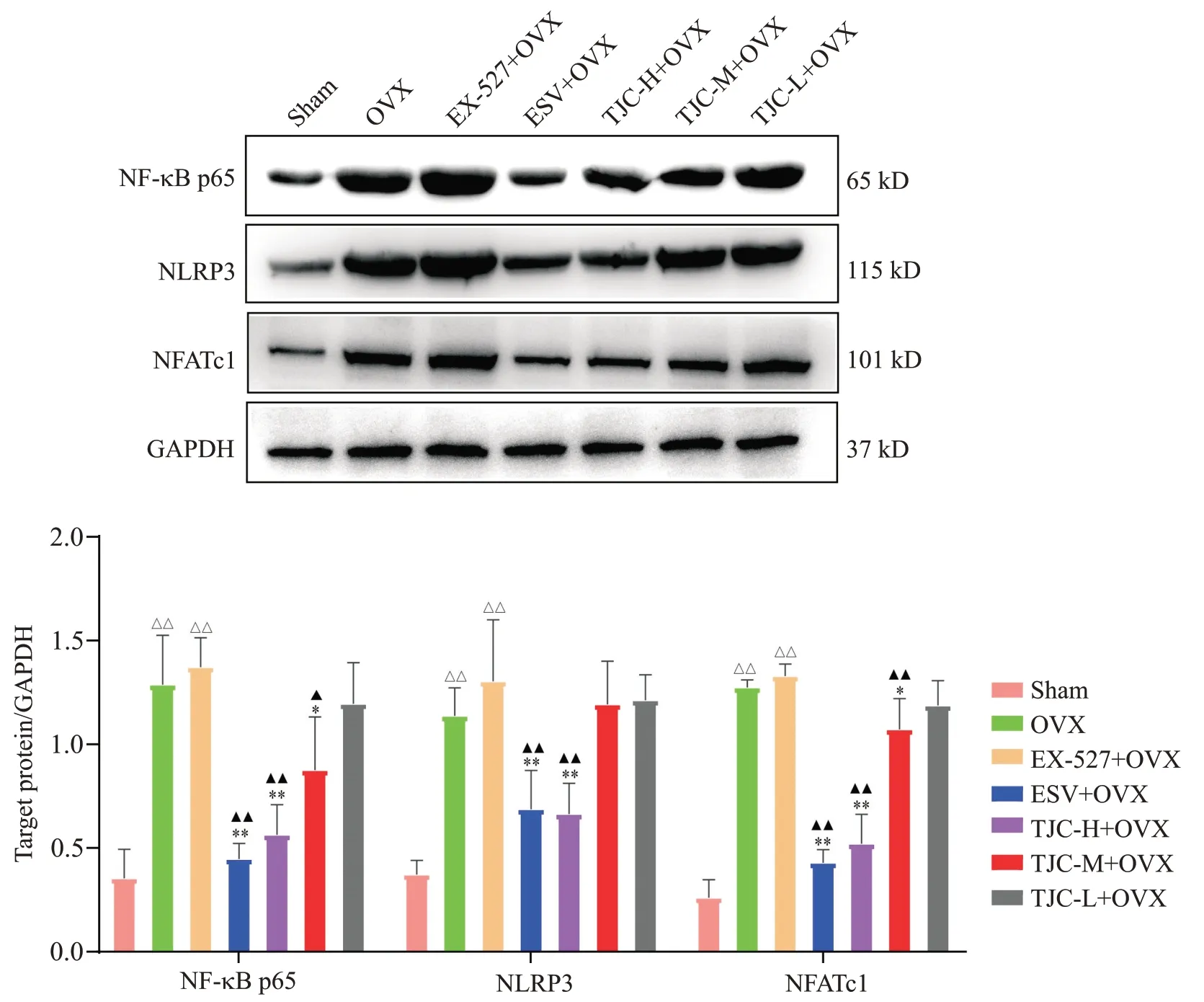
Figure 4. The protein expression of NF-κB p65, NLRP3 and NFATc1 in the femoral tissue of each group. Mean±SD. n=3. △△P<0.01 vs sham group; *P<0.05, **P<0.01 vs OVX group; ▲P<0.05, ▲▲P<0.01 vs EX-527+OVX group.图4 各组大鼠股骨组织中NF-κB p65、NLRP3和NFATc1蛋白表达变化结果
讨论
依据PMOP的主要病机“破骨细胞介导的骨吸收大于成骨细胞介导的骨形成”,目前临床上治疗PMOP的常用药物为骨吸收抑制剂和骨形成促进剂。骨吸收抑制剂包括雌激素、双膦酸盐和地诺单抗等;骨形成促进剂有钙剂、特立帕肽和阿巴帕肽等。这些西药治疗虽然能明显缓解患者的疼痛,减轻临床症状,但是存在一系列副作用。如雌激素长期服用会增加患者冠状动脉疾病、子宫内膜癌、乳腺癌和中风等疾病的发病率[19-22]。双磷酸盐长期服用患者会出现髋骨骨折、下颌骨坏死、胃肠道反应、低钙血症等副作用[23-25]。此外,大剂量的摄入钙可能导致便秘和肠胀气,也可增加心肌梗死和肾结石的患病风险[26];特立帕肽则是患者在停药后疗效会迅速丧失[27-28]。因此,寻找新的治疗策略成为PMOP亟待解决的问题。据报道,某些补肾中药复方可以通过抑制破骨细胞分化来防止PMOP引起的骨代谢紊乱[29]。TJC作为补肾壮骨的代表方药,因在PMOP治疗中的潜在作用而备受关注。
已有大量研究表明,炎症反应是促进破骨细胞生成参与骨质疏松症的重要途径[30-31]。PMOP患者由于雌激素缺乏会出现促炎细胞因子如IL-1、TNF-α和IL-6等分泌增多现象,使破骨细胞增殖和活性增强,进而打破了骨形成与骨吸收之间的动态平衡[32]。有研究已证明IL-1和TNF-α受体缺失型小鼠进行OVX,术后这类小鼠不会出现骨丢失现象[33],说明这些炎症因子和骨吸收密切相关。此外大量研究证明[34-36],TNF、M-CSF、NFATc 1等因子可以调控破骨细胞的来源和分化,其中NFATc 1被认为是破骨分化的特异性调节器[37]。本研究发现OVX组大鼠血清中IL-1β、IL-18和TNF-α的分泌明显增多,股骨组织中NFATc1的mRNA和蛋白表达显著,说明在PMOP中炎症反应促进了破骨细胞分化,这与上述研究结果相似。而TJC干预后IL-1β、IL-18和TNF-α的分泌显著降低,股骨组织中NFATc1的mRNA和蛋白表达显著降低,证明TJC通过抑制炎症因子的分泌正反馈抑制PMOP破骨细胞NFATc1的表达,最终达到抑制PMOP破骨细胞分化的目的。但是TJC通过抑制炎症因子的分泌正反馈抑制PMOP破骨细胞NFATc1的表达是通过什么样的网络信号来调控的,目前尚未具体阐明。
Gurt等[38]发现,SIRT1激活剂SRT2183能抑制破骨细胞分化成熟和功能,抑制了骨吸收过程。另有文献发现,橙皮苷升高SIRT1的表达可显着降低炎症介质NF-κB以及TNF-α、IL-1β和IL-6细胞因子水平,明显改善了骨丢失[39]。提示SIRT1可能是调控破骨细胞炎症反应的关键靶点。NF-κB信号通路是经典炎症信号通路,通过调控破骨细胞参与骨质疏松症的重要发生过程[40]。研究发现,SIRT1可通过抑制NF-κB信号通路阻止BMM向破骨细胞分化,从而抑制骨质疏松症的发生[9]。而NLRP3炎症小体激活的起始步骤也主要依赖于NF-κB通路,NF-κB抑制剂显著降低NLRP3炎症小体表达水平,缓解骨吸收[8]。NF-κB/NLRP3信号通路的激活刺激促炎细胞因子的产生[41],因此,NF-κB、NLRP3炎症小体作为炎症的上游信号,可介导炎症反应的发生[42]。本实验发现在OVX组大鼠股骨组织中NF-κB p65、NLRP3和NFATc1的mRNA和蛋白表达显著上升,而TJC干预后NF-κB p65、NLRP3和NFATc1的mRNA和蛋白表达显著降低;说明在OVX大鼠中激活NF-κB/NLRP3信号通路促进了NFATc1的生成,加速了破骨细胞的分化,而TJC逆转了这一现象。本实验也观察到OVX组大鼠破骨细胞中SIRT1荧光表达面积显著降低,而NF-κB p65和NLRP3的荧光表达面积显著升高;TJC干预后破骨细胞中SIRT1荧光表达面积显著上升,而NF-κB p65和NLRP3的荧光表达面积显著降低。这表明OVX大鼠可通过SIRT1/NF-κB/NLRP3信号通路介导炎症反应促进IL-1β、IL-18和TNF-α等炎症因子的释放,进一步促进破骨分化标志分子NFATc1的表达,从而促进OVX大鼠破骨细胞的分化。
综上所述,TJC通过调控SIRT1/NF-κB/NLRP3信号通路炎症因子的分泌来正反馈抑制破骨细胞分化标志分子NFATc1的表达,抑制PMOP破骨细胞的分化,从而纠正其骨代谢紊乱,为TJC防治PMOP的作用机制研究提供了实验证据。但目前研究仍然存在一些不足,本研究仅通过体内实验层面阐明了TJC抑制破骨细胞分化可能与SIRT1/NF-κB/NLRP3信号通路抑制有关,但在本研究中未使用SIRT1/NF-κB/NLRP3信号通路的相关抑制剂如SIRT1抑制剂,也未使用基因干扰技术并结合体外实验对TJC抑制破骨细胞分化的作用机制进行深入探讨。

