有氧运动对青年期小鼠海马体Cdc42及DNA损伤反应相关因子的短期和长期影响*
骆远, 宋诗语, 赵格,3, 彭爽, 李良鸣△, 刘淑靖△
(1广州体育学院,广东 广州 510500;2广州理工学院,广东 广州 510540;3广东科技学院,广东 东莞 523083)
随着生活水平的提高,人口老龄化已成为重要的社会问题。同时,随着年龄的增长与年龄相关的疾病患病率也会提高,如糖尿病、心血管疾病、神经退行性疾病和肿瘤等[1-2]。衰老是宏观的范畴,究其根本即细胞衰老。氧化应激、DNA损伤、端粒缩短和线粒体功能障碍等都参与细胞衰老过程[3-4]。DNA损伤反应(DNA-damage response, DDR)和修复机制是DNA损伤积累、细胞衰老和生物体衰老的关键机制。近年研究显示,细胞分裂周期蛋白42(cell division cycle protein 42, Cdc42)参与DDR和修复机制,其在维持基因组稳定及衰老过程中发挥重要作用[5-6]。Cdc42过度激活可引起基因组不稳定和过早衰老的表型[7];抑制Cdc42表达可使衰老的造血干细胞恢复到年轻时的状态[8]。以上证据表明,Cdc42活性与衰老之间存在功能联系。
海马体是学习记忆和认知功能的关键中枢,衰老可导致海马体神经元再生功能衰退,最终导致认知功能减退及多种神经退行性疾病的发生[9-11]。研究表明,运动有抗衰老的作用,其可刺激大脑可塑性,改善认知功能,避免多种神经退行性疾病的发生和进展[12-13]。而青少年时期的定期身体锻炼,在预防老年期认知障碍、提高大脑自我修复能力等方面也发挥重要的有益作用[14-15],但这种有益作用的机制尚未明确。因此,本研究构建运动小鼠模型,分析长期有氧运动对小鼠海马体Cdc42及DDR相关因子的短期和长期影响,探索运动引起Cdc42表达改变参与细胞衰老的机制,为青年期进行长期的体育锻炼可维持老年期大脑健康提供参考资料。
材料和方法
1 小鼠模型建立及分组
40只8周龄SPF级C57BL/6J雄性小鼠,体重20~25 g,购自广东省医学实验动物中心,生产许可证号为SCXK(粤)2018-0002。实验小鼠在清洁级动物房内分笼饲养。动物房温度控制在20~24℃,相对湿度控制在40%~70%,自由饮水和摄食。动物房内正常昼夜自然光照,定期观察小鼠的生活和毛发状况。本研究中动物饲养的要求和操作规范都符合中华人民共和国《实验动物管理条例》相关规定,并获得广州体育学院动物保护与使用专业委员会(2021DWLL-05)批准。
将40只小鼠随机分为安静组和运动组,每组20只,均使用普通饲料喂养。运动组小鼠参考既往文献造模方法[16],进行12周的中等强度(75% VO2max)跑台运动,每周运动5 d,每天运动1 h;安静组小鼠在不跑步的情况下暴露于跑步机噪声和振动中。12周训练结束后,从安静组和和运动组中随机选取小鼠各10只(5月龄),分别为安静青年期小鼠(Sedyoung)组和运动青年期小鼠(Exe-young)组,于运动干预结束后3 d收集数据及海马体组织;剩余的10只安静组小鼠和10只运动组小鼠继续喂养至老年期(18月龄)[17],分别为安静老年期小鼠(Sed-old)组和运动老年期小鼠(Exe-old)组,收集数据及海马体组织。
2 方法
2.1 小鼠体成分及Y迷宫测试 使用Echo MRI动物体成分仪(EchoMRI-500H)获取和分析小鼠体成分,包括体重、瘦体重和体脂率等,其应用原理为核磁共振(NMR)技术。
Y迷宫可评估小鼠的学习和空间记忆能力,而自主交替行为是衡量小鼠空间记忆能力的标准。参考既往文献中的Y迷宫自主交替实验方法[18],分析有氧运动对小鼠学习记忆能力的影响:以起始臂为起点,逆时针方向分别标记为A、B、C臂。调试Y迷宫周围的光照,通过摄像头可观察到明显的光暗对比度。测试原理:利用小鼠对新环境探索的天性,小鼠会进入Y迷宫各臂探索,凭记忆做出正确的选择可有效地评价其空间工作记忆能力。将小鼠从起始臂的末端(A臂)放入,记录小鼠在10 min内进入各臂的总次数和顺序。当相邻的三次进臂顺序不重复时(ABC, ACB, BAC, BCA, CAB, CBA)为完成一次正确的交替反应。统计正确交替反应次数,计算自主交替率(%)=[正确交替反应次数/(N-2)]×100%,N=进臂次数的总和。每只小鼠测试结束后,应将小鼠残留在Y迷宫内的粪便和尿液处理干净,使用毛巾擦拭Y迷宫清除小鼠残留的气味,避免对下一只小鼠的测试造成干扰。
2.2 Western blot 将小鼠的海马体放入含蛋白酶抑制剂和磷酸酶抑制剂(Beyotime Biotechnology)的RIPA裂解液(100 mmol/L NaCl, 20 mmol/L Tris, pH 8.0, 1 mmol/L EDTA, pH 8.0, 0.5% Triton X-100,and 0.5% Nonidet P-40)中,在冰上匀浆裂解。使用BCA蛋白检测试剂盒(Pierce)对海马组织进行定量。经蛋白变性后,将等量的蛋白在12%的SDS-PAGE进行电泳并将蛋白转移至PVDF膜上,然后用5%的脱脂牛奶进行封闭。封闭结束后用Cdc42抗体(Cat#: 21010, NewEast Biosciences, CN)和β-actin抗体(Cat#: 60008-1-Ig, ProteinTech Group)在4 ℃条件下孵育。与Ⅱ抗(Peroxidase-conjugated Affinipure Goat Anti Mouse IgG or Anti Rabbit IgG, ProteinTech Group)在室温下孵育2 h。孵育结束后,化学发光法显色,用ImageJ图像分析软件获取定量数据。
2.3 RT-qPCR 使用HiPure Universal RNA Kit试剂盒(Magen)提取小鼠海马体的总RNA。使用Nanodrop Lite(Thermo Fisher Scientific)仪器对提取的RNA进行浓度检测,采用SYBR法(TaKaRa)和Appllied Biosystems 7500 Real Time PCR System(Thermo Fisher Scientific)进行实时荧光定量PCR测定。用β-actin对相对周期阈值(Ct)进行归一化。所用引物序列见表1。
2.4 Cdc42活性Pull-Down 实验 使用Cdc42活性Pull-Down试剂盒(Wuhan NewEast Biotechonology Co.Ltd)检测小鼠海马体Cdc42-GTP水平,分析Cdc42活性情况[19]。配制1×分析/裂解缓冲液:将5×原液简单混合,在去离子水中稀释至1×,每1 mL 1×裂解液加入蛋白酶抑制剂和磷酸酶抑制剂各0.02 mL。往EP管中加入0.35 mL配好的1×裂解液。将取出的新鲜组织放入裂解液中充分研磨,结束后静置10 min。静置后以4 ℃、13 000×g条件下离心15 min。使用BCA试剂盒测出浓度,算出0.8 mg所需要的样本量,然后用1 mL减去样本量,得出需要加入的1×裂解液的量并定容至1 mL。在EP管中加入2 μL的Cdc42活性抗体,然后在4 ℃条件下装在圆盘旋转混匀仪上孵育90 min。孵育结束后,将A/G蛋白琼脂糖珠浆混匀后加入0.02 mL至EP管中(每支试管在加入前都需要将A/G蛋白琼脂糖珠浆混匀)。加入珠浆后继续在4 ℃条件下的圆盘旋转混匀仪上孵育90 min。孵育结束后在室温5 000×g离心1 min,舍弃上清液,留下珠浆。加入0.5 mL的1×裂解液后在室温5 000×g离心1 min,舍弃上清液,留下珠浆,重复3次。洗涤结束后舍弃上清液,将珠子转移至0.025 mL的2×还原SDS-PAGE中以100 ℃条件变性8 min。在5 000×g条件下离心10 s,静置2 min,吸取上清液至新的EP管中,上清液为Cdc42-GTP样本。Western blot法测定Cdc42-GTP表达量。
3 统计学处理
统一用SPSS 25.0对所有实验数据进行分析,所有数据经正态分布检验,分析结果用均值±标准误(mean±SEM)表示,组间的比较采用独立样本t检验。以P<0.05为差异有统计学显著性。制图使用GraphPad Prism 9.0软件。
结果
1 建模后小鼠体重及体成分的基本情况
对建模后的各组小鼠体重及体成分等基本情况进行分析,结果可见,在普通饲料喂养的情况下青年期和老年期小鼠的体重和瘦体重无显著差异(P>0.05),但有氧运动可有效降低青年期小鼠体内脂肪量和体脂率(P<0.05),并且在停止运动干预后仍可维持至老年期(P<0.05或P<0.01),见图1。
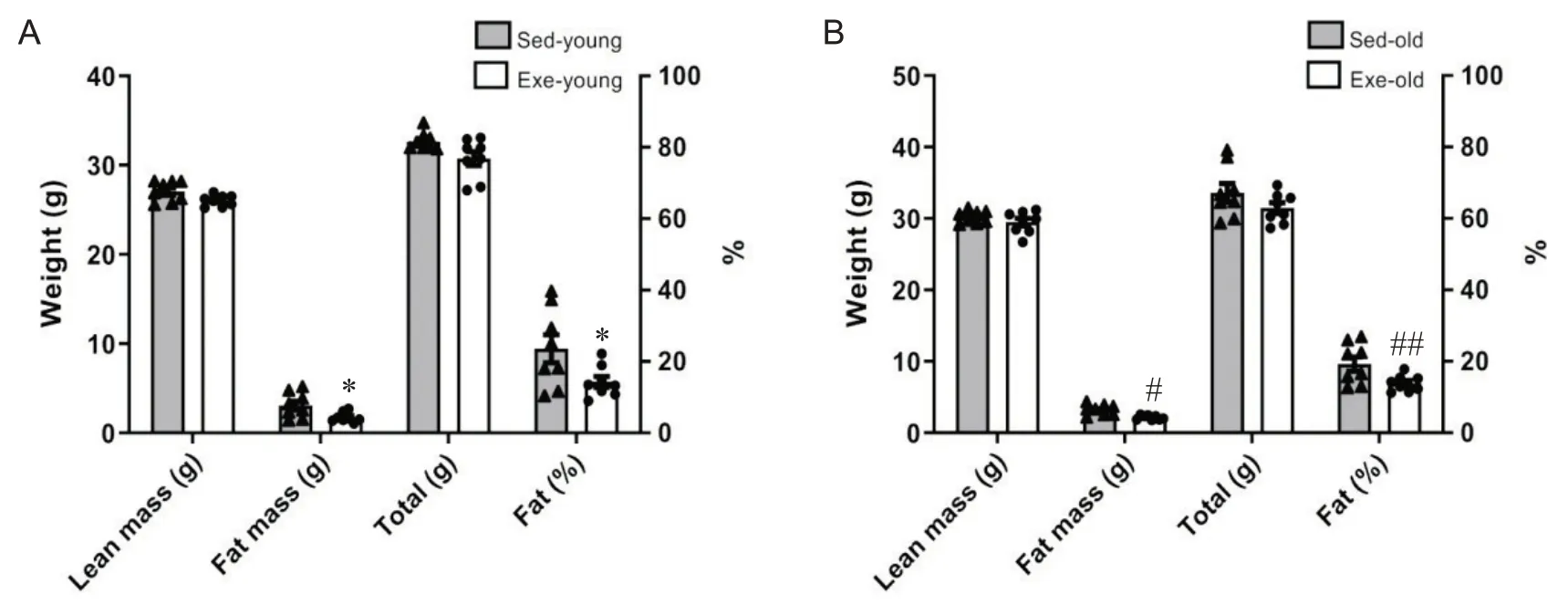
Figure 1. Changes in body weight and body composition in mice of each group. A: body composition was measured in Sed-young and Exe-young groups; B: body composition was measured in Sed-old and Exe-old groups. Mean± SEM. n=8. *P<0.05 vs Sedyoung group; #P<0.05, ##P<0.01 vs Sed-old group.图1 各组小鼠体重、体成分变化
2 长期有氧运动提高小鼠学习和空间记忆能力
Y迷宫自主交替实验结果显示(图2A),与安静组相比,12周有氧运动干预可显著提高所有运动组小鼠的Y迷宫自主交替正确率(P<0.05);而把上述部分小鼠继续喂养至老年期(18周龄)后,仍可观察到运动老年期小鼠的Y迷宫自主交替正确率高于安静老年期小鼠(P<0.05),见图2B。
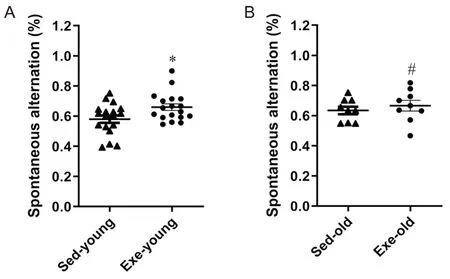
Figure 2. Comparison of the Y-maze spontaneous alternation in mice of each group. A: Y-maze of Sed-young and Exe-young groups (n=18); B: Y-maze of Sed-old and Exe-old groups (n=9). Mean±SEM. *P<0.05 vs Sedyoung group; #P<0.05 vs Sed-old group.图2 各组小鼠Y迷宫自主交替率比较
3 长期有氧运动抑制小鼠海马体Cdc42表达及活性
对运动干预后不同时期(青、老年)小鼠海马体Cdc42表达水平分析显示,与安静青年期小鼠比较,运动青年期小鼠海马体Cdc42表达显著减少(P<0.01);与安静老年期小鼠比较,运动老年期小鼠海马体Cdc42表达也显著减少(P<0.01)。对运动干预后不同时期(青、老年)小鼠海马体Cdc42活性分析显示,运动青年期小鼠海马体Cdc42-GTP水平显著低于安静青年期(P<0.05);运动老年期小鼠海马体Cdc42-GTP水平也显著低于安静老年期(P<0.05)。见图3。

Figure 3. Comparison of Cdc42 protein levels and Cdc42 activity in mice of each group. A: Western blot of Cdc42 protein levels and pull-down assay of Cdc42-GTP in Sed-young and Exe-young groups; B: Western blot of Cdc42 protein levels and pull-down assay of Cdc42-GTP in Sed-old and Exe-old groups. The relative levels of Cdc42 and Cdc42-GTP were normalized to β-actin, and the relative protein levels in the Sed-young or Sed-old group were normalized as “1”. WB: Western blot. Mean±SEM. n=4~6. *P<0.05, **P<0.01 vs Sed-young group; #P<0.05, ##P<0.01 vs Sed-old group.图3 各组小鼠Cdc42的表达量及活性比较
4 长期有氧运动抑制小鼠海马体DDR相关因子的表达
对运动干预后不同时期(青、老年)小鼠海马体Cdc42及DDR相关因子mRNA水平分析显示,与安静青年期小鼠相比,运动青年期小鼠海马体Cdc42、Pak4、Pak5、Cofilin、Atm、Chk2和P53等基因转录水平降低(P<0.01);与安静老年期小鼠相比,运动老年期小鼠海马体Cdc42、Pak4、Pak5和P53等基因转录水平降低(P<0.05或P<0.01),见图4。
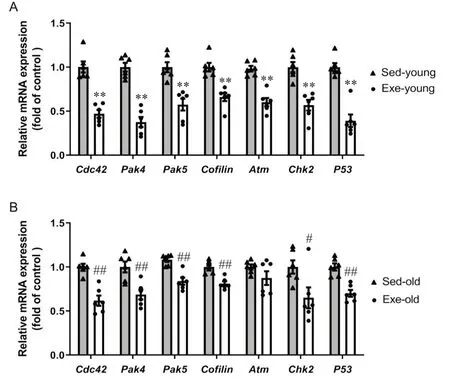
Figure 4. The mRNA expression of Cdc42 and DDR-related genes in mice of each group. A: RT-qPCR showed the mRNA expression of Cdc42 and DDR-related genes in Sed-young and Exe-young groups; B: RT-qPCR showed the mRNA expression of Cdc42 and DDR-related genes in Sed-old and Exe-old groups. The relative levels of these genes were normalized to β-actin, and the relative mRNA levels in the Sed-young or Sed-old group were normalized as “1”. Mean±SEM. n=6. **P<0.01 vs Sedyoung group; #P<0.05, ##P<0.01 vs Sed-old group.图4 各组小鼠Cdc42及DDR相关因子的转录水平比较
讨论
衰老是一个普遍且不可避免的、由遗传和环境因素相互作用的生物学过程。尽管衰老及死亡不可避免,但目前已有大量文献提出各种延缓衰老的干预措施。长期身体活动不足或久坐不动的生活方式是引起健康问题的重要原因。据世界卫生组织报道,积极参加体育锻炼可促进健康老龄化[20]。因此,运动是对抗衰老的有效手段之一。本研究通过构建长期有氧运动小鼠模型,分析有氧运动对青年期小鼠海马体的短期和长期影响。在普通饲料条件下,青年期小鼠通过长期有氧运动干预,可显著降低小鼠体脂率,这与以往文献报道一致[21];但在停止运动干预后继续喂养小鼠至老年期,可观察到小鼠体脂率的改变并没有随着年龄的增长而消失,表明运动对身体影响可能是终生的,或至少可维持一段较长的时间。
近几十年来,衰老机制的研究层面已从大体器官发展到细胞分子。Cdc42是真核细胞中的小分子Rho GTP酶,其功能包括肌动蛋白细胞骨架重组、细胞极性和细胞生长[22-23]。Cdc42有激活和失活两种状态,当与GTP结合时为激活状态,Cdc42活性可影响其功能的发挥。研究表明,随着年龄的增长,Cdc42在各个组织的表达和活性都会增加[7],并参与年龄相关疾病的发生发展[24-25]。此外,有证据表明,增加Cdc42表达可促进神经元突触生长[26]。在老化的造血干细胞中,通过抑制Cdc42的表达可使衰老的造血干细胞恢复到年轻时的状态[8];而运动也可促进小鼠造血干细胞造血重建能力[27]。再如,通过短期的药理学抑制Cdc42的活性可普遍延长小鼠的平均寿命[28];而运动干预后同样能够改变Cdc42的表达[29]。以上表明,Cdc42在各组织细胞中有不同作用,尤其在调控细胞衰老中发挥重要作用。与以往研究相似,在本研究中(图3),青年时期的有氧运动可短期和长期影响小鼠海马体Cdc42的表达和活性,提示运动可能通过抑制Cdc42的表达和活性,参与抗衰老的过程。这预示着有氧运动的影响可能与Florian的药理治疗[28]有类似的效果,即早期对小鼠进行运动或药物干预可对小鼠产生长期的有利影响,甚至可能延长小鼠的寿命。
DNA损伤是引起细胞衰老的重要因素。在正常情况下,DNA损伤会在24 h内被修复,以确保功能失调的遗传信息不会传递给后代细胞,因此基因组的完整性可以得到保护[30-31];若DNA损伤病灶未被修复,细胞则会留下持久的DNA损伤焦点,这种没有修复迹象的病灶是衰老表型的特征,也是衰老本身的原因[30]。而DDR和修复机制在DNA损伤引起细胞衰老的机制中发挥重要作用。Cdc42参与调控DDR和修复机制,其可激活DDR相关因子Pak4/5和Cofilin,调节Atm、Chk2和P53等蛋白的磷酸化状态,从而影响DDR介导的DNA损伤信号传导,在衰老过程中发挥重要作用[6]。但以上过程在Cdc42过度激活的状态下可出现异常改变。
Pak4可作为Cdc42的效应物在Cdc42介导的基因组不稳定性反应中发挥作用[32]。Pak5虽有报导可以减弱Chk2磷酸化,但具体机制尚不明确[33]。DNA损伤可诱导肌动蛋白重组,进而影响细胞凋亡和细胞周期停滞。而Cofilin对DNA损伤修复的影响已经被证实[34]。在DNA损伤后,通过Cofilin的磷酸化可调节肌动蛋白的动力学,从而执行细胞G2/M期停滞的功能[35]。DNA双链断裂后可募集并激活Atm,磷酸化的Atm进而调节Chk2和P53,激活DNA修复过程,诱导细胞S、G1和G2期停滞[36]。此外,P53是衰老相关的标志性蛋白,当Chk2表达异常时也会导致P53的积累[37]。因此,任何原因引起上述DDR相关因子的过度表达,都可能导致细胞周期停滞,影响细胞的复制寿命,诱导细胞衰老。在本研究中,经过有氧运动干预的小鼠海马体Cdc42表达及活性低于对照组,提示当细胞面临DNA损伤时,有氧运动可抑制Cdc42的过度激活,使Atm、Chk2、P53等因子响应正常的DNA损伤修复过程,避免无效的修复及进入衰老复制。再如,本研究经过运动干预后可以降低小鼠海马体P53基因的表达,且这种效果可维持至老年期,说明有氧运动可能通过减少DNA损伤或增强DNA修复的方式起抗衰老的作用。
运动可以改善脑认知功能[38-39]。但值得注意的是,在不同时期进行运动可对认知能力、海马体神经元生长和树突棘的形成产生不同的影响。研究显示,相比较成年后进行运动的实验鼠,青春期进行运动的实验鼠虽然Y迷宫自发交替率减少,但其海马体神经元和树突棘的数量显著增多[40]。在本实验的行为学观察中,有氧运动可显著提高青年期小鼠的自主交替正确率,提高空间记忆能力。而在停止运动干预后将小鼠继续喂养至老年期,对照组与运动组小鼠的自主交替正确率仍有差异,表明运动改善认知功能的作用可从小鼠的青年期维持至老年期,并且可能通过延缓海马体神经元细胞衰老改善认知功能。因此,早期进行运动除了能产生长期有益的影响外,越早进行运动可能会带来更好的效果,但需要更多的证据支持。
综上所述,长期有氧运动可有效增强小鼠的空间学习记忆,抑制海马体Cdc42及DDR相关因子的表达,保护小鼠海马体神经元细胞免受DNA损伤而死亡或衰老直至老年期。因此,本研究主要从Cdc42参与调控DDR及修复机制方面探讨青年期有氧运动干预对小鼠的短期和长期影响,为运动延缓衰老提供了新证据。然而,Cdc42活性增强是否为衰老的诱导因素,运动延迟衰老的进展是否通过抑制Cdc42的活性以及其具体机制如何,这在今后的研究中都是值得探讨的。

