清脑滴丸通过调控miR-223-3p抑制NLRP3炎症小体信号通路对急性脑缺血/再灌注损伤大鼠的抗炎作用机制*
刘孟涵, 吴艺帆, 刘云婷, 王翎沣, 巩俐, 刘嘉, 杨小蕊, 刘雪梅
(北京中医药大学东方医院,北京 100029)
卒中是临床最常见的脑血管疾病,是我国成年人首要致死及致残病因,2020年我国40岁以上人群卒中死亡患者约230万,其中缺血性卒中占卒中的62.4%~77.8%,给患者、家庭和社会带来沉重的经济负担[1-2]。缺血性卒中是由于脑血管栓塞,血液供应中断,造成局部脑组织缺血缺氧甚至坏死,然而临床上观察到即使恢复血液供应仍然会导致严重的神经细胞死亡和神经功能障碍,即脑缺血再灌注损伤(cerebral ischemia reperfusion injury, CIRI),若不进行干预或干预不及时可加重脑组织损伤。目前研究认为炎症级联反应在CIRI中起着关键作用,可导致“损伤-炎症-再损伤”的恶性循环[3-4]。因此,通过调控炎症反应研究CIRI的发病机制及治疗方法,对于改善患者预后和提升生活质量具有重要的意义。
核苷酸结合寡聚化结构域样受体蛋白3(nucleotide-binding oligomerization domain-like receptor protein 3, NLRP3)炎症小体由NLRP3、含caspase募集结构域的凋亡相关斑点样蛋白(apoptosis-associated speck-like protein containing a caspase recruitment domain, ASC)和pro-caspase-1蛋白组成,通过调控白细胞介素1β(interleukin-1β, IL-1β)和IL-18的成熟和释放,促进炎症反应,加重CIRI[5]。研究证实微小RNA-223-3p(microRNA-223-3p, miR-223-3p)可直接靶向结合NLRP3的3′-UTR调控NLRP3,参与炎症反应,miR-223-3p过表达可发挥神经保护作用[6-7]。清脑滴丸(Qingnao dripping pills, QNDP)由栀子、三七和冰片三味中药组成,具有清热活血,醒神开窍之功效。本团队前期研究已证实QNDP能够降低CIRI大鼠的神经元凋亡,减少脑缺血体积,改善神经功能症状,降低炎症反应而发挥神经保护作用[8]。然而QNDP如何调控神经炎症值得进一步研究。因此本项目通过建立脑缺血再灌注损伤大鼠模型,探讨QNDP是否通过miR-223-3p介导NLRP3炎症小体信号通路对CIRI大鼠发挥抗炎作用,为其临床治疗缺血性卒中提供实验依据。
材料和方法
1 动物
6周龄雄性SD大鼠,SPF级,体质量(200±20) g,97只,购自中国食品药品检定研究院,许可证号为SCXK(京)2022-0002,所有大鼠均在北京中医药大学东方医院动物房饲养,室温24~26 ℃,相对湿度50%~60%,自由饮水、饮食,光昼交替12 h。本实验方案通过北京中医药大学东方医院动物伦理委员会批准(No. DFYY202208)。
2 主要药物与试剂
QNDP(北京同仁堂股份有限公司科学研究所);栓线(北京西农科技有限公司);Trizol总RNA提取试剂(天根生化科技北京有限公司);Reverse Transcriptase M-MLV、SYBR®Premix Ex Taq™ Ⅱ (Tli RNaseH Plus);预染蛋白Marker(Amersham);NLRP3抗体和cleaved caspase-1抗体(Proteintech);ASC抗体(ImmunoWay);GAPDH抗体(Cell Signaling Technology);Alexa Fluor标记的羊抗兔Ⅱ抗(Abcam);IL-18和IL-1β试剂盒(南京建成生物工程研究所);antagomiR-223-3p引物设计、合成委托苏州吉玛基因股份有限公司完成。
3 主要仪器设备
R530小动物麻醉机(深圳市瑞沃德生命科技有限公司);大鼠数显脑立体定位仪(北京众实迪创科技发展有限公司);7300 RT-PCR仪(AppliedBiosysterms);Mini Blot Module小型转印模块(ThermoScientific);BOX Chemi XX9型化学发光成像系统(Gene);CM1900冷冻切片机(LEICA);BX53F荧光显微镜(OLYMPUS)。
4 方法
4.1 侧脑室注射antagomiR-223-3p 大鼠禁食不禁水12 h,采用1%戊巴比妥钠(30 mg/kg)腹腔注射麻醉,充分暴露前囟点,大鼠俯卧位固定于数显脑立体定位仪,调整定位并使微量注射器针尖对准囟点向后1.1 mm,中线左旁开1.5 mm,用微型颅骨钻小心钻孔,将微量注射器插入颅内4.5 mm注射antagomiR-223-3p 10 μL,1 μL/min,留针5 min,骨蜡封闭注射孔,缝合皮肤,24 h后制备CIRI模型。
4.2 动物模型制备 参考Longa法改良建立大鼠大脑中动脉栓塞/再灌注(middle cerebral artery occlusion/reperfusion, MCAO/R)模型模拟CIRI[9]。造模前大鼠禁食不禁水12 h,采用4%~5%异氟烷气体吸入诱导麻醉,再以1%异氟烷气体吸入维持麻醉,将大鼠仰卧位固定,颈部正中切口,分离左侧颈总动脉、颈内动脉和颈外动脉,结扎颈总动脉近心端和颈外动脉,暂时夹闭颈总动脉远心端,在颈总动脉靠近远心端位置剪一斜口,插入头端直径为0.24 mm的栓线,有阻力感时停止插入,此时插入深度约为(1.8±0.2)cm,造成大脑中动脉供血相关区的缺血,栓塞1.5 h后,拔出栓线再灌注24 h。Sham组仅将栓线插入1 cm,余操作同模型组。术后注意肛温,正常喂养。大鼠术后6 h进行Longa评分,评分1~3分视为造模成功,随机纳入实验各组。实验过程中,因麻醉、手术等原因死亡4只,Longa评分不符合要求的3只,均不入组。
4.3 实验分组、给药 MCAO/R大鼠随机分为CIRI模型(MCAO/R)组、MCAO/R+QNDP组、MCAO/R+antagomiR-223组和MCAO/R+QNDP+antagomiR-223组,另设假手术(sham)组作为对照,共5组,每组18只。每组随机取6只大鼠进行神经功能缺损评分;随后6只取大脑用于TTC染色和脑含水量检测;3只取大脑用于免疫荧光染色检测;3只取缺血侧皮层用于RT-qPCR和Western blot检测;6只取缺血侧皮层用于ELISA检测。MCAO/R+QNDP组和MCAO/R+QNDP+antagomiR-223组均灌胃给予QNDP (150 mg/kg),从MCAO/R术后2 h给药1次,间隔10 h给药1次,末次给药2 h后进行指标观察,余各组给予等体积的蒸馏水。
4.4 Garcia评分法测定大鼠神经功能缺损程度 由对本实验设计不知情者对所有大鼠进行Garcia评分[10]。观察大鼠自主运动状态,得分越低表示神经功能缺损越严重,最高得分18分表示功能正常,最低得分3分表示损伤最严重。
4.5 TTC染色法观察大鼠脑缺血体积 大鼠大脑自额极开始行冠状切片,共切5片,每片约2 mm。将脑片放入2% TTC染液中,37 ℃避光水浴孵育30 min,取出切片,进行拍照。缺血脑组织呈白色,采用ImageJ软件对TTC染色照片进行统计分析,脑缺血体积比(%)=(各脑切片缺血面积×切片厚度之和)/(各脑切片的总面积×切片厚度之和)×100%。
4.6 干湿重法检测大鼠脑含水量 完整大脑取出后先快速称重,再将其置于110 ℃干燥箱中烘烤24 h,取出称干重,按照Billiot公式计算脑含水量:脑含水量(%)=(湿重-干重)/湿重×100%。
4.7 RT-qPCR法测定miR-22-3p表达 采用Trizol法提取皮层RNA,紫外分光光度计测定RNA浓度和纯度。取1 μg RNA采用Reverse Transcriptase MMLV进行cDNA反转录,再进行实时荧光定量PCR扩增。扩增条件:95 ℃ 30 s;92 ℃ 5 s,60 ℃ 40 s,40个循环。miR-223-3p的上游引物序列为5′-ACACTCCAGCTGGGTGTCAGTTTGTCAAATAC-3′,下游引物序列为5′-TCAACTGGTGTCGTGGAGTCGGCAATTCAGTTGAGGGGGTAT-3′;内参照U6的上游引物序列为5′-CTCGCTTCGGCAGCACA-3′;下游引物序列为5′-AACGCTTCACGAATTTGCGT-3′。采用2-ΔΔCt法进行定量分析。
4.8 Western blot法检测NLRP3、ASC和cleaved caspase-1蛋白表达 采用RIPA裂解液提取皮层总蛋白,BCA法测定蛋白浓度,10% SDS-PAGE分离蛋白,PVDF转膜,5%脱脂牛奶进行封闭1 h,加入兔多克隆NLRP3抗体(1:500)、兔多克隆ASC抗体(1∶1 000)和兔多克隆cleaved caspase-1抗体(1∶1 000),4 ℃孵育过夜,加入羊抗兔IgG-HRP Ⅱ抗(1∶1 000),室温摇床1 h,ECL显色后,置于凝胶成像系统进行拍照。应用ImageJ软件进行蛋白条带灰度值分析。
4.9 免疫荧光法观察NLRP3在缺血侧皮层中的分布 大鼠采用多聚甲醛灌注固定后,取大脑行冰冻切片(厚度30 μm)。选用山羊血清和5% BSA进行封闭1.5 h,加入兔多克隆NLRP3 Ⅰ抗(1∶300),4 ℃过夜孵育,加入羊抗兔Alexa Fluor Ⅱ抗(1∶2 000),含DAPI的防荧光淬灭封片剂进行封片,荧光显微镜下观察拍照。应用ImageJ软件进行分析。
4.10 ELISA法检测IL-1β和IL-18的水平 取皮层按重量体积比加生理盐水制成10%的组织匀浆,严格按照IL-1β和IL-18的ELISA测定试剂盒说明书进行操作。
5 统计学处理
采用SPSS 26.0进行数据处理,符合正态分布或近似符合的计量资料用均数±标准差(mean±SD)表示。若方差齐,多组间采用单因素方差分析(oneway ANOVA)进行多组间比较,采用LSD检验进行组间两两比较;若方差不齐,则采用Dunnett′s T3检验法。以P<0.05为差异有统计学意义。
结果
1 QNDP对大鼠神经功能损伤评分的影响
与sham组比较,MCAO/R组大鼠神经功能评分显著降低(P<0.01);与MCAO/R组相比,MCAO/R+QNDP组大鼠神经功能评分显著升高(P<0.01),antagomiR-223组大鼠神经功能评分显著降低(P<0.01);与MCAO/R+QNDP组比较,MCAO/R+QNDP+antagomiR-223组大鼠神经功能评分显著降低(P<0.01),见图1。
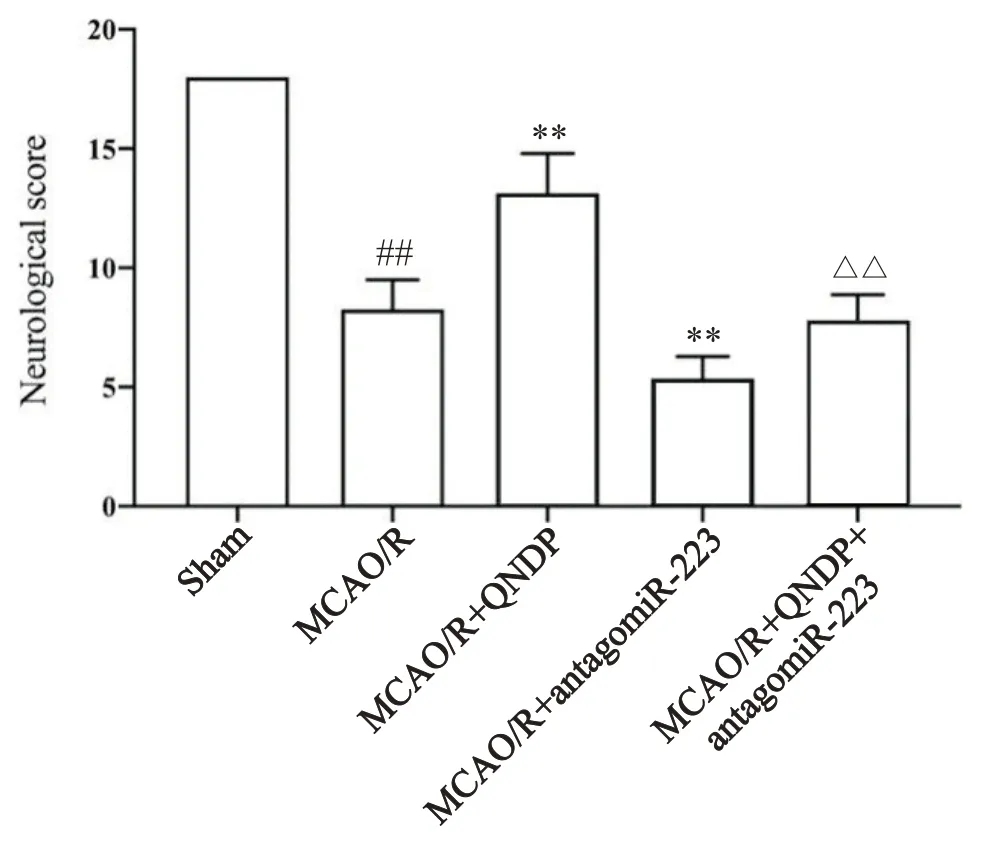
Figure 1. The neurological deficit scores of the rats in each group.Mean±SD. n=6. ##P<0.01 vs sham group; **P<0.01 vs MCAO/R group; △△P<0.01 vs MCAO/R+QNDP group.图1 各组大鼠神经功能缺损评分
2 QNDP对大鼠脑缺血体积的影响
与sham组比较,MCAO/R 组大鼠缺血侧白色区域显著增大,脑缺血体积明显增加(P<0.01);与MCAO/R组相比,MCAO/R+QNDP组大鼠脑缺血体积显著降低(P<0.01),而MCAO/R+antagomiR-223组显著增加(P<0.01);与MCAO/R+QNDP组比较,MCAO/R+QNDP+antagomiR-223组大鼠脑梗死体积显著增加(P<0.01),见图2。

Figure 2. The cerebral infarct volume of the rats in each group (TTC staining). Mean±SD. n=6. ##P<0.01 vs sham group; **P<0.01 vs MCAO/R group; △△P<0.01 vs MCAO/R+QNDP group.图2 各组大鼠脑缺血体积
3 QNDP对大鼠脑含水量的影响
与sham组比较,MCAO/R组大鼠脑含水量增加(P<0.05);与MCAO/R组相比,MCAO/R+QNDP组大鼠脑含水量显著降低(P<0.01);MCAO/R+antagomiR-223组大鼠脑含水量升高(P<0.05);与MCAO/R+QNDP组比较,MCAO/R+QNDP+antagomiR-223组大鼠脑含水量升高(P<0.05),见图3。
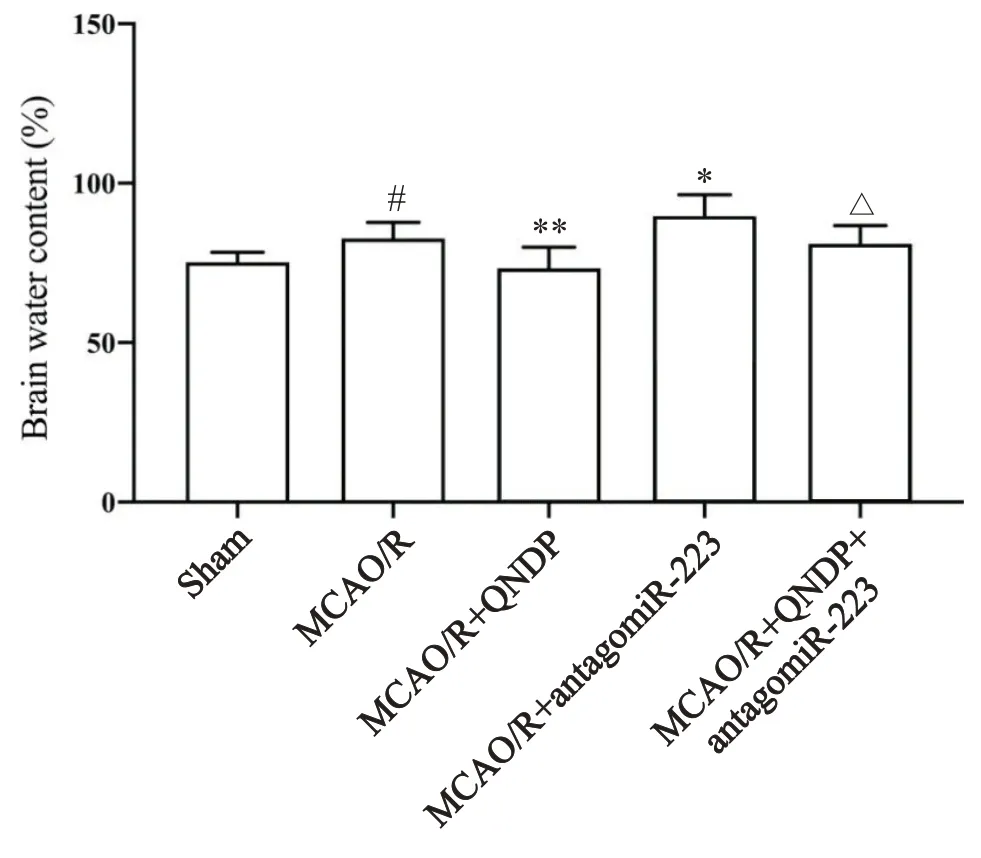
Figure 3. The brain water content of the rats in each group.Mean±SD. n=6. #P<0.05 vs sham group; *P<0.05,**P<0.01 vs MCAO/R group; △P<0.05 vs MCAO/R+QNDP group.图3 各组大鼠脑含水量
4 QNDP对缺血皮层miR-223-3p表达的影响
与sham组相比,MCAO/R组缺血侧皮层区miR-223-3p表达显著上调(P<0.01);与MCAO/R组比较,MCAO/R+QNDP组大鼠miR-223-3p表达增加(P<0.05),MCAO/R+antagomiR-223组则显著减少(P<0.01);与MCAO/R+QNDP组比较,MCAO/R+QNDP+antagomiR-223组大鼠miR-223-3p表达显著减少(P<0.01),见图4。
5 QNDP对缺血皮层NLRP3炎症小体的影响
Western blot结果显示,与sham组相比,MCAO/R组大鼠NLRP3、ASC及cleaved caspase-1蛋白表达显著增加(P<0.01);与MCAO/R组比较,MCAO/R+QNDP组大鼠上述蛋白表达减少(P<0.05),MCAO/R+antagomiR-223组大鼠三者蛋白表达升高(P<0.05,P<0.01);与MCAO/R+QNDP组比较,MCAO/R+QNDP+antagomiR-223组大鼠NLRP3和cleaved caspase-1蛋白表达均上调(P<0.05,P<0.01),ASC蛋白无统计学意义;进一步与MCAO/R+antagomiR-223组比较,MCAO/R+QNDP+antagomiR-223组大鼠ASC蛋白显著降低(P<0.01),见图5A。免疫荧光染色结果显示,与sham组相比,MCAO/R组NLRP3细胞数量显著增加(P<0.01);与MCAO/R组比较,MCAO/R+QNDP组大鼠显著降低NLRP3细胞数量(P<0.01),MCAO/R+antagomi-R223组反而显著增加(P<0.01);与MCAO/R+QNDP组比较,MCAO/R+QNDP+antagomiR-223组中NLRP3表达的细胞数量显著升高(P<0.01),见图5B。
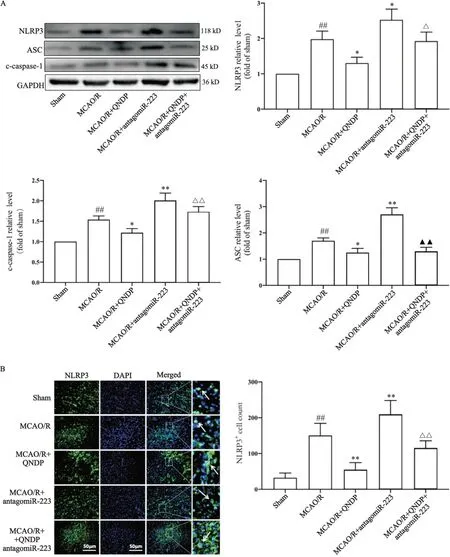
Figure 5. The expression NLRP3 inflammsome-related proteins in the cortex of the rats in each group. A: the protein expression of NLRP3, cleaved caspase-1 and ASC detected by Western blot; B: representative immunofluroscence images of NLRP3(green) and DAPI (blue), and the quantification of NLRP3 positive cell number. Mean±SD. n=3. ##P<0.01 vs sham group; *P<0.05, **P<0.01 vs MCAO/R group; △P<0.05, △△P<0.01 vs MCAO/R+QNDP group; ▲▲P<0.01 vs MCAO/R+antagomiR-223 group.图5 各组皮层NLRP3炎症小体相关蛋白的表达
6 QNDP对缺血皮层IL-1β和IL-18水平的影响
与sham组相比,MCAO/R组大鼠IL-1β和IL-18水平显著升高(P<0.01);与MCAO/R组比较,MCAO/R+QNDP组大鼠二者水平显著降低(P<0.01),MCAO/R+antagomiR-223组反而显著增加(P<0.01);与MCAO/R+QNDP组比较,MCAO/R+QNDP+antagomiR-223组的IL-1β和IL-18水平显著增加(P<0.01),见图6。

Figure 6. The IL-1β (A) and IL-18(B) levels in the cortex of the rats in each group. Mean±SD. n=6. ##P<0.01 vs sham group; **P<0.01 vs MCAO/R group; △△P<0.01 vs MCAO/R+QNDP group.图6 各组皮层IL-1β和IL-18水平
讨论
缺血性卒中呈现出高发病率、高致残率、高死亡率,高经济负担率,已成为我国亟需解决的重大难治性疾病。近年来溶栓、血管内治疗等治法取得了较好疗效,然而临床上溶栓有限的治疗时间窗(<4.5 h)和禁忌症等问题导致仅约10%的患者获益[2]。因此为大多数非溶栓的缺血性卒中患者寻求有效的治疗方案,仍然是目前临床实践中面临的主要问题。急性缺血性卒中患者加以中医辨证施治,综合治疗效果可有所提高,临床上采用清热活血化瘀法治疗已得到肯定,有利于患者神经功能恢复,且一定程度提升患者日常生活和质量水平[11]。QNDP由栀子、三七和冰片组成。君药栀子,清热、泻火、凉血;臣药三七,长于活血化瘀,化瘀而不伤正;冰片作为佐使药,醒神开窍。三药共同导火热下行,瘀血散结,发挥清热活血之功效。本团队前期实验证实QNDP能够降低大鼠CIRI诱导的炎症反应,减轻神经功能损伤,改善神经功能[7,12]。然而QNDP通过调控何种分子机制发挥抗炎作用,正是本研究的目的。
NLRP3是目前研究较深入的炎症小体,作为炎症反应的中枢,在缺血性卒中发病及发生发展中扮演着关键作用[13]。NLRP3直接或通过ASC蛋白间接招募pro-caspase-1,产生活化的caspase-1(cleaved caspase-1),后者将pro-IL-1β和pro-IL-18裂解为成熟形式IL-1β和IL-18并释放,介导炎症反应。Wang等[14]采用NLRP3基因敲除小鼠建立MCAO/R模型后,脑缺血体积和神经功能损伤均明显降低,表明NLRP3炎症小体加重急性CIRI。Ward等[15]和Zhu等[16]分别应用NLRP3抑制剂MCC950干预MCAO/R小鼠,可显著降低缺血皮层NLRP3、ASC和cleaved caspase-1蛋白表达,减轻脑缺血体积。这也与本研究结果相一致,大鼠MCAO/R损伤后可导致NLRP3、cleaved caspase-1和ASC的蛋白表达均显著增加,神经功能缺损严重,经QNDP治疗后,缺血皮层NLRP3炎症小体相关蛋白表达水平降低,IL-1β和IL-18水平显著减少,表明QNDP对CIRI大鼠具有较好的抗炎作用,是一个潜在的有效治疗缺血性卒中的中药复方。
miRNA是一类小的非编码内源性RNA分子,通过与靶基因的mRNA特异性结合,在转录后水平调控靶基因的表达,具有调节细胞分化、增殖等功能,超过20%的miRNA在缺血性脑卒中发生改变,参与神经细胞死亡,炎症,神经再生以及血管生成等生物学过程[17-18]。miR-223-3p主要在骨髓和中性粒细胞中高度表达,但也在大脑中海马、皮层区表达相对富集,是一种具有神经保护作用的miRNA[7,19]。Li等[20]证实脑缺血72 h患者的血清miR-223表达上调,但与神经功能损伤程度和脑缺血体积呈负相关。Voelz等[21]证实大鼠MCAO/R 24~72 h,缺血侧的皮层、杏仁核区的miR-223-3p显著增加,这可能与血小板活化,以及应激反应等因素有关。本研究同样观察到大鼠MCAO/R 24 h时,缺血侧皮层的miR-223-3p出现升高,给予miR-223-3p拮抗剂后可显著上调IL-1β和IL-18水平,脑缺血体积增大,提示miR-223-3p过表达可保护CIRI,miR-223缺乏导致脑损伤加重,这也与Harraz等[7]研究结果相一致。多项研究表明miR-223-3p可特异性地靶向结合NLRP3 mRNA的3′端非翻译区,对NLRP3 mRNA转录水平实行负向调控,抑制NLRP3蛋白表达和NLRP3炎症小体活化[22-23]。Sha等[24]采用电针治疗可增加急性MCAO/R大鼠的miR-223水平,抑制NLRP3炎症小体,发挥神经保护作用。本研究结果显示QNDP联合miR-223-3p拮抗组干预后,QNDP显著上调MCAO/R大鼠的miR-223-3p表达,减弱NLRP3炎症小体激活,降低神经炎症,减轻CIRI。
综上所述,本研究证实,大鼠MCAO/R损伤后可激活NLRP3炎症小体,加重神经炎症;QNDP可能通过miR-223-3p调控NLRP3通路抑制炎症反应,从而减轻大鼠CIRI,发挥神经保护作用。

