延胡索总生物碱对慢性癫痫大鼠皮层NLRP3/caspase-1/GSDMD介导的细胞焦亡的影响*
齐雅芝, 唐娅, 李君, 曹睿, 翟燕玲, 韩玉生△, 徐强△
(1黑龙江中医药大学,黑龙江 哈尔滨 150040;2黑龙江中医药大学佳木斯学院,黑龙江 佳木斯 154007)
癫痫作为临床常见的慢性神经系统疾病,是由于大脑中间歇性的高同步化异常神经元放电,导致患者长期反复的癫痫发作,并且伴有认知功能和行为障碍。临床上约有30%的患者对抗癫痫药物(anti-seizures drug, ASDs)产生耐药性,而且部分患者经过ASDs治疗后并未起到有效缓解的作用。研究显示神经炎症在癫痫发生与发展中起到越来越重要的作用[1],炎症反应可以引起神经元异常放电,从而破坏神经连接导致神经元损伤和胶质细胞增生[2]。新近研究显示在癫痫的病理过程中神经细胞发生焦亡,同时引起促炎细胞因子分泌增加,进一步激活神经炎症反应[3]。经典细胞焦亡途径为炎症小体激活pro-caspase-1为caspase-1,caspase-1可以促进细胞因子的成熟,并且能通过切割消皮素D(gasdermin D,GSDMD),使成熟的细胞因子由GSDMD N端形成的蛋白孔释放,协同作用下导致神经炎症的发生并驱动神经细胞焦亡[4]。核苷酸结合寡聚化结构域样受体蛋白3(nucleotide-binding oligomerization domainlike receptor protein 3, NLRP3)是在癫痫的发病过程中起到重要作用的炎症小体,由NLRP3、含caspase募集结构域的凋亡相关斑点样蛋白(apoptosis-associated speck-like protein containing a caspase recruitment domain, ASC)和磷酸化的caspase-1前体组成。研究显示NLRP3炎症小体的激活可以促进促炎细胞因子的分泌,从而导致神经炎症的发生[5],而NLRP3/caspase-1/GSDMD通路蛋白的转录和表达可通过核因子κB(nuclear factor-κB, NF-κB)通路来激活[6]。
延胡索为罂粟科植物的干燥根茎,其性辛、苦和温,归心、肝和脾经,具有活血散瘀、理气止痛的功效,临床上主要用于治疗心血管疾病、炎症和睡眠障碍等,且安全性良好[7]。延胡索总生物碱(total alkaloids ofRhizoma Corydalis, TAC)是从中药延胡索提取分离的活性成分,黄连碱、巴马汀和表小檗碱是其中的重要组成部分[8-9],均有一定的抗炎作用[10-11]。研究表明,表小檗碱可通过调控CD39-NLRP3-GSDMD焦亡路径减轻脓毒症肺损伤[12];盐酸巴马汀也可通过抑制NLRP3炎症小体所诱导的炎症通路,对脊髓神经细胞起到保护作用[13]。本实验采用戊四氮(pentetrazol, PTZ)建立慢性癫痫大鼠模型,研究延胡索总生物碱对慢性癫痫大鼠的治疗作用,进一步探讨其对NLRP3/caspase-1/GSDMD介导的细胞焦亡的影响及可能机制。
材料和方法
1 动物
SPF级8周龄雄性SD大鼠30只,体质量(250±10) g,由辽宁长生生物技术股份有限公司提供,动物许可证号为SCXK(辽)2020-0001。大鼠饲养温度20~24 ℃,湿度50%~60%,常规饲养于标准环境1周,自由饮食饮水。
2 主要试剂
TAC由黑龙江中医药大学实验实训中心提供,经黑龙江中医药大学田明教授鉴定纯度为85%;PTZ(酷尔化学科技有限公司,批号:GT633714);TUNEL检测试剂盒(Roche,批号:10768100);NF-κB p65、NLRP3和pro-caspase-1多克隆抗体(武汉博士德生物工程有限公司,货号:BA0610、BA3677和BM4291);抗GSDMD-N抗体(北京安诺伦生物科技有限公司,货号:DF13758);抗caspase-1 p20、GSDMD、肿瘤坏死因子α(tumor necrosis factor-α, TNF-α)、白细胞介素18(interleukin-18, IL-18)、IL-1β和β-actin兔多克隆抗体及山羊抗兔HRP标记IgG(北京博奥森生物技术有限公司,货号:bs-10743R、bs-14287R、bs-10802R、bs-0529R、bs-0812R、bs-0061R和bs-0296GHRP);TRIpure Reagent、SuperM-MLV反转录酶、RNase inhibitor和2×Power Taq PCR Master Mix(北京百泰克生物技术有限公司,货号:RP1001、PR6502、RP5602和PR1702);SYBR Green qPCR Master Mix(北京索莱宝科技有限公司,货号:SY1020)。
3 主要仪器
DNM-9602型酶标仪(北京普朗新技术有限公司);正置荧光显微镜FR-4A(上海光学仪器厂);YD-1508B型组织切片机(浙江金华益迪医疗设备厂);MoticBA400显微摄影成像系统(Motic);iCEN-24R型台式高速冷冻离心机(杭州奥盛仪器有限公司);Tanon EPS-300型电泳仪、Tanon VE-186电泳槽、Tanon VE-180B转膜槽和Tanon-4600凝胶成像系统(上海天能科技有限公司);Exicycler 96荧光定量PCR仪(BIONEER)。
4 主要方法
4.1 模型制备及评价 24只大鼠适应性饲养7 d后进行编号、称重,模型组大鼠每天腹腔注射PTZ溶液(35 mg/kg),连用28 d[14]。注射完毕后将大鼠迅速置于透明盒子中观察。本研究通过监测各组大鼠最后一次给药后癫痫发作的持续时间和强度,根据Racine评分标准判断大鼠的癫痫发作等级[15]:0级,无发作反应;Ⅰ级,出现咀嚼、节律性面部抽搐等症状;Ⅱ级,出现咀嚼、头部点头症状并伴随更严重的面部肌肉抽搐;Ⅲ级,出现单侧前肢阵挛但不伴随直立;Ⅳ级,出现双侧前肢阵挛伴随直立;Ⅴ级,出现周身强直性阵挛、直立或跌倒;Ⅵ级,死亡。以大鼠在28 d内至少出现3次严重程度不低于Ⅳ级的连续癫痫发作为造模成功的标准,成功造模18只。
4.2 分组及给药方法 将模型制备成功的18只大鼠随机分为模型(model)组、低剂量TAC(low-dose TAC, TAC-L)组和高剂量TAC(high-dose TAC, TACH)组,另设正常(normal)组,每组6只。参照参考文献[16],TAC低、高剂量组大鼠分别灌胃给予剂量为7和14 mg/kg的TAC溶液,每日1次,连续给药14 d,正常组和模型组每天灌胃给予等体积的生理盐水。
4.3 全面强直阵挛发作(generalized tonic-clonic seizures, GTCS)和极小阵挛发作(minimal clonic seizures, MCS)潜伏期 每次PTZ腹腔注射后,参照文献[17]及Racine分级标准,观察各组大鼠GTCS潜伏期和MCS潜伏期。
4.4 HE染色观察病理学变化 取各组大鼠脑组织经4%多聚甲醛固定24 h,常规脱水、透明、浸蜡和石蜡包埋后切片,进行HE染色。在显微镜下观察各组大鼠颞叶皮层脑组织的病理学变化。
4.5 TUNEL法观察细胞凋亡 根据TUNEL检测试剂盒说明进行操作,在光镜下观察大脑皮层区神经元凋亡情况,每组大鼠取6张不连续切片进行检测,计算每张切片3个不同视野中的神经细胞凋亡百分比,取其平均值进行统计分析。
4.6 免疫组化(immunohistochemictry, IHC)检测各组大鼠皮层组织中NF-κB p65、NLRP3、GSDMD-N和caspase-1 p20的蛋白表达 采用PV两步法进行检测,石蜡切片常规脱蜡水化后微波修复;灭活内源性酶,PBS清洗;滴加Ⅰ抗(NLRP3和GSDMD-N抗体,1∶125;NF-κB p65和caspase-1 p20抗体,1∶100),4 ℃孵育过夜;经PBS清洗后滴加Ⅱ抗,37 ℃孵育30 min;DAB显色、苏木素复染色;脱水透明后封片。每组选取6例进行检测,采用Motic3000显微摄影成像系统200倍镜下采集图像,每张切片随机选取3个不同视野,使用Image-Pro Plus 6.0图像分析软件进行分析,以平均积分吸光度(integral absorbance,IA)代表蛋白表达水平。
4.7 IHC检测各组大鼠皮层IL-1β、IL-18和TNF-α水平 同4.6操作,检测各组大鼠皮层区IL-1β、IL-18和TNF-α水平。
4.8 Western blot检测各组大鼠颞叶皮层NF-κB p65、NLRP3、GSDMD、GSDMD-N、pro-caspase-1和caspase-1 p20蛋白表达 取皮层脑组织样本称重后于冰上研磨,用RIPA细胞裂解液裂解,冷冻离心机离心后取上清液,BCA蛋白定量法进行定量,金属浴变性后备用。蛋白样品制备成功后电泳分离,恒流200 mA转移至PVDF膜上,脱脂奶粉封闭2 h后分别在兔抗NLRP3、NF-κB p65、pro-caspase-1、caspase-1 p20、GSDMD和GSDMD-N(均1∶1 000)中4 ℃孵育过夜。加入山羊抗兔HRP标记IgG(1∶2 000)在室温孵育1 h,然后进行ECL化学发光显影,所使用内参照为β-actin。应用ImageJ软件对各组条带进行定量分析,计算目的蛋白对应条带灰度值与内参照条带灰度值的比值,确定目的蛋白的表达水平。
4.9 RT-qPCR检测各组大鼠皮层NLRP3、GSDMD和caspase-1的mRNA表达 取新鲜皮层组织,提取总RNA,使用NanoDrop 2000紫外分光光度计测定各样本中RNA的浓度。将上述所得到的RNA样本进行反转录以得到对应的cDNA。使用SYBR Green Master Mix进行PCR扩增,反应条件:94 ℃ 5 min;94 ℃ 10 s,60 ℃ 20 s,72 ℃ 30 s,循环40次。以β-actin作为内参照,结果采用2-ΔΔCt分析相对表达量。上海生工合成引物序列如表1所示。
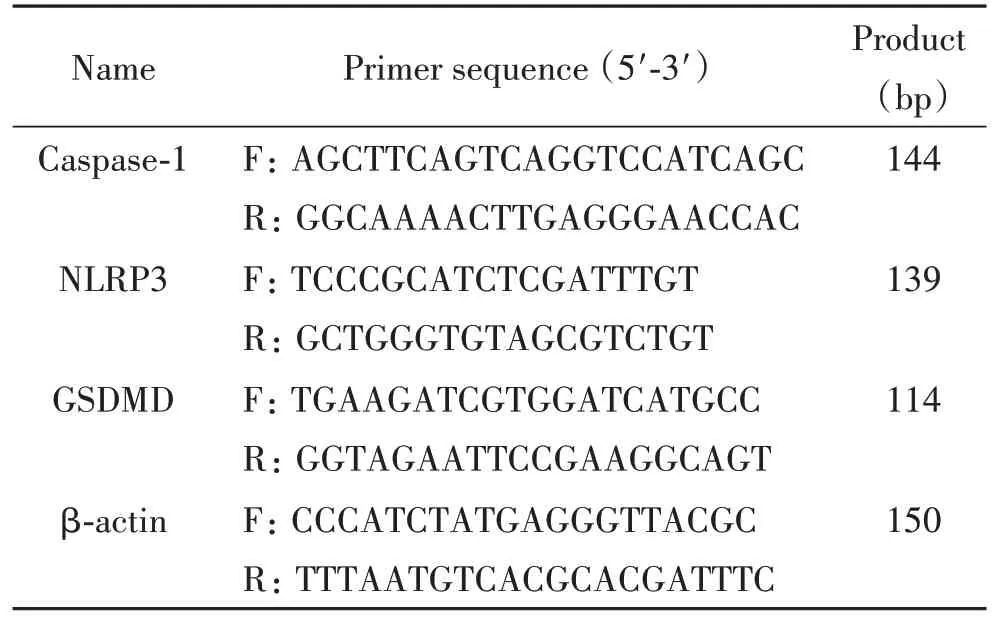
表1 RT-qPCR引物序列Table 1. The sequences of the primers for RT-qPCR
5 统计学处理
采用SPSS 25.0软件进行统计学分析。正态分布的计量资料以均数±标准差(mean±SD)表示。组间均数比较采用单因素方差分析,两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
结果
1 TAC对PTZ致痫大鼠GTCS和MCS潜伏期的影响
在实验过程中,正常组未出现癫痫发作症状;与模型组相比,TAC各治疗组GTCS潜伏期和MCS潜伏期显著延长(P<0.01),见表2。

表2 各组大鼠GTCS和MCS潜伏期比较Table 2. Comparison of GTCS and MCS latency of rats in each group (Mean±SD. n=6)
2 TAC对PTZ致痫大鼠皮层病理形态学的影响
正常组大鼠颞叶皮层脑组织结构清晰,组织无水肿,神经细胞排列规整,胞质胞核染色均匀,核仁清晰,未见充血和炎症细胞浸润;与正常组相比较,模型组大鼠脑组织结构疏松,神经细胞形态不规则,核固缩明显增多,细胞肿胀深染,小胶质细胞和炎症细胞明显增多,毛细血管充血扩张;与模型组相比,各TAC组大鼠皮层上述病变均有不同程度减轻,表现为脑组织结构较紧密,染色较均匀,细胞核固缩数量减少,炎症细胞和小胶质细胞数量减少,毛细血管充血减轻,高剂量组病变减轻更为显著,见图1。
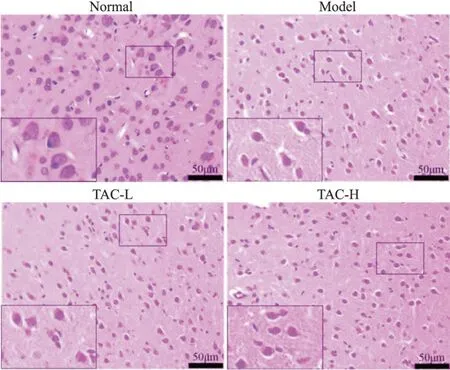
Figure 1. HE staining was used to detect neuronal damage in the cortex of rats in each group (HE staining, scale bar=50 μm).图1 TAC减轻癫痫大鼠皮层区神经细胞损伤
3 TAC对PTZ致痫大鼠皮层神经细胞凋亡的影响
TUNEL染色结果显示,与正常组相比,模型组大鼠皮层中神经细胞凋亡数量显著增多(P<0.01);与模型组相比,TAC低剂量组和高剂量组大鼠皮层中神经细胞凋亡数量显著减少(P<0.01),见图2。
4 TAC对PTZ致痫大鼠皮层NF-κB p65、NLRP3、caspase-1 p20和GSDMD-N蛋白表达的影响
IHC结果显示,正常组大鼠颞叶皮层区NF-κB p65、NLRP3、caspase-1 p20和GSDMD-N蛋白表达较低;与正常组相比,模型组大鼠上述各蛋白表达水平显著升高(P<0.01),阳性细胞呈棕黄色;与模型组相比,TAC各治疗组颞叶皮层区各蛋白表达水平显著降低(P<0.01),见图3。
5 TAC对PTZ致痫大鼠皮层IL-1β、IL-18和TNF-α蛋白表达的影响
IHC检测结果显示,与正常组相比,模型组大鼠皮层中IL-1β、IL-18和TNF-α蛋白表达均显著升高(P<0.05);与模型组相比,TAC各治疗组大鼠皮层中IL-1β、IL-18和TNF-α蛋白表达均显著降低(P<0.01),见图4。
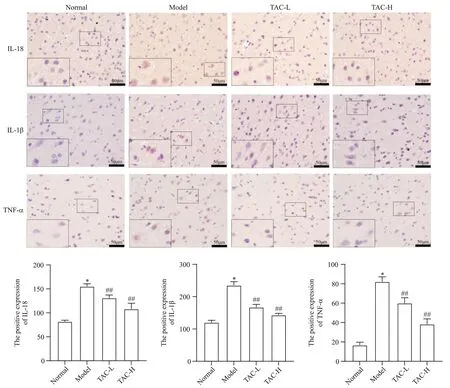
Figure 4. The positive expression of IL-18, IL-1β and TNF-α in the cortex was detected by immunohistochemical staining (scale bar=50 μm). Mean±SD. n=6. *P<0.05 vs normal group; ##P<0.01 vs model group.图4 TAC降低癫痫大鼠皮层IL-18、IL-1β和TNF-α蛋白阳性表达
6 TAC对PTZ致痫大鼠皮层NF-κB p65、NLRP3、pro-caspase-1、caspase-1 p20、GSDMD和GSDMDN蛋白表达的影响
Western blot结果显示,与正常组相比,模型组NF-κB p65、NLRP3、pro-caspase-1、caspase-1 p20、GSDMD和GSDMD-N蛋白表达水平均显著升高(P<0.05或P<0.01);而TAC治疗组上述蛋白表达水平显著低于模型组(P<0.01),见图5。

Figure 5. Protein expression of NF-κB, NLRP3, Pro-caspase-1, caspase-1, GSDMD and GSDMD-N in the cortex of rats in each group detected by Western blot. Mean±SD. n=3. *P<0.05, **P<0.01 vs normal group; ##P<0.01 vs model group.图5 TAC降低癫痫大鼠皮层NF-κB、NLRP3、Pro-caspase-1、caspase-1、GSDMD和GSDMD-N蛋白表达
7 TAC对PTZ致痫大鼠皮层NLRP3、caspase-1和GSDMD mRNA表达的影响
RT-qPCR结果显示,与正常组比较,模型组大鼠皮层中NLRP3、caspase-1和GSDMD的mRNA表达水平显著提高(P<0.01);与模型组比较,TAC各治疗组皮层NLRP3、caspase-1和GSDMD的mRNA表达水平显著降低(P<0.01),见图6。

Figure 6. Relative mRNA expression of NLRP3, caspase-1 and GSDMD in the cortex of rats in each group detected by RT-qPCR.Mean±SD. n=3. **P<0.01 vs normal group; ##P<0.01 vs model group.图6 TAC降低癫痫大鼠皮层NLRP3、caspase-1和GSDMD的mRNA表达
讨论
癫痫是一种复杂的临床综合征。国际抗癫痫联盟认为神经元死亡是导致癫痫反复发作的易感性基础,残存的神经元和增生的胶质细胞等形成异常的神经网络,可导致癫痫的进一步发生发展[18]。神经细胞焦亡与癫痫的发生与发展有关,在神经细胞焦亡过程中伴随着大量促炎细胞因子的释放,激活炎症小体从而引起神经炎症级联反应[19]。NLRP3炎症小体能使磷酸化的caspase-1去磷酸化而活化,导致促炎细胞因子转变为它们的成熟形式,同时活化的caspase-1扣住GSDMD,并将其切割,细胞因子由GSDMD-N形成的蛋白孔释放,进一步激活NLRP3炎症小体[4]。GSDMD是炎性caspases的底物和焦亡的促发因子[20],GSDMD孔N端释放的细胞因子IL-1β和IL-18可促进焦亡[21]。而炎症介质的过度释放可激活NMDA受体和Toll样受体等特定信号传导来参与神经元的兴奋,导致癫痫发作的持续进展[22]。
本实验结果显示,与正常组相比较,癫痫模型大鼠脑组织中TNF-α、IL-18和IL-1β蛋白表达均显著增加,且NLRP3、caspase-1 p20和GSDMD蛋白及mRNA表达也显著增加。这表明PTZ所诱导的慢性癫痫大鼠脑组织中有神经细胞焦亡的发生,同时伴随着大量促炎细胞因子的释放,通过NLRP3炎症小体的激活加剧炎症级联反应,从而进一步促进焦亡的发生和发展。
细胞焦亡是癫痫的重要病理机制之一,如何通过调控NLRP3炎症小体的激活来有效地抑制细胞焦亡,是癫痫防治的关键。如氨基黄酮可以抑制PTZ所诱导的小鼠癫痫模型中海马NLRP3炎症小体的激活,并降低炎症细胞因子水平[23]。研究表明,NF-κB可以激活NLRP3、ASC、GSDMD、caspase-1和IL-1β等焦亡信号因子而促进细胞焦亡[24-25],阻断NF-κB/GSDMD信号可减轻炎症小体诱导的细胞焦亡[26],而且NF-κB对神经炎症和认知功能障碍也具有一定的调节作用[27]。
TAC所包含多种生物碱成份均具有抗炎和抑制细胞焦亡的药理作用,如黄连碱也可抑制TNF-α的产生[28],延胡索提取物可通过NLRP3炎症通路有效缓解大鼠神经根型颈椎病[29]。本实验结果显示,TAC可以显著减少模型大鼠癫痫发作次数和强度,减轻PTZ所致的神经元病理损伤,对癫痫大鼠具有明显的治疗作用,表明TAC可能通过阻断NLRP3炎症小体的激活,抑制GSDMD 及caspase-1的活化,减少IL-1β和IL-18炎症细胞因子的释放,从而减轻癫痫引起的神经细胞焦亡。同时TAC还通过NF-κB信号通路,抑制脑组织中的炎症级联反应,进一步抑制神经细胞焦亡的进展。但TAC是否通过调节NF-κB所介导的焦亡信号通路发挥作用仍需进一步确定。
综上所述,TAC通过NLRP3/caspase-1/GSDMD信号通路,抑制神经炎症级联反应,进一步抑制神经细胞焦亡,从而对PTZ所诱导的慢性癫痫大鼠起到明显的治疗作用。

