RANKL靶向抑制对骨纤维结构不良治疗的研究进展
刘钟毓,白 丁,赵雪峰
0 引 言
骨纤维结构不良(fibrous dysplasia,FD)在我国发病率为 10/100万~30/100万,多见于15岁以下的青少年[1],居良性骨肿瘤首位[2-3]。FD由骨骼干细胞内GNAS基因激活型突变引发[4],其主要病理学改变是正常骨组织被纤维组织替代[5],常累及股骨、胫骨、脊柱、颅颌面骨等部位,可局部单发,也可全身多发[6]。根据累及部位和病损程度的不同,患者表现出不同程度的疼痛、骨骼畸形和骨折等症状[7],严重影响 FD患者生活质量[8]。当FD累及颌骨时还可引起显著的牙槽骨扩张、牙齿移位、错牙合畸形和牙齿发育障碍等症状[9-10]。
1 治疗现状
FD的治疗原则是以观察和药物治疗为主,手术为辅。考虑到部分患者的FD病变具有自限性[11],对早期无症状且不伴病理性骨折的FD患者以定期随访为主;对于已经出现骨痛和骨转化率升高的FD患者,可采用如双膦酸盐(bisphosphonates,BPs)等抗骨质吸收类药物来缓解骨痛、减少骨折风险;对于严重病变导致骨骼畸形或骨折的患者,则需要进行手术治疗[7]。然而,现有的治疗手段并不能满足临床需求。有研究指出BPs对部分FD患者治疗效果不佳,具体表现为疼痛缓解无效[12-14],以及无法延缓病程、预防骨折[15-16]。手术治疗也存在一定局限性,一方面表现为多骨性FD或累及颅面骨、脊椎骨等复杂解剖结构的手术难度高、风险大;另一方面骨骼畸形一旦产生,手术不能完全消除;除此之外,术后复发风险高,尤其是尚处于生长发育期的患者[17-18]。综上,临床上亟需能有效防治FD的新型药物。
陆续有研究提示:FD骨病损区出现的大量破骨细胞,介导严重骨吸收,其骨质破坏程度与RANKL的表达量成正相关[19]。因此,RANKL成为FD的潜在治疗靶点。RANKL通过与破骨前体细胞表面核因子κB受体活化因子(receptor activator for nuclear factor-κ,RANK)特异性结合来促进破骨前体细胞向破骨细胞分化[20],并激活成熟破骨细胞,进一步增加其骨吸收能力[21]。2010年,一种重组人源性抗RANKL单克隆抗体Denosumab(狄诺塞麦,又称地舒单抗、地诺单抗)获得美国食品及药物管理局(Food and Drug Administration,FDA)的批准,用于治疗骨质疏松及继发性骨肿瘤转移事件[22]。
延续了抗骨质吸收在FD治疗中应用的思路,2012年,首个应用Denosumab来治疗FD的临床病例被报道[17]。随后,越来越多的临床医生和科研工作者围绕RANKL靶向抑制对FD的治疗效果进行研究。RANKL靶向抑制表现出优于BPs的FD治疗效果[17,23-28],具体表现为:骨痛缓解、骨骼畸形改善[27,29]、骨转化率降低。Denosumab逐渐成为临床上对BPs治疗效果不佳或产生耐药性时的首选替代药物[30-31]。在实验室研究方面[32-34], RANKL靶向抑制在FD小鼠模型上也展示了出色的治疗效果。值得注意的是,Denosumab的副作用被逐渐报道,包括停药后骨转化率偶有严重反弹[27,35],病程加速,并伴随严重的高钙血症[36]。
本综述将重点围绕RANKL靶向抑制在FD治疗中的有效性和安全性进行讨论。
2 方 法
本综述纳入16篇与RANKL靶向抑制剂治疗FD相关的文章包括:10篇临床病例报道(12个病例)[17,23-29,37,38]、3篇动物实验[32,34,39]和3篇观察性研究[30,35,40]。相关信息整理见表1。
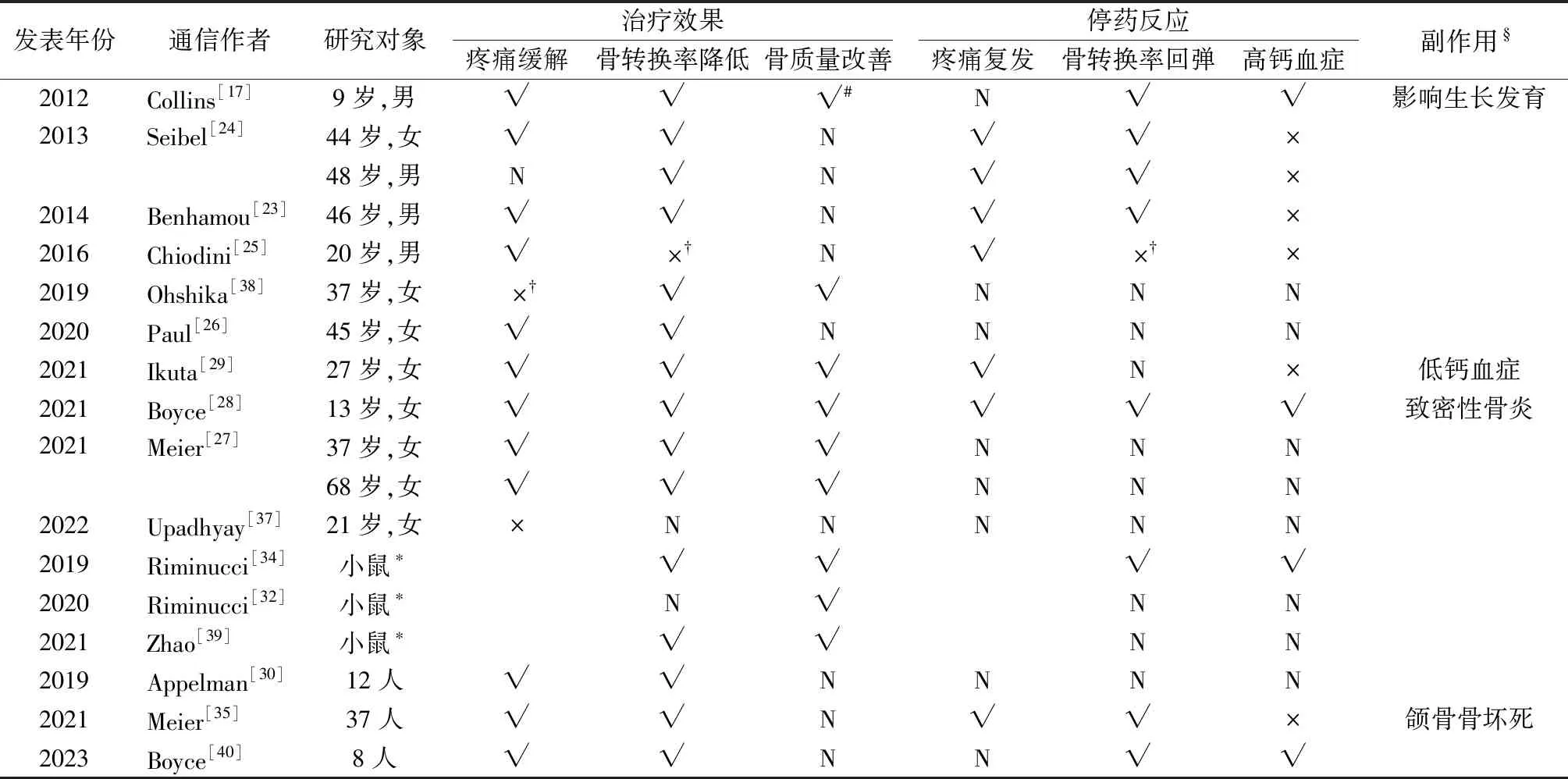
表1 FD的RANKL靶向治疗病例汇总表
3 治疗效果
通过对现有文献的汇总,RANKL靶向抑制对FD治疗中的有效性主要体现为缓解骨痛、降低骨转换率和提高骨质量。
3.1 疼痛缓解
疼痛是FD最常见的并发症之一,据报道81%的成人和49%的儿童FD患者均出现疼痛的症状[41]。疼痛的缓解被纳入为本次药效评价的重要指标。根据目前有具体治疗信息报道的12例病例[17,23-29,37,38],绝大多数患者(11/12)在接受Denosumab治疗后疼痛得到迅速且明显的改善,其中82%的患者(9/11)在此之前有接受BPs治疗无效的治疗史[17,23-28,37]。仅有1例患者在接受Denosumab治疗后疼痛无缓解,值得注意的是该患者被同时诊断为三叉神经痛[37]。FD相关疼痛缓解的具体表现包括:患者自觉疼痛完全消失[23,25]或不再依赖止痛药[17];患者依据疼痛数字评分量表(numerical analog scale,NAS)描述疼痛的严重程度从重度(NAS 7~9)缓解至中度(NAS 4~6)[24,27]甚至轻度(NAS 1~3)[27,29]。相关动物实验中缺乏关于疼痛指标的直接评估,但通过对小鼠的行为学分析可以间接得出RANKL靶向抑制能够有效缓解FD相关疼痛的结论[39]。
现有的研究结果显示RANKL靶向抑制可缓解FD相关疼痛,但其具体治疗机制尚不明确,同时面临长期给药伴随的耐药问题。有报道指出,每次用药后产生的“无痛间隔”会随着用药次数的增多而变短[25]。另有报道指出部分患者在连续用药1.6年后出现耐药,即药物对疼痛的控制程度逐渐降低[35]。上述临床现象背后的生物学机制是解决耐药性的关键,有待进一步探索。
3.2 骨转换率降低和骨密度增加
骨转换指标(bone turnover markers,BTMs)和骨密度(bone mineral density,BMD)是骨病临床监控的核心环节,是本次疗效评估的重要指标。BTMs 是一项敏感性高、特异性强的骨质流失风险预测指标。现有临床数据显示,多数FD患者的BTMs在治疗前后的变化趋势具有高度的一致性,即在治疗前处于高水平,治疗后被控制在正常范围内波动[17,23,24,26-28,34,37-40]。这说明Denosumab可有效降低FD患者的骨转化率,降低病理性骨折风险。
BMD是一项可独立评价骨质流失程度、判断骨质量的指标[42]。多数FD患者在接受Denosumab治疗后BMD显著回升[27-29,38],说明FD导致的骨质流失在治疗后得到有效控制。动物实验进一步证实,RANKL靶向抑制治疗能够延缓疾病进程、提高骨质量,具体体现在原病变区域内编织骨含量减少,骨的刚度和弹性模量提高[32,34,39]。
综上,现有临床研究和动物实验均提示,RANKL靶向抑制治疗能够降低FD患者的BTMs,提高BMD,改善骨质量,从而有效控制疾病的进程。
4 停药反弹现象
随着RANKL靶向抑制在FD治疗中的推广,陆续有关Denosumab停药后疾病复发甚至病程加重的报道引发学界的高度关注。现有临床数据显示,Denosumab治疗有效的FD患者在停药后发生停药反弹现象(rebound phenomenon)的概率是100%[17,23-25],主要表现为不同程度的疼痛、BTMs反弹和高钙血症,上述症状可单一或合并存在。
4.1 停药反弹现象的可能机制
致病基因GNAS的持续性激活突变是FD病变发生和发展的充分且必要条件[19]。除非包含GNAS突变的FD始发细胞大量凋亡、衰竭,GNAS分子信号通路回归或接近正常水平,否则停药后理论上会出现FD病变的复发[39]。
有学者提出假说,治疗前BTMs越高,或Denosumab疗效越明显,停药后反弹现象就越严重[40,43]。该假说与我们对比研究现有临床数据后的结论具有一致性,即Denosumab停药后出现恶性高钙血症的患者[17,28]有以下三个特点:其一,患者年龄小,正处于生长发育期;其二,原发病灶侵袭性强,病灶范围不断扩大;其三,给药策略是每月按时给药,而非依据患者主观上疼痛的复发,这样导致用药频率更高、剂量更大。上述假说和临床观察结论支持生长发育期的患者和原发病灶侵袭性强的患者是停药后发生恶性高钙血症的高风险人群。虽然该结论有待进一步机制研究的证实,但在现阶段的FD停药管理工作中具有一定的参考价值。
未来可以考虑通过对GNAS信号通路水平进行评估,并结合原发病灶严重程度来作为停药或药物剂量调整的指导。
4.2 疼痛复发和BTMs反弹
Denosumab单次给药后疼痛复发和BTMs反弹一般发生在停药的3~6个月后[23,25];连续给药一段时间后的复发时机差异较大,7个月至2年不等[17,28-29],给FD的临床管理带来了巨大的挑战。有研究显示疼痛和BTMs在停药后的波动曲线具有强相关性,提示疼痛的复发与骨代谢水平关系密切[23]。
4.3 高钙血症
目前有关停药后恶性高钙血症的报道共3例[17,28,40],具体表现为恶心、呕吐、心律失常。从Denosumab在骨质疏松治疗的应用中得知,高钙血症的发生与停药后BTMs反弹有关[44],其机制是破骨活动活跃导致骨内大量钙离子释放[45]。FD患者停药后的恶性高钙血症事件的发生率(3/31)低于BTMs反弹的发生率(24/31)。事实上,不少患者在停药后只经历无症状的、轻度的血钙升高,且无需药物介入就能自行恢复[23-25,29,35,40]。这提示,BTMs的反弹不能充分解释恶性高钙血症发生的机制,有待进一步研究。
为防止Denosumab停药后高钙血症的发生,有研究提出可以采用逐步减药的方法作为预防措施[36]。也有研究通过及时补充BPs实现了高钙血症的快速缓解,并提出可以将常规补充BPs作为Denosumab停药后预防高钙血症的措施[28]。
综上,Denosumab停药反弹中恶性高钙血症的发生机制和风险管理有待进一步研究和完善。
5 给药策略
目前尚无针对RANKL抑制剂在FD病例中应用的专家共识。有研究指出Denosumab抑制骨吸收的持续时间呈现剂量依赖性[46],停药后疾病复发与Denosumab在骨内不会长时间停留有关[47]。考虑到包含GNAS突变的FD始发细胞的存在是疾病复发的根本原因[39],有研究建议Denosumab在FD疾病治疗中应长期使用[35-36]。寻找能够稳定维持且有效的最低血药浓度是长期安全用药的关键。
目前尚无Denosumab在FD患者体内的药物代谢动力学研究,临床上只能参考该药物在实体肿瘤骨转移患者[48]和骨质疏松患者[49]中的推荐剂量,因此该药物在FD治疗中的使用频率和剂量相差较大。例如,目前已报道的最低剂量是每3个月皮下注射60 mg Denosumab[27];最高剂量是在首月每周皮下注射120 mg Denosumab,此后给药频率和剂量递减[29]。除此之外,还有依据患者的体重计算剂量[17,26],或依据患者主观疼痛来决定给药时机的案例(表2)[25]。以上病例都获得了较好的治疗效果。需要注意的是,一项基于实体肿瘤骨转移病例的药物代谢动力学研究指出,没有必要根据患者的体重、年龄、种族和肿瘤类型来对剂量进行调整,因其药物代谢动力学特征是基本一致的[50]。

表2 Denosumab给药策略汇总表
基于目前可分析的临床资料,现阶段推荐低剂量、长期给药、慎重停药的用药原则。未来还需要更多的研究来探索最佳给药策略。
6 副作用
由于Denosumab应用于FD治疗的临床经验有限,目前鲜有副作用的报道。然而,该药物在骨质疏松和骨肿瘤治疗中应用广泛,在展示出显著治疗效果的同时,也出现了一系列副作用,均与BTMs的抑制有关,具体表现为以下5个方面。
6.1 颌骨骨坏死
颌骨骨坏死(osteonecrosis of the jaw,ONJ)是一种抗骨吸收药物治疗相关的罕见严重不良事件[48],表现为颌面部骨质的进行性破坏[51]。在骨巨细胞瘤(giant cell tumor of bone,GCTB)的研究中发现,大剂量Denosumab的使用会导致1%~5% ONJ的发生率[48]。颌骨骨坏死的发病机制目前尚不明确,有研究认为与骨重建受到抑制和血管生成受到抑制有关[52]。截至目前,已有一位FD患者被报道在接受RANKL靶向治疗过程中出现ONJ[35]。需要注意是,有研究认为改用Denosumab前的BPs治疗可能是加剧颌骨骨坏死发生的一个危险因素[51]。
6.2 低钙血症
在使用Denosumab治疗骨相关事件(skeletal-related events,SREs)的过程中,低钙血症是一种常见的副作用[53],这是由于抗吸收药物会抑制破骨细胞介导的骨骼钙离子的释放。截至目前,已有一位FD患者被报道在接受Denosumab治疗的过程中出现低钙血症。考虑到低钙血症作为Denosumab的副作用在骨质疏松的治疗中已被大量报道[29],有研究建议BTMs高的患者在治疗前应该常规补充钙和维生素D[25],并建议采用较低的Denosumab起始剂量,当BTMs降低后再逐步提高剂量[17,28]。
6.3 非病灶区骨密度增加
由于全身用药的缘故,患者在接受Denosumab治疗后BTMs降低,在病灶区体现为对病理性骨质破坏的控制,而在非病灶区则体现为骨密度的增加。目前已有一例相关报道:一名13岁FD患者在经历3.5年的Denosumab治疗后出现非病灶区骨密度增高。庆幸的是Denosumab对非病变区的影响在该患者身上是可逆的,患者在停药2年后非病灶区骨密度逐渐恢复正常[28]。在未来临床工作中,需要针对RANKL靶向抑制治疗有可能带来的非病灶区的骨密度增加进行严格监测。
6.4 生长发育和牙齿萌出
Denosumab能通过抑制骨吸收影响生长发育期的骨塑建(bone modeling)[54]。有动物研究显示,大剂量的Denosumab对骨骼生长发育和牙齿的萌出存在抑制作用[55],然而,临床上尚未有此不良反应的报道[17,56],这可能与用药时患者年龄和牙齿、骨骼发育状态相关。仅一项临床研究关注了Denosumab对牙齿和身高的副作用[17],并证实Denosumab对生长没有显著的不良影响。故RANKL靶向治疗是否对儿童生长发育和牙齿萌出存在负面影响有待进一步论证。
6.5 牙颈部外吸收
有个别关于全牙列在Denosumab停用后出现牙颈部外吸收的报道[57],这可能与停药后BTMs和破骨细胞活性的升高有关[58]。尽管目前FD的RANKL靶向治疗中暂未出现此类副作用,但未来全面的口腔检查应该成为FD患者的常规例行检查。
7 结语与展望
现有研究证明RANKL靶向抑制治疗能够有效缓解FD患者的疼痛,延缓疾病进程,提高骨质量。但仍然缺乏给药策略的共识[53,59]。同时,应该注意监测RANKL靶向抑制治疗结束后的反弹效应和高钙血症,并给予及时治疗,这在重症FD患者中显得尤为重要[40]。除此之外,RANKL靶向抑制对疼痛的治疗机制,停药反弹现象的产生机制、预防和管理,以及长期给药的风险管理和副作用等方面还存在大量的研究空白,这些都将是未来的研究重点。

