浓缩生长因子促进大鼠下颌骨联合部成骨作用的初步研究
卢 鹏,陈祉宏,杨月美,尹忠浩,吴福丽,宋晓萌,吴煜农
浓缩生长因子(concentrated growth factor,CGF)是通过差速离心得到的最新一代血小板浓缩物,几乎含有离心血液内全部的生长因子[1-3]。与一代血小板浓缩物——富血小板血浆(platelet rich plasma,PRP)相比,不需添加凝血酶,避免了引起患者的过敏及排异反应的可能性;与二代血小板浓缩物——富血小板纤维蛋白(platelet rich fibrin,PRF)相比,CGF具有更加致密的网格结构[4],其缓慢释放生长因子的过程更接近组织愈合的自然过程[5-6]。CGF取材方便,制备简单、高效,并具有一定的抗炎作用,已经在口腔种植领域广泛应用[7-10];但是,影响其促进骨组织愈合的具体因素尚未完全清楚,是否单独或联合其他生物材料应用于骨组织缺损处,尚未达成共识[11]。
骨缺损的实验模型包括部分骨缺损、节段骨缺损、骨钻孔缺损等[12]。然而在不使用任何材料填充缺损的情况下,这些骨缺损也可以进行一定程度的自我修复[13]。如果我们有一个非手术制造缺损的骨缺损模型,那么这个模型就可以更好地避免骨组织自我修复带来的观测上的干扰。
大鼠下颌骨由两块骨块构成,其间的下颌骨联合由纤维结缔组织连接[14]。因为该联合处生理情况下不会闭合,所以可作为一种先天性骨缺损模型[15]。在本研究中,我们按分组将CGF和成骨材料填入大鼠下颌骨联合中,并观察该天然缺损是否生成新的骨组织,使缺损愈合。成骨结果通过显微计算机断层扫描(micro-CT)和组织学进行评估。
1 材料与方法
1.1 材料
1.1.1 实验动物 SPF级雌性SD大鼠24只,4周龄,体重90~110 g,由南京医科大学实验动物中心提供。动物生产许可证号:SCXK(浙)2019-0001。动物伦理审查编号:IACUC-2011044。
1.1.2 设备与试剂 Geistlich Bio-Oss胶原骨,注册证编号:国械注进20153460268(Geistlich Pharma AG瑞士盖氏制药有限公司);TR18 CGF血纤维蛋白离心机(江苏创英医疗器械有限公司);micro-CT(skyscan 1172,比利时)。
1.2 实验方法
1.2.1 分组手术及取材 SD大鼠随机分为3组,每组8只。第1组,胶原骨组;第2组,CGF+胶原骨组;第3组,CGF组。在第3、6个月分两批处死动物,并处理解剖获取大鼠下颌骨。
1.2.2 建立大鼠下颌骨联合缺损模型 ①大鼠腹腔注射1%戊巴比妥钠(40 mg/kg)麻醉,然后将大鼠仰卧位固定,颌下备皮,消毒铺巾。②沿下颌骨边缘设计10 mm长新月形的切口。③切开并分离皮肤,充分暴露骨膜。④切开骨膜至骨面,剥离子钝性剥起骨膜,暴露大鼠左右下颌骨间纤维结缔组织(图1A)。⑤刮除双侧下颌骨间纤维结缔组织(图1B)。⑥加入填充材料(图1C、D)。⑦缝合骨膜(图1E)。⑧检查口内是否与下颌骨联合相通(图1F)。⑨缝合皮肤。
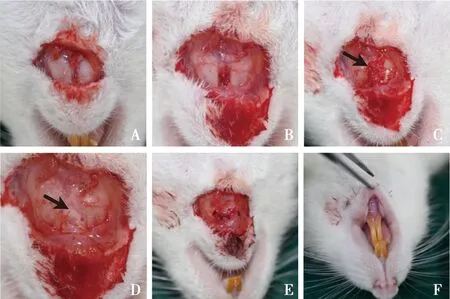
A:切开皮肤及皮下组织;B:剥离骨膜并刮除双侧下颌骨间结缔组织;C:于缺损处填入胶原骨(箭头示);D:于缺损处填入CGF(箭头示);E:缝合骨膜瓣;F:检查口内未穿通
1.2.3 CGF的制备 采用真空采血管从大鼠颈静脉抽取静脉血3 mL,置于TR18 CGF血纤维蛋白离心机,变速离心13 min后,可见采血管中分为三层:最上层的血浆层,中间的CGF层和最下方的红细胞层(图2A)。倒出上清液后,采用无菌镊子夹出CGF和下方的红细胞凝块,剪除凝块后得到的黄色胶冻样物质即为CGF凝胶(图2B)。

A:采血管中分为三层,最上层的血浆层、中间的 CGF 层和最下方的红细胞层;B:黄色胶冻样物质即为CGF
1.2.4 micro-CT分析放射学骨愈合及骨密度情况 采集的大鼠下颌骨使用skyscan 1172 micro-CT进行分析。使用以下参数:电压为55 kVp;电流72 μA;每隔15.6 μm对下颌骨进行扫描。使用CTVox软件(Bruker,Konitch,比利时)生成扫描样品的3D模型。获得的3D图像用于下颌骨联合愈合的放射学检查。使用放射学愈合量表对图像进行评估,0分:无明显新骨形成;1分:沿下颌骨联合边缘皮质骨增厚;2分:较多新骨生成伴明显的间隙;3分:骨完全愈合或仅伴有微小裂缝。为每个样本的下颌骨联合部中线处选择ROI区域,计算骨密度(bone mineral density)和BV/TV值。
1.2.5 组织学分析组织学骨愈合情况 micro-CT拍摄后,将所有样本固定在4%多聚甲醛溶液中48 h。冲洗后脱钙处理,包埋制作组织学切片。HE染色后,组织学切片采用Salkeld等报告的原始量表进行评估,评分0分:纤维愈合伴微量新软骨/骨形成;1分:纤维愈合伴少量新软骨/骨形成;2分:由软骨愈合;3分:骨完全愈合。
1.3 统计学分析
使用Graphpad Pism 9.5软件进行统计分析。计量资料用均数±标准差表示,多组比较采用单因素方差分析。P<0.05表明结果有统计学差异。
2 结 果
2.1 大体观察
解剖观察大鼠下颌骨联合处成骨情况。CGF+胶原骨组第3个月时于大鼠下颌骨联合处可探及部分硬组织,但并未连续(图3A),第6个月时,可见大鼠下颌骨联合处已基本由新骨连接,探针探诊可见硬组织(图3B);CGF组第3个月时,大鼠下颌骨联合处仅可见结缔组织,探诊未及硬组织(图3C),第6个月时同样未能探及硬组织(图3D);胶原骨组第3个月时,于大鼠下颌骨联合处可探及颗粒状硬物(图3E),第6个月时,可及少量光滑硬组织,但并未连续(图3F)。
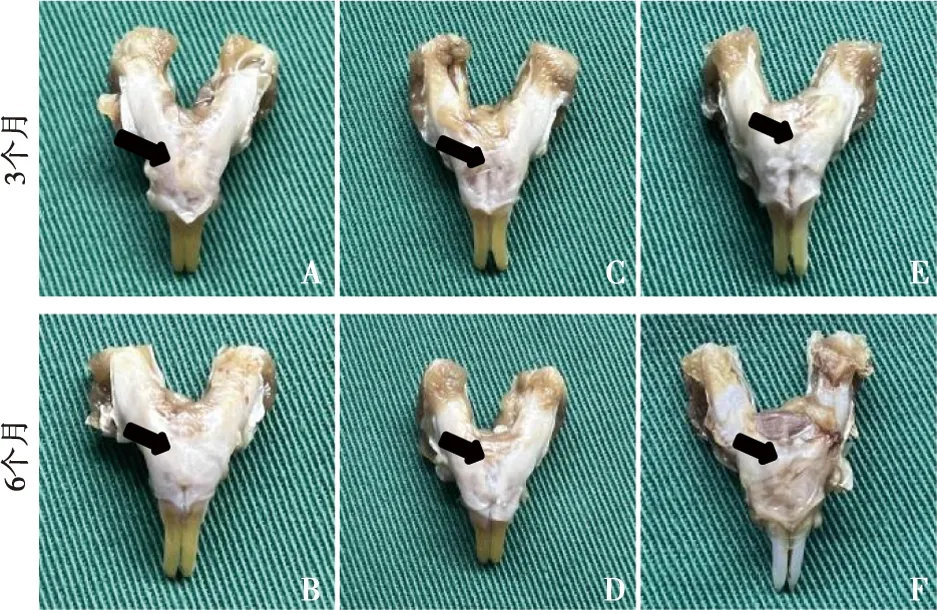
A:CGF+胶原骨组第3个月时;B:CGF+胶原骨组第6个月时;C:CGF组第3个月时;D:CGF组第6个月时;E:胶原骨组第3个月时;F:胶原骨组第6个月时
2.2 micro-CT分析
植入材料后第3、第6个月,分两批处死大鼠,每批每组各4只,取材后进行micro-CT扫描评估大鼠下颌骨联合处骨量及形态变化。第3个月时,CGF+胶原骨组标本显示在下颌骨联合处有大量骨形成,但伴有较为明显的间隙(图4A);CGF组(图4B)和胶原骨(图4C)组则仅有少量的新骨生成,主要表现为下颌骨边界的皮质骨增厚。第6个月时,CGF+胶原骨组标本则主要表现为完全的骨愈合,仅伴有微小裂纹,同时较第3个月时,新生成的骨表面更为光滑,与周围原有下颌骨结合更为协调(图4D);胶原骨组(图4E)和CGF组(图4F)除少数标本表现为较多新骨生成伴有较明显的间隙,依然仅有下颌骨边界的皮质骨增厚。通过既定标准对每个标本进行打分(表1),并对各组评分进行统计学分析。
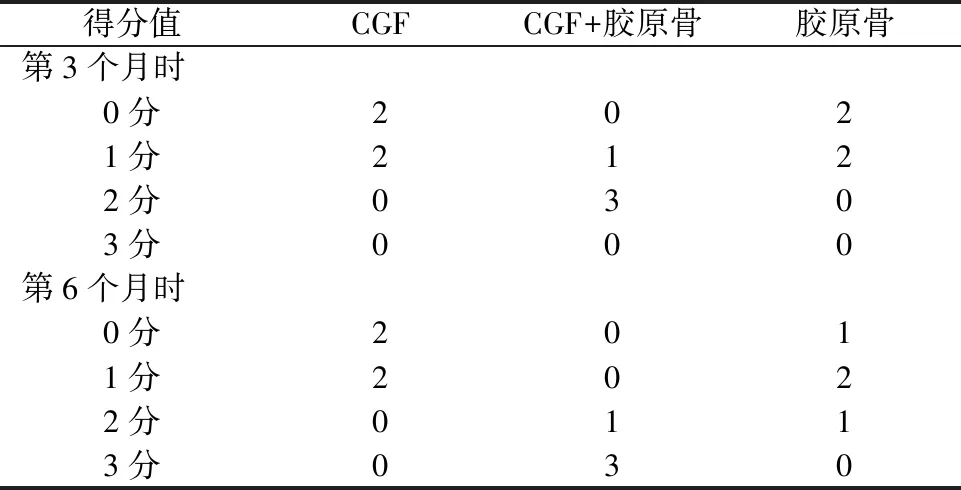
表1 各组大鼠放射学成骨评分

A:第3个月时,CGF+胶原骨组可见大量骨形成,但伴有较为明显的间隙;B:第3个月时,CGF组仅有少量的新骨生成,主要表现为下颌骨边界的皮质骨增厚;C:第3个月时,胶原骨组可见少量新骨;D:第6个月时,CGF+胶原骨组为完全的骨愈合,仅伴有微小裂纹,同时表面更为光整;E:第6个月时,胶原骨组为较多新骨生成伴有较为明显的间隙;F:第6个月时,CGF组仅有骨质增多
进行统计学分析可知,第3个月时,CGF+胶原骨组评分要明显高于CGF组和胶原骨组(P=0.026 6,P=0.026 6),而CGF组和胶原骨组间并无统计学差异;第6个月时,CGF+胶原骨组评分与CGF组和胶原骨组相比,具有显著优势(P=0.002 1,P=0.010 1),而胶原骨组评分看似优于CGF组,却并无统计学差异(图5)。

A:第3个月时,各组得分分析;B:第6个月时,各组得分分析;*:P<0.05,**:P<0.01,ns:无明显差异
将样本的成骨区域设定为ROI(region of interest)区域,对其进行逐个分析(表2)。结果显示第3个月时,CGF+胶原骨组骨密度(BMD)显著高于CGF组(P=0.003 4),但与胶原骨组相比差异无统计学意义(P=0.074 7);而第6个月,CGF+胶原骨组BMD较CGF、胶原骨两组皆有显著差异(P=0.000 9,P=0.043 8)。在micro-CT分析中,BV/TV表示骨组织体积与组织体积比值,可直接反映骨量变化情况,比较ROI区域内各组骨组织体积占比(表3)。第3个月时,CGF+胶原骨组BV/TV明显优于CGF组和胶原骨组(P=0.001 4,P=0.014 7)。第6个月时,CGF+胶原骨组BV/TV同样优于CGF组和胶原骨组(P=0.000 2,P=0.001 9)。

表2 各组BMD值

表3 各组BV/TV值
2.3 组织学观察
通过HE染色发现, 其中第3个月时, CGF+胶原骨组(图6A)显示双侧下颌骨表面有新生成的骨,但并未接续,其间充满纤维结缔组织,周围分布有胶原骨中所含多孔骨颗粒,经Masson染色可发现中间区域为纤维结缔组织,而非新生骨组织(图6B);第6个月时,CGF+胶原骨组(图6C)可见双侧下颌骨间由新生成的骨组织连续,其中可见成骨细胞,Masson染色证实中间部分为骨组织(图6D)。第3个月时,CGF组可见少量骨质增厚(图6E),Masson染色表明中间仍为纤维结缔组织(图6F);第6个月时,CGF组可见较多骨质增厚(图6G),但Masson染色表明主要为纤维结缔组织(图6H)。第3个月时,胶原骨组表现为少量骨质增厚及大量骨粉颗粒(图6I),Masson染色证实了这一点(图6J);第6个月时,胶原骨组表现为较多骨质生成,但并未连续(图6K),Masson染色表明除边缘增厚的骨质外,主要为纤维结缔组织(图6L)。
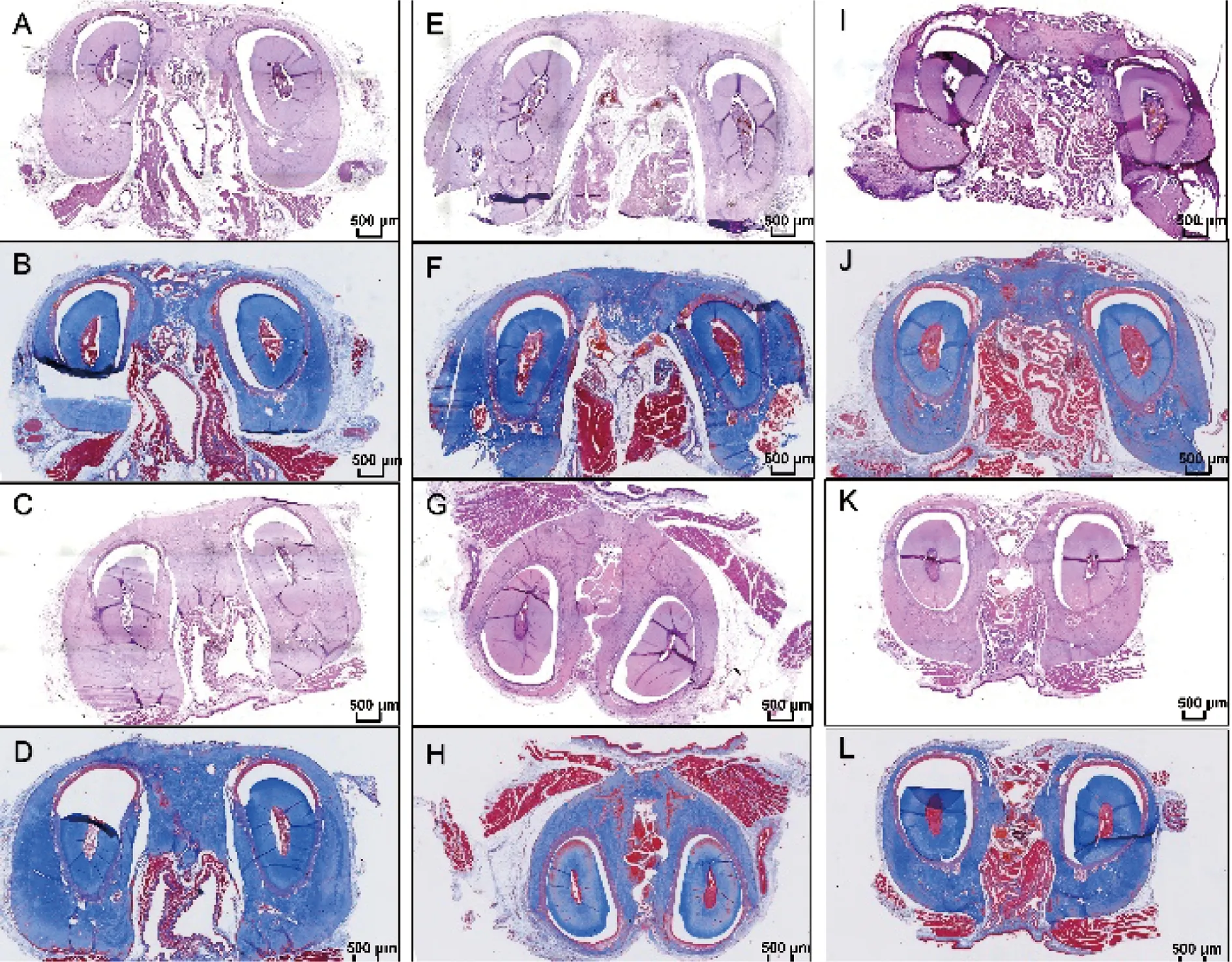
A:第3个月时,CGF+胶原骨组HE染色;B:第3个月时,CGF+胶原骨组Masson染色;C:第6个月时,CGF+胶原骨组HE染色;D:第6个月时,CGF+胶原骨组Masson染色;E:第3个月时,CGF组HE染色;F:第3个月时,CGF组Masson染色;G:第6个月时,CGF组HE染色;H:第6个月时,CGF组Masson染色;I:第3个月时,胶原骨组HE染色;J:第3个月时,胶原骨组Masson染色;K:第6个月时,胶原骨组HE染色;L:第6个月时,胶原骨组Masson染色
在CGF+胶原骨组标本中,在新生骨中可见大量血管组织,血供丰富;箭头所示区域骨质的结构呈板层状,为骨板结构,该处骨强度较高;五角星所示区域可见到矮柱状单层排列并与相邻细胞突起相连的成骨细胞(图7)。
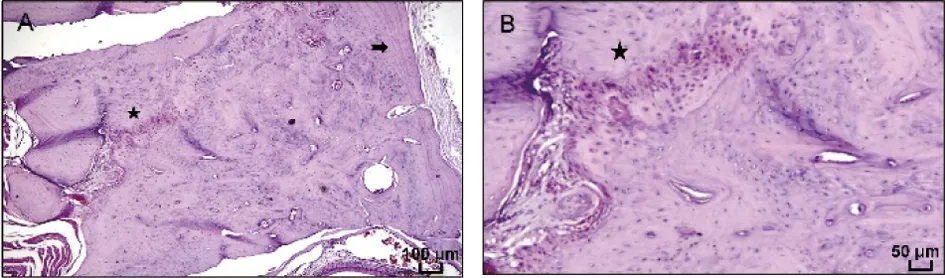
A:大鼠下颌骨HE染色( ×5);B:大鼠下颌骨HE染色( ×10);箭头:板层骨;五角星:成骨细胞
CGF+胶原骨组在第3个月时评分显著优于CGF组和胶原骨组(P=0.003 8,P=0.003 8),而CGF组和胶原骨组间并无统计学差异;第6个月时,与CGF组和胶原骨组相比,CGF+胶原骨组评分依然具有显著优势(P=0.008 2,P=0.019 4),胶原骨组评分略微高于CGF组,然而在统计学分析上并无显著差异(图8)。

A:第3个月时,各组HE染色比较;C:第6个月时,各组HE染色比较;*:P<0.05,**:P<0.01,ns:无明显差异
3 讨 论
CGF作为新一代血液提取物,含有高浓度的生长因子,如转化生长因子(transforming growth factor, TGF)、血小板生长因子(platelet derived growth factor, PDGF)、血管内皮生长因子(vascular endothelial growth factor,VEGF)、骨形态发生蛋白-2(bone morphogenetic protein-2, BMP-2)等[2]。它们对骨组织的形成至关重要。Pang等[16]证实BMP-2信号通路的激活可以促进人成骨细胞的增殖和分化。Rochira特别研究了CGF体外诱导人骨髓间充质干细胞(human bone marrow mesenchymal stem cell, hBMSC)成骨分化的能力,证实了单独使用CGF可诱导hBMSC成骨分化。其他一些体内、体外研究也证实,CGF可诱导成骨细胞分化[17-18],促进新骨形成。CGF具有强纤维蛋白凝胶结构,类似于天然的血凝块。CGF在应用后不会迅速溶解,在一些相关研究中发现,CGF在第一阶段即应用后24 h内释放生长因子的主要来源于活化的血小板;第二阶段的释放高峰发生在14~28 d[19],可能是来自CGF中的纤维蛋白结构降解和白细胞产生的生长因子[20]。有研究观察了CGF膜的微观结构,并评价其作为rhBMP-2在裸鼠皮下组织传递支架的能力[21]。证明CGF膜可作为rhBMP-2的短期生物支架。因此,CGF提供了较高浓度的生长因子并可持续释放,促进了细胞增殖和成骨分化,同时还有一定的成骨支架作用。
在本研究中,CGF+胶原骨联合成骨效果最好,在成骨量和骨结构重建方面均优于其他各组。这可能是因为胶原骨为早期成骨细胞的附着提供了可靠的支架;CGF可在术后早期释放生长因子,促进成骨细胞的分化和增殖[17]。中后期,CGF凝胶被吸收到骨颗粒中,血管组织形成增多,局部血管化增强,营养供应增加,骨修复和再生过程中受各种生长因子调节,骨组织形成增多。这也与HE染色切片观察到的结果一致。而CGF组也有一定的新骨生成,但其单独填充的骨缺损区未观察到足够数量的新骨组织,其原因可能是成骨细胞的增殖分化需要复杂的微环境,受多种生长因子和途径的调控。虽然CGF可以起到短期支架的作用,同时其生长因子的释放可达14~21 d,但在漫长的成骨过程中仍是相对较短的。另一个可能的原因是受限骨缺损面积较大,成骨细胞无法得到支架材料的支撑。缺乏稳定的骨分化诱导环境导致缺损中心区域仅有少量骨形成,而大部分被纤维组织覆盖。
1986年Schmitz等[22]首次提出了临界性骨缺损的概念,并将其定义为缺损后不做任何处理无法自愈的最小骨缺损尺寸。对于临界骨缺损尺寸的大小,还未完全达成一致[12],同时在许多实验中,即使是达到临界尺寸,不做任何处理在缺损边缘依然会有新生骨质,这就对实验构成了干扰。而大鼠下颌骨的缺损是天然的,终身不愈的,很好地避免了这一问题[13,15]。大鼠下颌骨联合部骨缺损模型具有其独到之处,其双侧皆为皮质骨,可以更好地模拟一些临床中遇到的问题,如牙槽突裂等。
本实验也有一些缺点,大鼠骨骼系统更为原始,该系统不具有哈弗斯系统管式的皮质重塑,反映的成骨情况与人类有一定的不同[23];在手术中,并未于双侧下颌骨表面制作滋养孔,这可能影响了实验区的血供及成骨、破骨细胞的来源;术后没有采用合适的方法将大鼠双侧下颌骨进行固定,虽术后采用软食喂养减少下颌骨受力,但双侧下颌骨间仍有一定动度,不能提供足够稳定的环境,这使得自两侧增厚新生成的骨质较难在中间区域愈合,同时术后的取材过程也可能对成骨区域造成一定损伤。在以往的实验中,往往选择观测手术后8周[14]和12周[4]时的成骨情况,在我们的预实验中发现,12周时已可观测到较为明显的差异性,同时考虑胶原骨作为成骨支架可长时间留存,为了进一步观测远期差异性,选取了术后第3、6个月两个时间节点。
综上所述,在第3、6个月时,CGF+胶原骨组在放射学及组织学成骨上,较CGF组和胶原骨组都有更好的表现,而单独应用CGF较单独应用胶原骨并无优势。通过实验,我们认为CGF含有多种生长因子,可促进骨生成。CGF与胶原骨联合使用可以明显促进骨缺损的修复,但单独使用CGF对骨缺损的效果并不理想。

