超小剂量利妥昔单抗治疗ANCA相关性血管炎一例
吴海婷,李 航
中国医学科学院北京协和医院肾内科,北京 100730
患者男性,61岁,因“咳嗽2年余,发现血肌酐(serum creatinine,Scr)持续升高10个月,尿量减少3周”,于2018年12月9日收住北京协和医院肾内科。
2016年3月患者无诱因出现咳嗽、咳白色痰,偶有活动后气短,此后症状多于夏季好转、冬季加重。于当地医院诊断为“间质性肺炎”,间断服用抗生素(具体不详)、百令胶囊等中药治疗。2018年2月患者自觉尿中泡沫增多,不伴下肢水肿,就诊于当地医院,查Scr 115 μmol/L(↑),具体情况不详,未予治疗。2018年11月,双下肢出现轻度水肿,尿量略减少,无肉眼血尿,进一步查尿常规:潜血+++、红细胞异形率90%、尿蛋白±,Scr 125 μmol/L(↑),予以肾炎康复片、金水宝胶囊治疗。2周后出现发热,体温高峰为38.2 ℃,伴有咳嗽、咳白痰、气短、双下肢水肿加重,尿量进一步减少至约600 mL/d。辅助检查:白细胞9.9×109/L,中性粒细胞7.83×109/L,血红蛋白 121 g/L,血小板 299×109/L;尿常规同前;Scr 149 μmol/L(↑),C反应蛋白80.8 mg/L(↑)。胸部CT:双肺间质纤维化。泌尿系超声未见异常。予患者头孢类抗生素、利尿剂、非甾体抗炎药等治疗效果不佳,为进一步诊治,1周后就诊于北京协和医院肾内科门诊。查Scr升至232 μmol/L,抗核抗体、抗双链DNA抗体(-);抗中性粒细胞胞浆抗体(antineutrophil cytoplasmic antibodies,ANCA):抗髓过氧化物酶(myeloperoxidase,MPO)-ANCA>200 RU/mL;抗肾小球基底膜抗体(-);血清免疫固定电泳(-)。考虑ANCA相关性血管炎,自2018年12月6日起予以泼尼松龙65 mg/d及莫西沙星0.4 g/d抗感染治疗。患者体温降至36.8 ℃,咳嗽、咳痰较前减轻,尿量较前无变化。为进一步治疗收入北京协和医院肾内科病房。患者自发病以来体质量较前减少5 kg。既往史:双耳“噪音聋”(职业病)8年,右侧助听器辅助听力。否认高血压、冠心病、糖尿病等慢性病史。个人史:吸烟25年,每天1包,已戒烟15年;饮白酒35年,已戒酒5年。查体:体温36.5 ℃、心率65次/min、呼吸频率17次/min、血压130/70 mm Hg(1 mm Hg=0.133 kPa)、血氧饱和度96%(自然状态下)、体质量97 kg。双下肺听诊可闻及Velcro啰音,心、腹部未见异常,双下肢轻度水肿。
患者中老年男性,慢性病程,急性加重。患者存在多系统表现:(1)肾脏受累突出,表现为大量异形为主的镜下血尿、少尿、慢性肾功能不全急性加重,符合急进性肾小球肾炎表现;(2)呼吸系统症状,即慢性咳嗽、咳痰,影像学检查提示肺间质病变;(3)近期发热,给予抗生素治疗效果不佳,行糖皮质激素治疗有效。从一元论角度考虑系统性疾病可能性大。免疫学检查提示抗MPO-ANCA强阳性,抗核抗体、抗肾小球基底膜抗体阴性,且无其他继发因素相关临床表现,考虑诊断为ANCA相关性血管炎。入院后拟完善肾穿刺活检以获得ANCA相关性血管炎的组织病理学结果,并评估病变的急慢性程度以指导治疗及预后;同时应评估呼吸系统及心脏、神经系统等潜在靶器官的受累情况。导致患者肾脏病变的因素除ANCA相关性血管炎外,还需警惕其他合并因素。患者起病时有反复抗生素及中药使用史,可部分解释慢性肾功能不全;而病情加重后又有非甾体抗炎药物使用史,需警惕在急进性肾小球肾炎基础上合并药物性肾损伤可能,进一步行肾活检病理学检查可协助诊断。
患者入院监测Scr最高升至514 μmol/L。痰细菌、真菌、结核涂片+培养,痰耶氏肺孢子菌-DNA、巨细胞病毒-DNA、血培养均未见病原学证据。胸部CT示双肺多发磨玻璃淡片影,双肺下叶蜂窝网格影(图1)。呼吸科会诊考虑血管炎相关肺间质病变合并感染不除外。心脏超声示左心房轻度增大,左室射血分数 68.8%。患者入院2 d后行肾穿刺活检,结果见图2。免疫荧光结果呈阴性;光镜下可见26个肾小球、6个球性硬化、2个细胞性盘状体、1个大型及2个小型细胞性新月体;可见大量襻坏死灶,新月体内可见纤维素样坏死;肾小管管腔内可见大量红细胞管型;间质可见弥漫分布的水肿伴大量单核为主的炎症细胞浸润。病理学诊断为坏死性肾小球肾炎;结合患者临床表现符合小血管炎肾损害。患者ANCA相关性血管炎诊断明确,根据2022年美国风湿病学会及欧洲抗风湿病联盟(American College of Rheumatology/European League Against Rheumatism,ACR/EULAR)分类标准,临床分型为显微镜下多血管炎(得分12分,≥5分可诊断)[1];肾、肺受累,肾脏病理分型为混合型[2]。
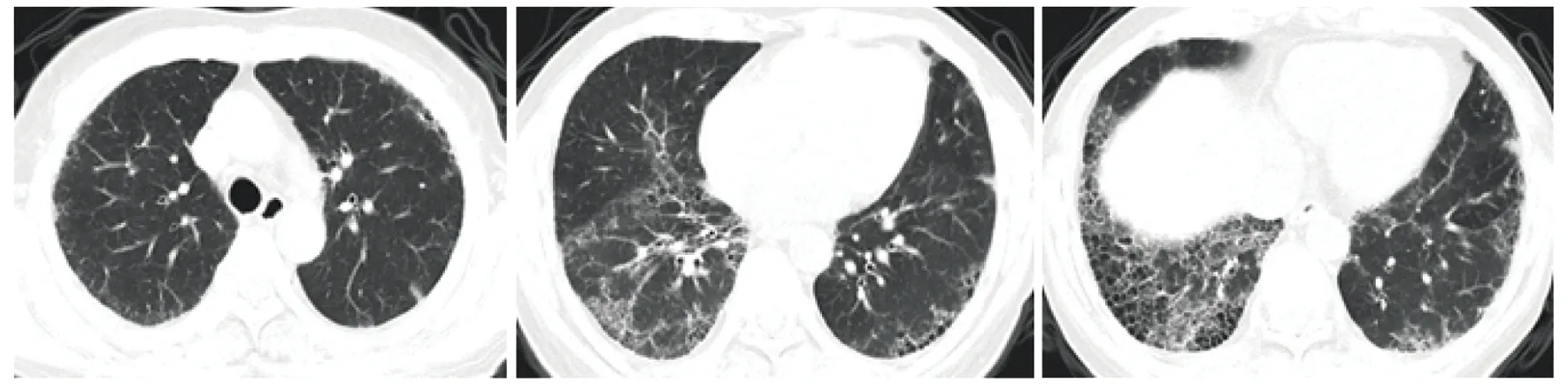
图1 患者胸部CT示双肺多发磨玻璃淡片影,双肺下叶蜂窝网格影
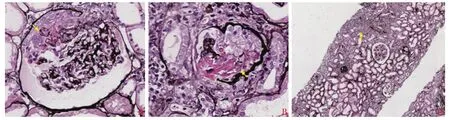
图2 患者肾组织过碘酸六胺银切片染色
本例患者入院后分别给予甲基强的松龙1 g×3 d及500 mg×3 d 冲击治疗2次,序贯甲基强的松龙60 mg/d,联合双膜血浆置换5次。鉴于MPO-ANCA阳性,且肾功能损害严重,给予环磷酰胺50 mg/d。此外,为预防感染给予复方磺胺甲恶唑(磺胺甲恶唑0.4 g,甲氧苄啶0.08 g)1片/d。至2019年10月甲基强的松龙已减量至4 mg/d,环磷酰胺累积剂量为12.5 g。复查Scr逐渐下降并稳定在190 μmol/L左右;尿常规(流式法):红细胞21.6(0~7.5)/μL,尿蛋白(±);抗MPO-ANCA转为阴性。
ANCA相关性血管炎的治疗分为诱导缓解及维持缓解2个阶段。在诱导缓解期,标准治疗方案为糖皮质激素联合环磷酰胺或利妥昔单抗,病情严重者可先予以糖皮质激素(1~3 g)冲击治疗;伴有急进性肾小球肾炎或肺泡出血者可考虑联合血浆置换[3]。诸多临床研究表明环磷酰胺和利妥昔单抗均是一线诱导治疗药物[4-5],但在严重肾功能不全(Scr>354 μmol/L)患者中利妥昔单抗的研究较少、证据尚不充分,应考虑首选环磷酰胺。而利妥昔单抗对于高复发风险患者,如抗蛋白酶3(proteinase 3,PR3)-ANCA阳性的患者更有利;对于有生育需求者及虚弱的老人,也可优选利妥昔单抗[3]。
ANCA相关性血管炎5年的复发风险为30%~50%。因此,在急性期病情缓解后,免疫抑制剂的长期维持治疗是必要的,目前一线推荐药物包括硫唑嘌呤和利妥昔单抗。研究显示经利妥昔单抗治疗的复发比例更低,尤其是对于高复发风险患者[6]。高复发的风险因素包括诊断为肉芽肿性多血管炎、血清PR3-ANCA阳性、耳鼻喉受累、复发史、治疗结束时ANCA阳性或ANCA抗体水平升高、诱导缓解期间环磷酰胺剂量不足等。本例患者进入维持治疗阶段,鉴于其不存在高复发的风险因素,硫唑嘌呤和利妥昔单抗均可使用。考虑到硫唑嘌呤为口服制剂,使用方便,且价格较低,故给予硫唑嘌呤50 mg/d进行治疗。
采用硫唑嘌呤治疗10 d后,患者出现发热、咳嗽加重伴咳黄痰、气短。查血常规:白细胞13.14×109/L(↑)、中性粒细胞11.26×109/L(↑)、淋巴细胞0.61×109/L(↓)、血红蛋白107 g/L(↓)、血小板145×109/L、降钙素原43 μg/L(↑);痰细菌、真菌、结核培养阴性;胸部CT示双肺磨玻璃影较前略加重。予以莫西沙星抗感染治疗并停用硫唑嘌呤,治疗3 d后患者体温正常,咳嗽、咳痰症状好转。待呼吸道感染稳定后再次给予硫唑嘌呤50 mg/d,治疗4 d后患者再次出现发热,伴咳嗽、咳痰加重。复查血常规:白细胞14.56×109/L(↑)、中性粒细胞13.45×109/L(↑)、淋巴细胞0.32×109/L(↓)、血红蛋白115 g/L(↓)、血小板117×109/L。再次停用硫唑嘌呤,给予莫西沙星治疗后,患者体温再次恢复正常至36.7 ℃,咳嗽好转,复查血常规均正常。
患者加用硫唑嘌呤后,短期内出现2次呼吸道症状,虽未获得明确的病原学证据,但根据临床表现、实验室检查、用药反应考虑细菌感染可能性大。鉴于硫唑嘌呤与感染事件的时间关系密切,考虑药物是发生感染的重要诱因。骨髓抑制是硫唑嘌呤相对常见的不良反应,呈剂量相关性,通常可逆;白细胞减少是最常见的临床表现,而全血细胞减少相对罕见。患者出现细菌感染后查血常规淋巴细胞减低,但白细胞总数及中性粒细胞升高,推测患者可能存在白细胞及中性粒细胞减少的情况,而患者在继发细菌感染后使得中性粒细胞增加。硫唑嘌呤在体内裂解为6-巯基嘌呤,再通过巯嘌呤甲基转移酶(thiopurine methyltransferase,TPMT)、黄嘌呤氧化酶、次黄嘌呤-鸟嘌呤磷酸核糖转移酶三条竞争性途径进行催化代谢[7]。其中,经次黄嘌呤-鸟嘌呤磷酸核糖转移酶途径生成的巯基鸟嘌呤磷酸盐被认为与药理作用、不良反应密切相关。当TPMT活性下降时,巯基鸟嘌呤磷酸盐增加导致骨髓抑制作用增强。TPMT的基因多态性与酶活性相关,亚洲人群中约2%~5%存在基因变异。因此,有研究推荐服用硫唑嘌呤前进行TPMT活性或基因型检测[7]。需注意TPMT活性下降仅可解释部分硫唑嘌呤相关的白细胞减少,其他原因包括使用可导致骨髓抑制作用的合并药物、与硫唑嘌呤相互作用的药物联用、病毒感染等。目前推荐于硫唑嘌呤治疗的初始8周内每周进行1次血常规检查,对存在肝肾功能不全的患者应考虑增加检查次数;此后建议每1~3个月检查1次。本例患者使用硫唑嘌呤前已有环磷酰胺使用史,且肾功能不全,是发生骨髓抑制的危险人群,应更加密切监测血常规。鉴于患者2次硫唑嘌呤治疗后均出现呼吸道感染,且存在肺间质病变,再次尝试硫唑嘌呤治疗的风险较高,故再次给予环磷酰胺50 mg/d进行治疗。
至2020年4月15日,环磷酰胺累积剂量达15.4 g,考虑继续使用环磷酰胺的风险高而拟停药,需要重新选择维持治疗药物。患者于2020年4月20日再次收入北京协和医院肾内科病房,血常规检查:白细胞6.07×109/L,中性粒细胞3.92×109/L,淋巴细胞1.47×109/L,血红蛋白118 g/L(↓),血小板176×109/L,CD19+B细胞计数为35 cell/μL(↓)。
利妥昔单抗目前虽作为指南推荐的ANCA相关性血管炎一线维持治疗药物,但具体使用方法仍无定论。英国专家建议维持阶段利妥昔单抗的用量为1000 mg/6个月或500 mg/6个月,持续治疗2年[8]。一项回顾性研究分析了采用利妥昔单抗治疗的62例患者的维持治疗效果,根据治疗剂量(2000 mg/年、1000 mg/6个月、1000 mg/6个月序贯500 mg/6个月、500 mg/6个月)将患者分为4组,研究发现500 mg/6个月的维持剂量治疗有效且使用安全[9],但其作为小样本量的回顾性研究,可能存在较多混杂因素。经典的MAINRISTAN研究中分别给予利妥昔单抗500 mg治疗0 d、14 d、6个月、12个月、18个月,与硫唑嘌呤组比较,利妥昔单抗组的复发率更低,提示使用该剂量治疗有效[6]。然而,更低剂量的利妥昔单抗治疗是否有效?有学者提出可尝试单次使用250 mg的小剂量利妥昔单抗用于维持治疗[10]。另有研究显示,在健康人群中输注利妥昔单抗,将药代动力学数据经模型推演后显示,100 mg/3个月的利妥昔单抗即足以抑制B细胞[11]。
对于本例患者,因已接受较长时间的免疫抑制治疗,基础淋巴细胞水平明显偏低(仅35 cell/μL),是否更低剂量的利妥昔单抗即可满足临床需求,以节省治疗费用、减少药物不良反应值得探索。排除禁忌证后于2020年4月26日给予利妥昔单抗100 mg静脉输注治疗。治疗2 d后复查CD19+B细胞计数为3 cell/μL,1个月后复查为0,临床反应较好。本例患者使用利妥昔单抗剂量远小于既往临床研究中所用剂量,因此,将其称为超小剂量的利妥昔单抗。在首次进行利妥昔单抗治疗后5个月,CD19+B细胞计数升至15 cell/μL。
患者是否需按照固定的时间间隔、固定剂量进行给药尚需更多研究证实。MAINRISTAN-2研究比较了固定方案和更经济的个体化方案的疗效,将患者分为固定剂量组(500 mg治疗0 d、14 d、6个月、12个月、18个月,并于18个月时随访)或个体化组(500 mg治疗0 d,每3个月随访,若CD19+B细胞计数>0 或ANCA 滴度转阳或倍增时重复给药500 mg),结果显示随访28个月时,个体化组利妥昔单抗输注次数(3次)低于固定剂量组(5次),但复发率无明显差异,提示可根据患者的具体情况选择合适的给药频率[12]。虽然以上个体化方案是按照B细胞计数及ANCA滴度变化进行设计,但无论是B细胞清零或ANCA水平变化均无法准确预测复发,有研究采用敏感性更高的流式细胞仪检测循环中的B细胞计数,发现常规检测方法下B细胞显示已清零的标本中实际仍可检测出B细胞[13]。后续仍需相关研究探寻ANCA相关性血管炎复发的关键标志物以指导临床用药。
对于本例患者,考虑其并非复发的高危人群,因此,可借鉴MAINRISTAN-2研究中的个体化方案,即根据B细胞计数及ANCA滴度变化予以维持治疗。遂于2020年10月22日重复给予利妥昔单抗100 mg。监测B细胞计数,约在用药4~5个月出现B细胞回升,故于2021年5月13日、10月20日以及2022年3月18日分别再次予以利妥昔单抗100 mg。患者拟于2022年12月再次行利妥昔单抗治疗,但因新冠病毒感染暂缓(表现为发热,无肺炎表现),至2023年2月末次随访时患者无感染事件,ANCA(-),Scr 157 μmol/L,尿常规(-)、胸部CT较前无明显变化。
ANCA相关性血管炎的最佳维持治疗疗程尚无定论。MAINRISTAN-2研究中,继续予以每6个月一次的利妥昔单抗或安慰剂治疗,持续18个月(共4次输注),观察第28个月时的无复发生存率,利妥昔单抗组为96%,而安慰剂组为74%;两组出现严重不良事件的患者例数分别为利妥昔单抗组12例(24%),安慰剂组14例(30%)[14],提示持续4年的维持治疗可进一步减少复发且安全性较好。另一项对于ANCA相关性血管炎患者进行为期4年的随访研究结果亦证实,长期使用利妥昔单抗具有良好的安全性[15]。但新冠肺炎的全球流行使利妥昔单抗的长期维持使用更加审慎。利妥昔单抗会减少疫苗接种后的IgG应答率及应答强度[16]。美国新冠肺炎全国队列协作组对比了12 841例接受免疫抑制治疗和29 386例不接受免疫抑制治疗的新冠病毒感染者,利妥昔单抗使用与在院死亡率增加相关,而其他免疫抑制药物如糖皮质激素、环磷酰胺、硫唑嘌呤、钙调磷酸酶抑制剂、白细胞介素抑制剂、肿瘤坏死因子抑制剂、免疫检查点抑制剂等则未增加在院死亡率[17]。因此,应个体化评估利妥昔单抗长期治疗的获益及风险,包括患者的复发风险、新冠肺炎流行情况、其他免疫抑制剂的使用情况等。本例患者近期拟再行1次利妥昔单抗输注后暂停维持治疗。
利妥昔单抗在ANCA相关性血管炎中的治疗应用目前尚无定论。本例报道发现,对于低复发风险、基线淋巴细胞水平低的患者采用超小剂量利妥昔单抗进行治疗效果较好,具有合理性和可行性。ANCA相关性血管炎复发的关键标志物对于维持治疗的作用仍需进一步研究。