机器人辅助系统在脑血管疾病介入治疗中的应用现状
陈霈珂,江裕华
北京市神经外科研究所,北京100070
血管内介入手术凭借创伤小、术后恢复快等诸多优势,逐渐成为心脑血管疾病的首选治疗方法[1]。相较于心血管和外周血管,脑血管的解剖结构更加复杂,故脑血管疾病介入治疗的难度更大。此外,由于血管内介入治疗需影像设备实时引导,故术者需长时间暴露于辐射之下,这不仅增加其遭受职业损害的风险,且长时间穿戴铅衣将引起脊椎和关节受压,增加术者疲劳感,从而降低操作准确性。为解决传统血管内介入手术的局限性,机器人辅助系统应运而生。科学技术的日新月异对人工智能的发展产生了强劲推动力,目前机器人辅助系统已在临床多领域崭露头角,为多种疾病的治疗提供了新方案。鉴于脑血管疾病治疗的复杂性,相较于其他亚专业,虽然机器人辅助系统在神经外科领域中的应用相对缓慢,但部分针对神经外科手术研发的机器人辅助系统亦已逐渐在临床实践中应用[2]。有研究表明,机器人辅助系统已成功应用于颅内血管造影、颈动脉狭窄及颅内动脉瘤的治疗。本文主要梳理了血管内介入治疗及相关机器人辅助系统在脑血管疾病介入治疗领域中的优势、应用现状、存在的问题及未来发展方向。
1 血管内介入手术治疗脑血管疾病的有效性
血管内介入手术使得术者可借助计算机重建的虚拟影像进行操作,从而提高了临床疗效,已被广泛应用于心脑及外周血管疾病的治疗[3]。在操作中,通过导管可将造影剂注入脑血管,从而更好地发现病变部位,在颅内动脉瘤、颈动脉狭窄的治疗中具有明显优势。成年人颅内动脉瘤的发病率约为3%~5%[4],调查显示颅内动脉瘤平均破裂率约为0.95%[5],而动脉瘤破裂是导致非创伤性蛛网膜下腔出血的主要因素之一[6]。颅内动脉瘤的传统治疗方法为开颅夹闭术,具有损伤大、并发症多、术后恢复慢的弊端。一项纳入2143例颅内动脉瘤破裂患者的随机对照试验显示,血管内介入治疗组效果显著优于传统开颅夹闭术组,前者术后1年内死亡或生活无法自理患者的比例显著低于后者(23.7%比30.6%,P=0.0019),与开颅夹闭术相比,血管内介入治疗可将术后生活无法自理或死亡的发生率分别降低22.6%和6.9%[7]。随着可解脱弹簧圈、血流导向支架等技术的应用,血管内介入手术在颅内动脉瘤的治疗中占据越来越重要的地位[8]。
颈动脉狭窄是引起脑卒中的重要因素,其主要治疗方法包括颈动脉内膜剥脱术和颈动脉内支架植入术。多项随机对照试验已证明了颈动脉支架植入术治疗颈动脉狭窄的长期安全性和有效性。2009年,Ederle等[9]在研究中纳入了504例颈动脉狭窄患者,其中251例采用血管内介入治疗,253例采用颈动脉内膜剥脱术治疗,结果显示两组同侧非围术期脑卒中发生率均较低,卒中结局指标的差异亦不显著,血管内介入治疗组术后出现颅神经麻痹的患者明显减少(0例比22例)。此外,由于血管内介入手术创伤小、安全性高,使得诸多无法承受开放手术的患者不仅可获得手术治疗的机会,同时降低了术后并发症的发生率,但目前血管内介入治疗亦受到多方面限制,如术者需暴露于高剂量X线辐射之下,长时间穿戴防护服将致术者术中疲劳等。
2 机器人辅助系统在血管内介入治疗中的优势
机器人辅助系统的应用可减少甚至避免术者遭受辐射的威胁,降低职业损害程度,且凭借较高的操作稳定性和精确度,可进一步减少手术并发症,提高手术疗效[7],术者和患者均可获益。首先,机器人辅助系统可减少传统介入手术对术者的危害:术者可在导管室外遥控操作系统,以减少辐射暴露;利用机器人辅助装置,术者无需长时间穿戴铅衣,一方面可减少脊椎及关节损伤[10],另一方面可降低术者术中疲劳程度,提升治疗效果。其次,相较于正常人群,血管疾病患者的血管壁弹性减弱,解剖结构亦更加复杂,故手术难度与风险随之增加[11],而机器人辅助系统可通过提高操作稳定性,达到减少治疗过程中对血管壁撞击次数、降低对血管内皮损害程度的目的,继而降低血栓栓塞和动脉夹层等手术并发症的发生风险,提高手术安全性[12]。此外,对于急性脑卒中、急性心肌梗死等急危重症患者而言,治疗时间窗对患者预后十分关键[13],及时获得治疗可显著提高治愈率。随着5G网络和机器人辅助系统领域取得的突破,5G手术机器人的使用成本显著降低,有望由“一对一”单点治疗模式向“一对多”“多对一”等多点协同治疗模式转变[14],使更多生活在不具备血管内介入治疗手术区域的急性缺血性脑卒中患者在治疗时间窗内获得溶栓治疗。目前,多项研究证实了机器人辅助设备远程医疗的有效性和安全性:Beaman等[15]研究显示,居住在远离市中心的脑卒中患者可从远程医疗操作系统中明显获益。Patel等[16]利用CorPath GRX机器人辅助系统成功为5例患者远程实施了冠状动脉介入术,结果表明治疗效果良好,无术后并发症;距离20英里的远程控制台与实验室机器人辅助系统之间的平均延迟为53 ms,术者对远程设备的响应时间及与当地医疗团队的沟通情况、设备使用情况均较满意。Zheng等[17]借助5G网络,通过机器人辅助系统完成了4例距离3000 km之外的远程腹腔镜手术,平均网络延迟时间为264 ms,术中均无并发症发生。
3 脑血管疾病介入治疗机器人辅助系统
机器人辅助系统应用早期的任务是保持导管和导丝线性移动,随着技术革新,在机器人辅助系统操控下已可实现对导管进行平移和旋转的控制,从而满足术者的临床需求[18]。机器人辅助系统主体一般采用主从分离式结构,术者可利用位于导管室外的控制系统进行手术,在减少辐射暴露风险的同时,进一步提升操作的便利性和手术的安全性[19]。目前,已投入神经外科使用的机器人辅助系统主要包括CorPath GRX系统、Magellan系统、VIR-2系统和鲁班系统。
3.1 CorPath GRX系统
CorPath GRX系统主要应用于心血管及外周血管的介入治疗[20],经过设备升级与改造后逐渐推广用于治疗解剖结构更加迂曲、狭窄的脑血管疾病[21-23]。该系统由线性运动操作系统和旋转运动操作系统组成(图1)[24],可在术中精准控制导丝、导管及球囊与支架输送[19],并实现30°旋转,以便操作时更准确地控制导管(操作精度可达1 mm),将导丝和导管保持在血管腔中心,减少对血管壁的损伤[25]。相较于第一代CorPath 200系统,CorPath GRX系统可通过机器操控增加导管的支撑力,在治疗解剖结构复杂的血管疾病时优势显著[26]。但CorPath GRX系统亦具有一定局限性,如无法同时操控两根导管、无法旋转尺寸较大的导丝、缺乏触觉反馈系统等,对于脑血管疾病介入治疗而言操控范围不足,相较于传统介入手术其操作时间更长且经济成本更高[24]。
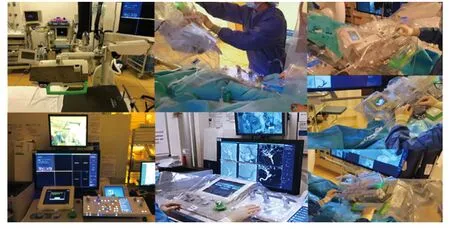
图1 CorPath GRX机器人辅助系统示意图[24]
3.2 Magellan系统
Magellan系统(图2)是首个可应用于外周血管治疗的商业机器人辅助系统,在颈动脉支架植入、主动脉瘤治疗、外周动脉血管成形术中发挥着重要作用[27],且目前已有将此系统应用于脑血管造影的报道[12]。Magellan系统由控制台、床边控制面板、远程导丝控制器、远程导管控制器4部分组成[27],通过对传统导管结构进行改造,其可更精确地控制导管尖端移动,在脑血管病介入手术过程中经颅多普勒记录的血管壁撞击次数显著降低[28],减少了对血管内皮的损伤。
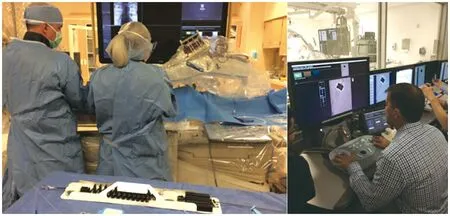
图2 Magellan机器人辅助系统示意图[12]
3.3 VIR-2系统
VIR-2系统由主从系统和三维成像系统组成,其中三维成像系统包括可获取C臂参数的视觉定位系统和可辅助血管内定位、导向的三维血管快速重建系统。上述辅助装置可提升系统的导航能力,提高操作准确性和灵活度,进一步促进血管内介入手术更加高效和便捷化[29]。VIR-2系统的缺陷包括术者利用机械装置操控导管不便、控制台与操作装置布局不合理等。
3.4 鲁班系统
鲁班系统由北京天坛医院李佑祥教授团队联合北京理工大学肖楠教授团队共同研发,为一款具有完全自主知识产权的微创血管内介入手术机器人辅助系统(图3)。其可实现对导丝和导管的同时控制,并具备触觉反馈系统,术者通过控制手柄可感受操作时导丝和导管遇到的阻力[30]。鲁班系统具有的特殊锁定装置可使导管和导丝在一个轨道上移动,并且二者移动的距离一致,提高了手术的安全性。为解决网络延迟带来的影响,系统设计了触发装置,即当导丝接触血管壁时将引起操作的灵敏度下降,直至术者发现导丝已触及血管壁,从而避免血管内皮细胞损伤,提高操作的准确性。鲁班系统结构较为简单,目前主要应用于脑血管造影,并有望拓展应用范围至心血管或肾动脉疾病的诊断与治疗[30]。鲁班系统的局限性:(1)虽然装置具有触觉反馈系统,但触觉反馈阈值的精确度仍有提升空间;(2)临床实践中存在导丝与导管出现弯曲的现象;(3)操作侧的活动范围较小,达到控制端操作范围极限时需断开操作端和控制端之间的连接,重新调整控制端位置,方可进行下一步操作。
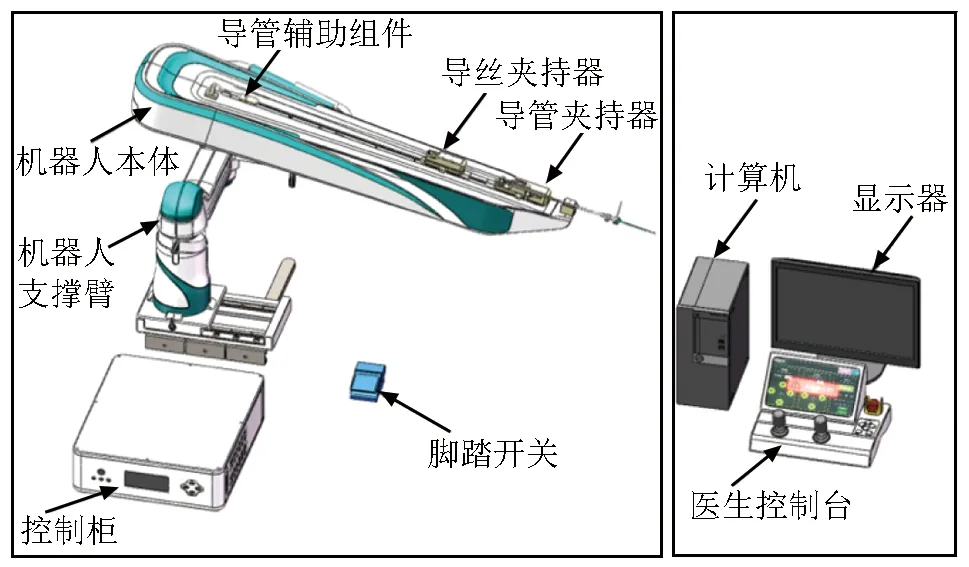
图3 鲁班机器人辅助系统示意图
4 机器人辅助系统在脑血管疾病介入治疗中的应用
4.1 机器人辅助系统在脑血管造影中的应用
2016年Lu等[29]使用VIR-2系统对15例患者(自发性脑出血6例、颅内动脉瘤术后复查6例、疑诊颅内动脉瘤伴动眼神经麻痹3例)实施了脑血管造影术。平均手术时间为(34.4±5.13)min,手术过程中术者无需暴露于辐射之下,除股动脉穿刺需人工操作外,余操作均在机器人辅助下完成,患者均未发生术后并发症。2017年Vuong等[12]基于Magellan机器人辅助系统完成了9例颅内血管造影术。结果显示,无围术期并发症发生,且机器人辅助造影在手术时间、X线透视时间、所需造影剂剂量方面与传统脑血管造影术均无显著差异(P均>0.05)。2018年Jiang等[30]使用鲁班系统为5例疑诊颅内动脉瘤患者进行了脑血管造影术。结果表明,相较于传统脑血管内介入术,机器人辅助血管内介入术的平均手术时间无显著延长,术后穿刺处均无渗血、肿胀、疼痛等感染指征,术后24 h所有患者血常规结果均正常,无发热及其他不适症状,均可下床自行活动。2020年Sajja等[31]通过CorPath GRX系统为7例患者实施了脑血管造影术(穿刺点为桡动脉)。结果显示,所有手术均顺利完成,未发生术后并发症。其中3例患者治疗过程中发现主动脉弓牛型畸形,需转换为人工操作,余4例患者均无计划外人工辅助操作。研究者认为随着机器人辅助系统使用经验的累积,术者操作熟练度亦会相应提升,相应步骤可进一步简化,手术时间和术中X线透视时间将进一步缩短,故机器人辅助系统应用于脑血管造影安全、可行,患者和术者均可从中获益。
4.2 机器人辅助系统在颅内动脉瘤治疗中的应用
目前机器人辅助系统应用于颅内动脉瘤治疗的相关报道主要集中于CorPath GRX系统。2019年研究者采用CorPath GRX机器人系统辅助放置支架和弹簧圈,成功治疗了1例起源于基底动脉的宽颈囊状动脉瘤,手术顺利完成,患者无术后并发症,2周后复查MRI血管造影示动脉瘤已完全夹闭[32]。Cancelliere等[33]于2019—2020年基于CorPath GRX系统治疗了6例直径>5 mm的颅内动脉瘤患者。其中4例使用neck-bridging stent支架,2例使用血流导向支架,3例需额外使用弹簧圈辅助治疗;平均手术时间为(134±14)min,机器人辅助颅内操作平均时间(自微导管第一次连接至取出微导管)为(85±15)min,操作过程中均无计划外人工辅助操作。除1例患者术后2个月发生脑干梗死外,余患者均无术后并发症;1年后随访显示,动脉瘤完全夹闭(Raymond Ⅰ级)4例,有瘤颈残留(Raymond Ⅱ级)2例。Mendes Pereira等[34]开展的研究得到了相近结果,采用CorPath GRX系统顺利治疗6例宽颈囊状动脉瘤患者,无术后并发症,无计划外人工辅助操作,且研究者认为虽然该辅助系统缺乏触觉反馈系统,但并未显著影响操作。最新使用CorPath GRX机器人系统辅助植入血流导向装置治疗10例动脉瘤患者(其中9例为颅内动脉瘤患者)的研究显示,除1例患者治疗过程中由于导丝弯曲程度的限制改为人工操控导丝外(植入微导管和血流导向装置仍为机器人辅助操作),余患者均无计划外人工辅助操作,所有患者均无穿刺区及围术期并发症发生。虽然机器人辅助操作的时间比传统介入手术长约22~34 min,但随着操作熟悉度的提升,手术时间将会进一步缩短[24]。上述研究提示,CorPath GRX机器人辅助系统凭借操作稳定、灵活性和准确性高的优势,在颅内动脉瘤血管内介入治疗中可取得良好疗效。
4.3 机器人辅助系统在颈动脉狭窄治疗中的应用
相较于颅内血管,颈部血管的解剖结构更为简单。2021年Jones等[28]使用Magellan系统成功治疗了13例颈动脉狭窄患者,平均手术时间为74.6 min(其中术前准备机器人辅助装置时间不足5 min),除栓塞保护装置及支架由人工放置外,余操作均在机器人系统辅助下完成,患者均无术后并发症,未出现支架内狭窄,随访期内未发现新增或恶化的神经系统疾病。相似的结论在CorPath GRX系统中得到了进一步验证[33]。George等[35]在一项使用CorPath GRX系统治疗1例73岁右侧颈动脉狭窄男性患者的研究中发现,该患者颈动脉狭窄程度>80%,因具有高血压、高脂血症、心律失常等病史,外科手术风险较高,故选择血管内介入治疗。手术时间为60 min,X线透视时间为13.5 min。术后支架内血流通畅,支架植入处血管最小直径为5.0 mm,颈动脉狭窄程度<10%,术后3个月随访期内无并发症发生。一项回顾性研究比较了机器人辅助系统经桡动脉放置颈动脉支架与传统血管内介入手术的疗效差异。结果显示,虽然机器人辅助组手术时间较传统血管内介入手术组有所延长[(85.0±14.3)min 比 (61.2±17.5)min,P=0.0231],但机器人辅助组未发生并发症,X线透视时间、造影剂使用与传统血管内介入手术相比均无显著差异,证实通过CorPath GRX机器人辅助系统经桡动脉进行颈动脉支架植入术安全可行且有效,有利于减少医务人员的辐射暴露[36]。Legeza等[37]借助虚拟模型分析了机器人辅助系统在颈动脉狭窄治疗中的应用情况,结果表明,相较于传统血管内介入手术组,机器人辅助组手术时间有所延长,二者的导丝放置及球囊扩张程度均无明显差异,说明机器人辅助操作的准确性与人工操作相当。因此,机器人辅助系统可提升颈动脉支架植入术的安全性,但确切结果仍需进一步临床验证,且需进一步研发适用于颅内血管的机器人辅助装置,以促进该技术的推广应用。
5 小结及展望
虽然机器人辅助系统在脑血管疾病介入治疗中已取得里程碑式的进展,其可行性、安全性及有效性已得到临床试验证明,但该辅助系统在实践中仍面临一定挑战:(1)缺乏触觉反馈系统或该功能仍需完善。例如,CorPath GRX系统不具备触觉反馈系统,虽然大量研究已证实使用该系统治疗多种脑血管疾病具有可行性,术者可基于自身经验和术中屏幕显示辅助判断导丝是否触及血管壁,从而弥补缺乏触觉反馈系统的不足[38],但对于经验尚不丰富的术者而言,该系统的安全性仍需加强。VIR-2系统的触觉反馈系统在动物实验中被安装于导管尖端,但在临床试验中出于安全性考虑和受操作空间限制,未安装触觉反馈装置[29]。国产自主研发的鲁班系统拥有触觉反馈装置,但精确度仍有待加强[32]。目前机器人辅助系统的触觉反馈方式包括机械力反馈、电流变液力反馈、磁流变液力反馈等,血管内介入机器人辅助系统需具备传感器、受力检测和良好的反馈能力,才能实现较为成熟的触觉反馈功能[39]。(2)成本高。相较于传统血管内介入手术,机器人辅助系统血管内介入治疗的成本更高。除机器人系统本身的成本外,辅助装置也需要额外花费,如CorPath GRX系统每次操作均需消耗一次性配件[34]、Magellan系统需专用导管[40]等,一定程度上增加了机器人辅助系统在脑血管疾病介入治疗中的运行成本。(3)手术时间长。部分临床试验因术前需安装机器人装置或由于术者对流程不熟悉延长了手术时间,该局限性有望随着临床实践的积累得到改善[24,31]。(4)需人工辅助操作。所有机器人辅助系统进行脑血管疾病介入治疗时在不同阶段均需不同程度的人为介入,如治疗颈动脉狭窄时,CorPath GRX装置仍需人工放置支架和球囊[28,31]。患者解剖结构异常时,为保证手术顺利进行及患者安全性,需转为人工操作[31]。
总之,人工智能和机器人辅助系统的应用有望突破传统介入手术的局限性,为患者带来了更加安全、有效、精确、智能化的治疗方案,已成为多种脑血管疾病介入治疗的新选择[41]。虽然目前应用于脑血管疾病介入治疗的机器人辅助系统仍存在不同程度的缺陷,但相信随着科学技术的进一步革新和设备装置的进一步迭代,机器人辅助系统必将在脑血管疾病介入治疗领域发挥更加重要的作用。