临床特征、乳房X线摄影及MRI表现鉴别非肿块型乳腺癌与乳腺炎
吴林桦,杨 蔚*,周晓平,刘开慧,李 健
(1.宁夏医科大学总医院放射科,宁夏 银川 750004;2.宁夏医科大学临床医学院,宁夏 银川 750004)
乳腺非肿块样强化(non-mass enhancement, NME)病变指乳腺MRI所示存在大小不同强化区域但无占位效应的病变[1];乳腺导管原位癌(ductal carcinoma in situ, DCIS)及浸润性癌及良性病变尤其乳腺炎均可见NME[2]。不同NME病变在MR功能成像,如弥散加权成像(diffusion weighted imaging, DWI)、动态对比增强MRI(dynamic contrast enhanced-MRI, DCE-MRI)中亦存在重叠[3],且MRI显示钙化能力欠佳[4],导致仅基于MRI难以鉴别良恶性NME病变。乳房X线摄影(mammography, MG)对钙化极敏感[5-6]。本研究基于SHAP分析[7]观察联合临床特征及MG、MRI表现鉴别非肿块型乳腺癌与乳腺炎的价值。
1 资料与方法
1.1 研究对象 回顾性收集2018年1月—2022年4月于宁夏医科大学总医院就诊的390例乳腺NME病变患者为开发组,并前瞻性招募2022年5月—2023年5月同一医院收治的159例乳腺NME病变患者为验证组。纳入标准:①术前DCE-MRI诊断单发NME病变;②接受MG检查,且与MR检查间隔<45天;③经粗针穿刺活检(n=46)或手术(n=503)病理证实为乳腺良性或恶性病变;④影像学资料完整;⑤未接受放射、激素或化学治疗。本研究获院伦理委员会批准(KYLL-2022-0774、KYLL-2022-0251),检查前患者及家属均签署知情同意书。
1.2 仪器与方法
1.2.1 MG 采用GE Senographe DS全数字化乳腺X线机拍摄双侧乳腺头足位(cranio-caudal position, CC)和内外斜位(mediolateral oblique position, MLO)像。
1.2.2 MR检查 采用GE Signa HDxt 1.5T MR仪、乳腺专用双侧8通道线圈,嘱患者俯卧,使双乳自然下垂,采集乳腺MRI;扫描参数:矢状位脂肪抑制(fat suppression, FS)T2WI,TR 3 800 ms,TE 94 ms,层厚2 mm,FOV 200 mm×200 mm,矩阵288×224;轴位DWI,TR 6 000 ms,TE 70 ms,FOV 32 cm×32 cm,矩阵32×132,层厚4 mm,层间距0,b值1 000 s/mm2;轴位DCE-MRI,经肘静脉以2.5 ml/s流率快速团注对比剂钆喷酸葡胺注射液(Gd-DTPA)0.2 mmol/kg体质量并跟注10 ml生理盐水后,以梯度回波序列及FS技术进行扫描,FA 15°,TR 6.5 ms,TE 2.5 ms,层厚1.5 mm,FOV 200 mm×200 mm,矩阵256×160,注射对比剂之前行预扫描,后连续采集7个时相,共扫描8个时相,时间432 s。
1.3 分析图像 由具有22及5年工作经验的影像科主任医师及主治医师各1名根据乳腺影像报告和数据系统(breast imaging reporting and data system, BI-RADS)标准[1]以盲法独立阅片,观察病变MG表现:①腺体类型,分为脂肪型、散在纤维腺体型、不均匀致密型和极度致密型;②MG状态,将MG未显示或疑诊、后经病理证实为良性、恶性或原位癌的病变定义为MG假阴性,否则为MG阳性;③钙化,良性钙化和可疑钙化。MRI表现:①病变大小;②病变分布特征,局灶、线样、段样、区域、多区域及弥漫分布;③以胸大肌信号强度为标准评估FS-T2WI中的病变为等低信号或高信号;④病变内部强化,分为均匀、不均匀、集群卵石样及簇样环形强化。2名医师意见不一致时经协商达成共识。
参照T2WI于DWI中选取包含病变实性成分的连续层面,避开囊性、坏死或出血区域,沿病变边缘手动勾画ROI,于表观弥散系数(apparent diffusion coefficient, ADC)图中获得其ADC;取各层面ROI的ADC的平均值进行分析。于晚期DCE-MRI[8]中病变实性成分最大层面放置面积50~70 mm2的圆形ROI,软件自动生成时间-信号强度曲线(time-signal intensity curve, TIC),得到最大上升斜率(maximum slope of increase, MSI)及信号强化率(signal enhancement ratio, SER)伪彩图,记录其TIC类型、MSI及SER。于矢状位FS T2WI中测量腋窝淋巴结短径,以短径>1.0 cm为腋窝淋巴结阳性[9]。
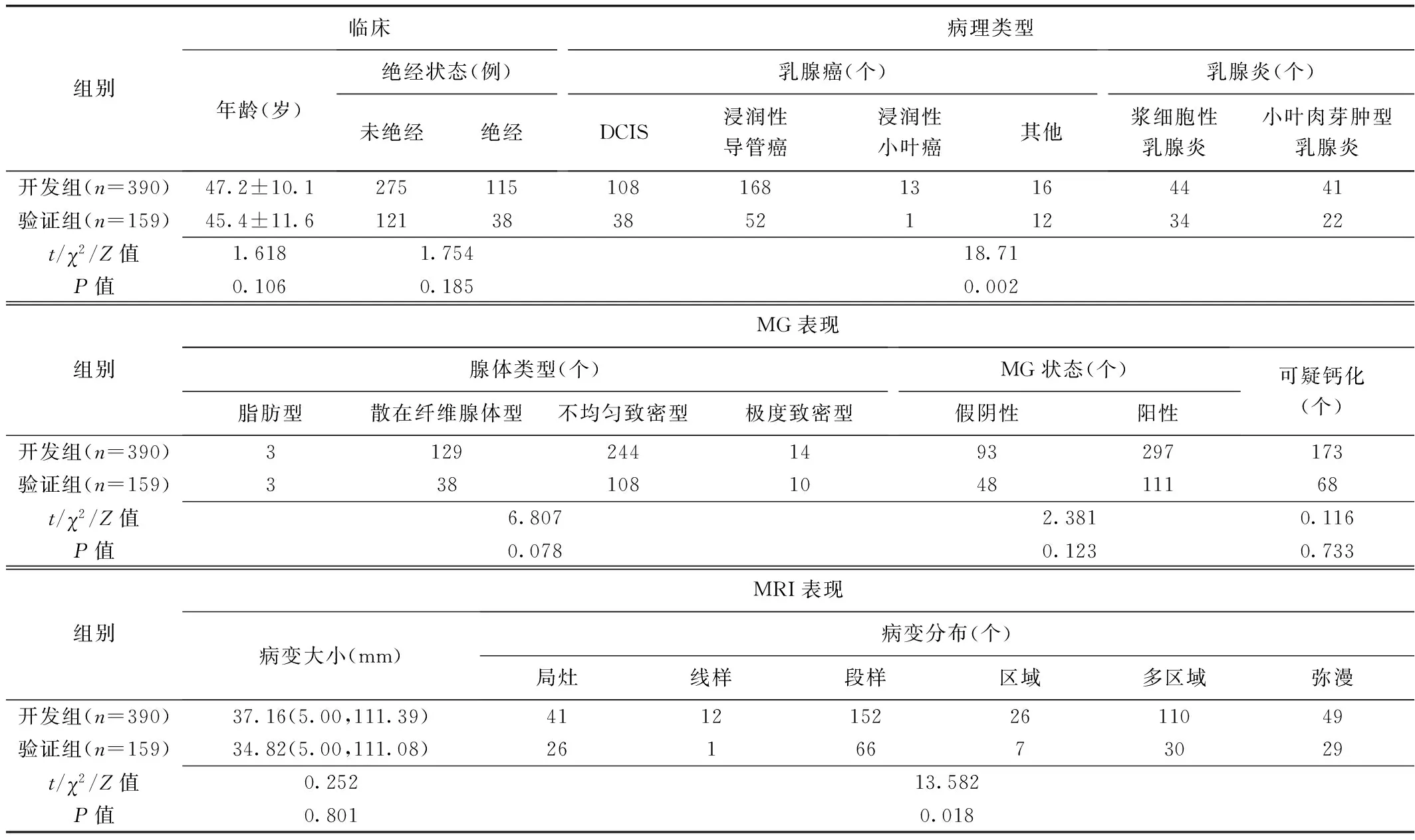
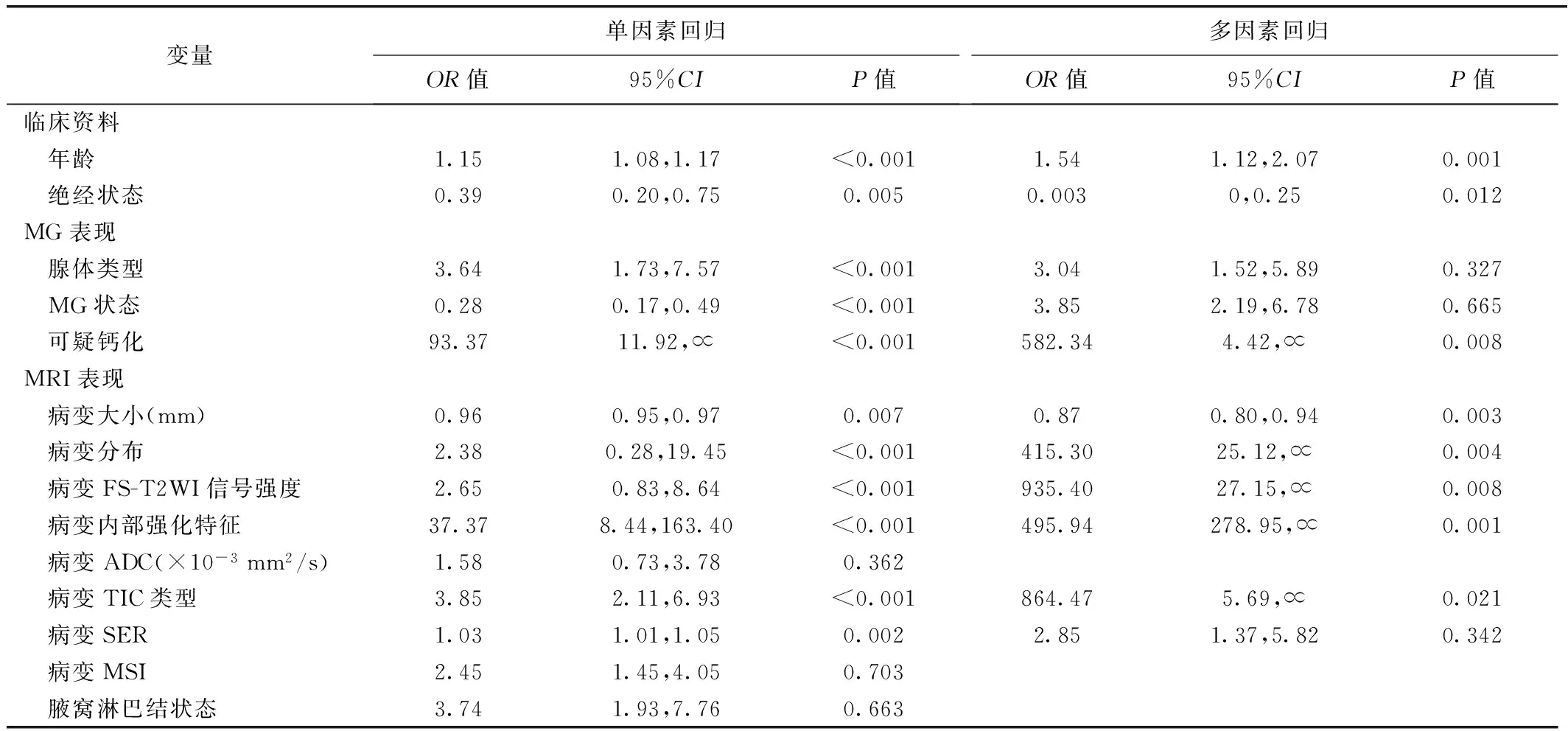
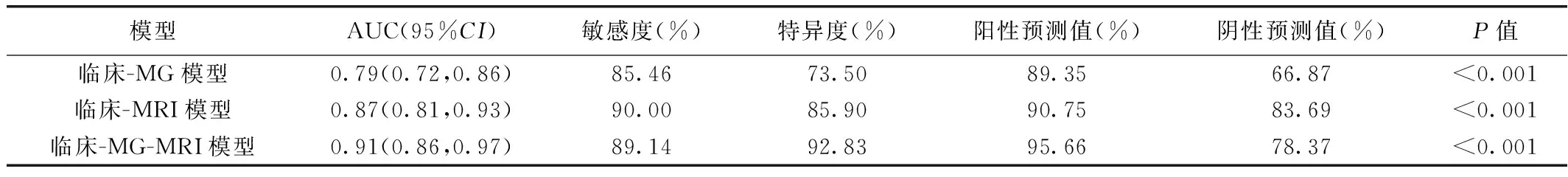
1.4 统计学分析 采用SPSS 26.0统计分析软件和R 3.6.3软件。以Kappa检验或组内相关系数(intra-class correlation coefficient, ICC)评估观察者间评估MG及MRI表现的一致性: Kappa≤0.20为一致性差,0.21~0.40一致性较差,0.41~0.60一致性中等,0.61~0.80一致性良好,0.81~1.00一致性好;0 共549例549处NME病变纳入研究,其中408处乳腺癌(146处导管原位癌、220处浸润性导管癌、14处浸润性小叶癌,28处其他)及141处乳腺炎(78处浆细胞性乳腺炎、63处肉芽肿性小叶性乳腺炎)。 2.1 一致性分析 观察者间评估MG所示腺体类型(Kappa=0.89)、MG状态(Kappa=0.87)、钙化(Kappa=0.93),以及MRI所示病变大小(ICC=0.88)、分布(Kappa=0.80)、FS-T2WI信号强度(Kappa=0.78)、内部强化(Kappa=0.91)、ADC(ICC=0.87)、TIC类型(Kappa=0.75)、MSI(ICC=0.81)、SER(ICC=0.78)及腋窝淋巴结状态(Kappa=0.84)的一致性为良好至好。 2.2 组间比较 组间病理类型及MRI所示病变分布、FS-T2WI信号强度、ADC、TIC类型和腋窝淋巴结状态差异均有统计学意义(P均<0.05),其余临床及影像学表现差异均无统计学意义(P均>0.05)。见表1。 表1 549例乳腺NME临床、影像学表现及病理结果比较 2.3 构建联合模型 年龄、绝经状态,MG所示可疑钙化,MRI所示病变大小、分布、FS-T2WI信号强度、内部强化特征和TIC类型均为鉴别非肿块型乳腺癌与乳腺炎的独立因素(P均<0.05)。见表2。 表2 logistic回归分析筛选鉴别非肿块型乳腺癌与乳腺炎的独立因素 2.4 评估模型效能 开发组中,临床-MG-MRI模型鉴别非肿块型乳腺癌与乳腺炎的AUC(0.91)高于临床-MG和临床-MRI模型(AUC=0.79、0.87,Z=2.341、5.067,P均<0.05);临床-MG与临床-MRI模型AUC差异有统计学意义(Z=3.265,P=0.013)。临床-MG-MRI模型在验证组的AUC为0.90[95%CI(0.83,0.97)]。见表3及图1。临床-MG-MRI模型鉴别2组结果与真实结果的一致性良好(MAE=0.02、0.03,P=0.076、0.063)。 表3 各模型鉴别开发组非肿块型乳腺癌与乳腺炎的效能 2.5 SHAP分析 临床-MG-MRI模型中,年龄、病变大小、可疑钙化和病变内部强化特征的贡献价值较高,绝经状态、病变分布、FS-T2WI信号强度及TIC类型为补充因素。见图2、3。 NME病变中,发生于年轻、绝经前女性且较大者多为乳腺炎,反之则乳腺癌可能较大[10];MRI显示NME病变呈段样分布及簇样环形强化则为提示恶性肿瘤的重要征象[11]。与肿块型乳腺癌相似,非肿块型乳腺癌MR T2WI常呈低信号和流出型TIC[12];炎性病灶通常因含水较多而呈T2WI特征性高信号,乳腺炎肉芽组织中微血管较多,呈流入型TIC。 本研究结果显示,年龄、绝经状态,MG所示可疑钙化,MRI所示病变大小、分布、FS-T2WI信号强度、内部强化特征及TIC类型均为鉴别非肿块型乳腺癌与乳腺炎的独立相关因素;基于临床、MG及MRI相关变量构建的临床-MG-MRI模型在开发组的AUC为0.91,高于临床-MG(0.79)和临床-MRI模型(0.87),在验证组为0.90,且校准度均良好,提示其具有较高诊断效能及兼容性。SHAP分析结果显示,年龄、病变大小、可疑钙化、病变内部强化特征对联合模型的贡献价值较高,而其他独立相关因素则为补充。临床-MG-MRI模型在临床-MRI基础上增加MG所示可疑钙化,明显提高了诊断效能,阳性预测值达95.66%,提示MG对鉴别非肿块型乳腺癌与乳腺炎具有重要意义[13]。 总之,联合应用临床特征及MG、MRI表现能有效鉴别非肿块型乳腺癌与乳腺炎。2 结果
3 讨论

