基于T2WI纹理分析预测高级别胶质瘤术后复发
赵正宇,单 奔,韩 雷,葛 芳,李绍东
(1.徐州医科大学影像学院,江苏 徐州 221004;2.徐州医科大学附属淮安医院影像科,江苏 淮安 223002;3.淮安市第五人民医院影像科,江苏 淮安 223399;4.徐州医科大学附属医院影像科,江苏 徐州 221006)
胶质瘤是颅内最常见肿瘤。2021年WHO中枢神经系统肿瘤分类将胶质瘤分为1~4级,其中3、4级为高级别胶质瘤(high-grade glioma, HGG)[1]。HGG侵袭性强,瘤周易出现血管源性水肿;临床治疗以手术切除为主,辅以放射及化学治疗等[2]。多数HGG术后会复发,但患者肿瘤无进展生存期(progression free survival, PFS)存在显著差异[3],使得术前评估HGG具有重要临床意义。术前影像学常通过常规MRI、弥散加权成像(diffusion weighted imaging, DWI)、磁共振波谱分析及灌注加权成像等评估HGG[4-5]。本研究观察基于T2WI纹理分析[6]预测HGG术后复发的价值。
1 资料与方法
1.1 研究对象 回顾性分析2013年7月—2021年3月71例于徐州医科大学附属医院及淮安市第二人民医院经术后病理确诊的HGG患者,男33例、女38例,年龄15~81岁、平均(52.9±10.9)岁。纳入标准:①初诊HGG,拟接受手术治疗;②术前未接受任何治疗;③于术前1个月内接受颅脑MR检查,图像质量良好;④术后随访资料完整。排除标准:①罹患其他恶性肿瘤;②MRI所示肿瘤实质、水肿区及其与正常脑组织界限不清;③MRI未见瘤周水肿。复发定义为出现新发HGG,或原病灶进展或转移[7]。术后随访1~21个月、中位时间8.3个月,将期间出现复发者归为复发组(n=45),无复发者纳入未复发组(n=26)。本研究经院伦理委员会批准(XYFY2021-KL120-01、HEYLL20210118)。检查前患者及家属均签署知情同意书。
1.2 MR检查 采用GE Signa HDxt 3.0T超导MR仪,8通道头部相控阵表面线圈。嘱患者仰卧,以自旋回波(spin echo, SE)序列采集轴位T2WI,TR 4 000 ms,TE 95 ms,层厚3 mm,层间距0.5 mm,FOV 220 mm×220 mm,矩阵256×256; 以SE或平面回波(echo planar, EP)序列采集轴位DWI,TR 3 000 ms,TE 65.5 ms,层厚5 mm,层间距1 mm,FOV 240 mm× 240 mm,矩阵160×160,b值分别为0和1 000 s/mm2。经肘静脉以2.0 ml/s流率团注钆喷酸葡胺(0.1 mmol/kg体质量)后采集轴位T1WI,TR 600 ms,TE 6.8 ms,层厚 3 mm,层间距0.6 mm,FOV 180 mm×180 mm,矩阵256×256。
1.3 阅片及提取特征 由分别具有10年和30年神经系统影像学诊断经验的主治医师和主任医师各1名分别阅片,观察并记录肿瘤形态特征,包括位置(左/右侧)、有无分叶、囊变、子病灶,以及实质/瘤周DWI信号(等低/中高)和强化程度(轻度/中重度),意见不一致时经协商达成共识。以DICOM格式导出T2WI,由2名医师采用3D Slicer软件沿肿瘤实质及水肿区边缘逐层手动勾画ROI(图1);采用开源Pyradiomics软件提取ROI的7类纹理特征,包括灰度共生矩阵特征、灰度游程矩阵特征、一阶特征、灰度区域大小矩阵特征、相邻灰度差矩阵特征、灰度依赖矩阵特征及形态特征。
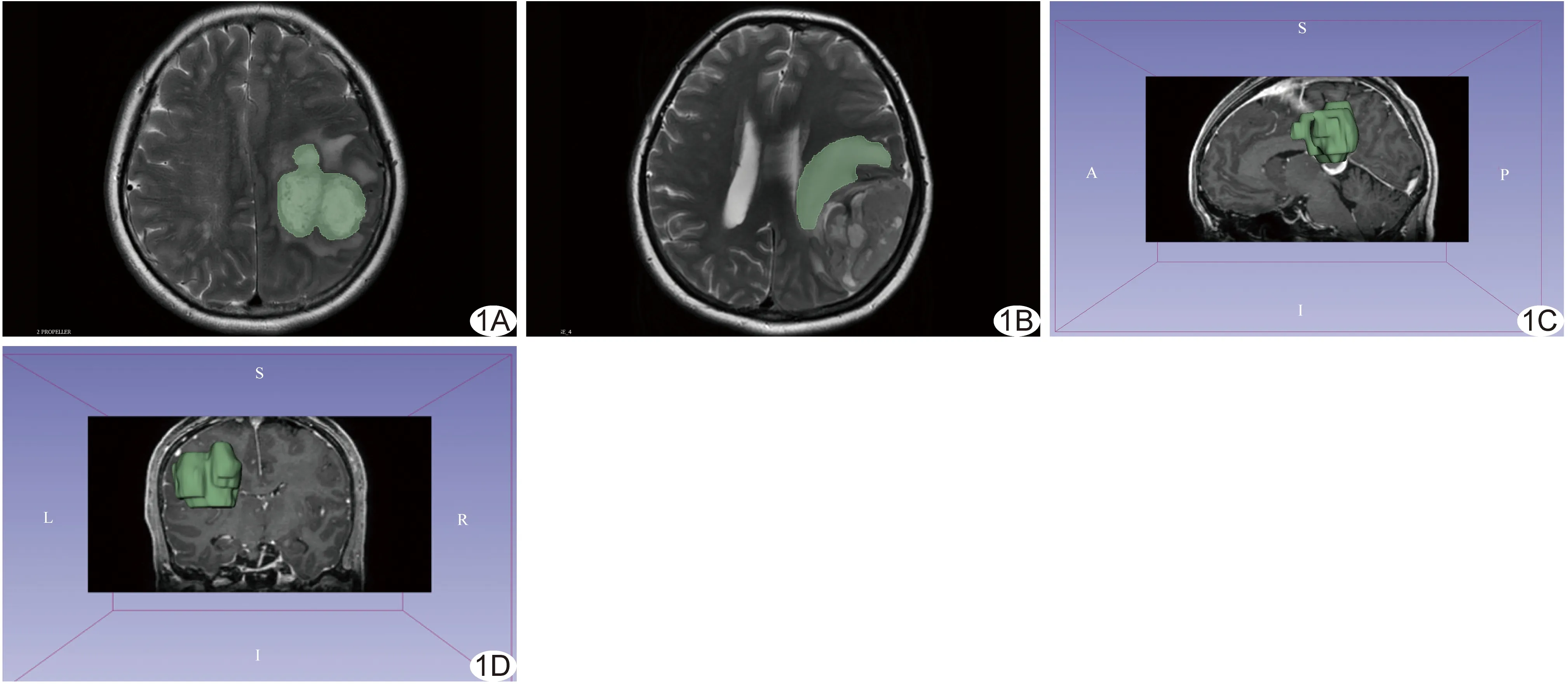
图1 以3D Slicer勾画ROI示意图 A、B.于轴位T2WI中勾画HGG瘤体(A)及瘤周水肿带(B); C、D.于冠状位(C)及矢状位(D)图像中勾画瘤体+瘤周水肿带 (图A、C、D为58岁、B为55岁女性左顶叶HGG患者)
1.4 模型构建 采用组内相关系数(intra-class correlation coefficient, ICC)分析2名医师分别提取纹理特征的一致性,选择一致性良好(ICC>0.75)的特征。以组间差异有统计学意义的HGG MRI形态特征构建支持向量机(support vector machine, SVM)和随机森林(random forest, RF)分类模型:将组间差异有统计学意义的瘤体、瘤周水肿区、瘤体+瘤周水肿区的纹理特征值标准化,以十折交叉验证获得最小绝对收缩和选择算子(least absolute shrinkage and selection operator, LASSO)算法的最优λ值,筛选最佳纹理特征,分别以瘤体、瘤周水肿区、瘤体+瘤周水肿区特征构建SVM和RF分类模型,并联合各区域纹理特征构建SVM和RF分类模型。绘制受试者工作特征(receiver operating characteristic, ROC)曲线,以曲线下面积(area under the curve, AUC)评估各模型预测效能。
1.5 统计学分析 采用Python 3.1.1统计分析软件。以±s表示符合正态分布的计量资料。以Levene检验进行方差齐性分析,对方差齐者以独立样本t检验行组间比较,否则行Welcht检验。采用χ2检验比较计数资料。P<0.05为差异有统计学意义。
2 结果
2.1 形态特征模型 组间肿瘤位置、有无囊变、有无子病灶、实质/瘤周DWI信号及强化程度差异均有统计学意义(P均<0.05),见表1;据此建立预测HGG术后复发的SVM形态及RF形态模型。

表1 组间患者一般资料及HGG形态特征比较
2.2 纹理特征模型 分别于瘤体、瘤周水肿区和瘤体+瘤周水肿区各提取1 245个纹理特征,其中987、1 020和1 084个特征的一致性良好,分别于其中筛选出122、230和424个特征;最终分别以LASSO算法选出12、13和13个最佳纹理特征(图2)用于构建各区及联合SVM纹理模型和RF纹理模型。

图2 筛选最佳纹理特征及其系数 A.瘤体; B.瘤周水肿区; C.瘤体+瘤周水肿区
2.3 模型预测效能 SVM形态模型预测HGG术后复发的效能(AUC=0.76)高于RF形态模型(AUC=0.68);SVM纹理模型预测效能最佳(AUC=0.83)。见表2。瘤体+瘤周水肿区SVM纹理模型和RF纹理模型预测效能高于瘤体和瘤周水肿区,见表3。
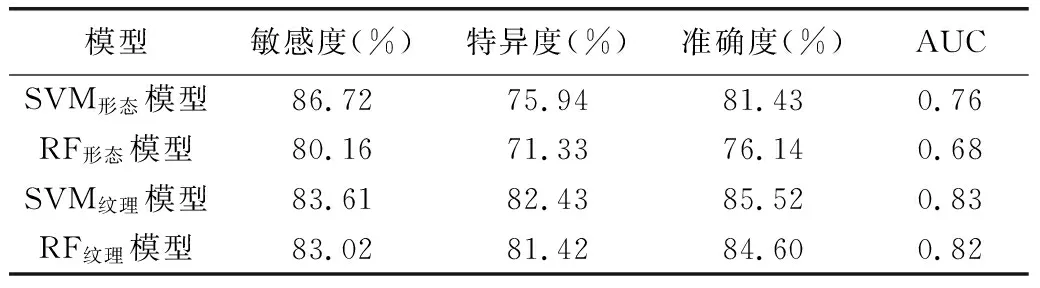
表2 以形态特征和纹理特征SVM、RF模型预测HGG术后复发的效能
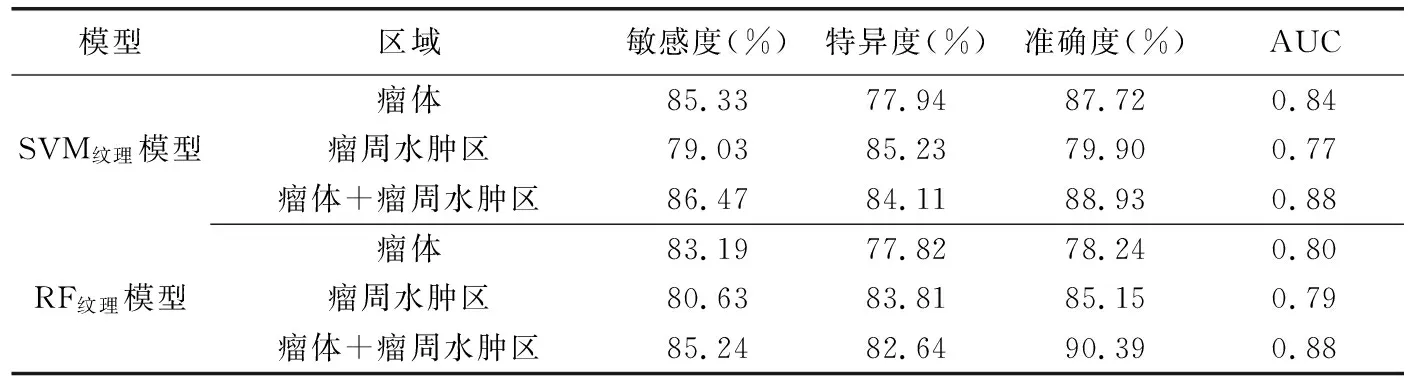
表3 以不同区域纹理特征SVM、RF模型预测HGG术后复发的效能
3 讨论
术前通过MRI预测术后肿瘤复发对于制定治疗HGG方案具有重要临床意义[8]。本研究结果显示,相比未复发组,MRI中,复发组HGG更易出现大面积囊变、坏死,瘤体或瘤周DWI高信号;分析原因,可能复发组肿瘤恶性程度更高,肿瘤细胞增殖更快、瘤内微血管增生更显著,造成微环境缺氧致肿瘤坏死、囊变,且随肿瘤细胞密度与体积改变,细胞外间隙水分子运动受限而出现DWI高信号[9-10]。既往研究[11]认为胶质瘤发生侵袭、转移是其预后差的重要原因之一。本研究发现HGG存在子病灶时更易复发,与周晶等[11]的观点相符。有学者[12]提出TERT启动子与胶质瘤偏侧性存在一定关联:野生型胶质瘤以左侧居多且往往预后较差,突变型胶质瘤则多位于身体右侧;或可从基因层面解释本组左侧HGG更易复发。此外,本研究复发组HGG较未复发组强化程度更高,可能其血脑屏障破坏更为严重,使对比剂更易进入组织间隙[13]。
SVM、RF模型已广泛用于纹理分析研究。SVM分类模型主要用于分类或回归图像及文本数据,尤其适用于小样本研究。RF以监督学习方式对数据进行二元分类,计算速度较快且不易出现过拟合,适用于处理大批量影像组学特征。刘哲等[13]报道,基于T1WI、T2WI构建的SVM和RF模型可有效鉴别HGG与单发脑转移癌。袁媛等[2]基于T2WI结合影像组学鉴别HGG与颅内单发转移癌,发现瘤周5 mm 影像组学模型的鉴别效能高于瘤周10 mm,但未与瘤体进行比较。T2WI所示瘤体与瘤周水肿区的界限相对清晰,勾画ROI相对简单。本研究基于T2WI分别提取瘤体、瘤周水肿区及瘤体+瘤周水肿区纹理特征,并纳入HGG MRI形态学特征,充分利用可挖掘信息构建多种SVM及RF模型,结果显示以瘤体+瘤周水肿区纹理特征预测HGG术后复发的效能最佳,AUC为0.88。
综上所述,基于T2WI纹理分析可有效预测HGG术后复发。本研究的主要不足之处:①纳入病例来源于2所医院,尽管扫描设备及其参数相同,图像灰度分布仍存在差异;②样本量小;③手动分割ROI难以避免偏倚,有待后续加以完善。

