缬更昔洛韦治疗巨细胞病毒血症的成本-效果
李佳佳 冯术青 谢跃生* 高 峰
在接受造血干细胞移植的患者中,由于免疫功能低下,巨细胞病毒(cytomegalovirus,CMV)感染仍是威胁其术后生存的重要因素。目前在发生CMV感染时,大多采取对CMV-DNA 阳性但无临床症状患者进行抢先治疗,以降低CMV 病发生率[1]。《美国移植和细胞治疗学会(ASTCT)系列指南3》中推荐口服缬更昔洛韦或静脉注射更昔洛韦作为抢先治疗一线药物[2]。目前国内最常使用的抢先治疗药物是更昔洛韦,不仅价格低廉,还能医保报销,但其在作用于CMV 的同时,对宿主细胞也产生一定的不利影响,会出现骨髓抑制等不良反应[3]。缬更昔洛韦作为更昔洛韦的前体药物,进入人体后也会有此类不良反应,但陆铉等[1]的研究证实,使用更昔洛韦的患者均存在不同程度的骨髓抑制,表现为已恢复正常的中性粒细胞和血小板再度下降,而使用缬更昔洛韦治疗的患者能表现出良好的耐受性,未观察到不良反应。因缬更昔洛韦的价格明显高于已纳入医保报销的更昔洛韦,但其口服用药方式也能显著节省由于患者住院及家属陪护带来的开支,目前国内关于缬更昔洛韦的研究多停留在合成方法及临床疗效的分析,药物经济学相关研究尚无。本文将采取回顾性研究的方式,基于真实世界数据对缬更昔洛韦与更昔洛韦进行成本-效果分析,为缬更昔洛韦临床推广提供数据支撑。
1 资料与方法
1.1 一般资料
采用回顾性调查方法,利用嘉和电子病历平台对2015年6月至2022年6月唐山市华北理工大学附属医院血液内科二病区收治的行异基因造血干细胞移植(allogeneic hematopoietic stem cell transplantation,allo-HSCT)且合并CMV 血症的患者病案进行调取,共收集62 例患者病案信息。将其按照纳排标准进行汇总分析,得到40 例CMV 血症患者纳入本研究。按照用药方案不同将患者分为更昔洛韦组(A 组)和缬更昔洛韦组(B 组),其中A 组患者15 例,B 组患者25 例。研究中对年龄、性别、文化、职业、收入、疾病史等特征不作特殊筛选。两组患者一般资料比较,差异无统计学意义(P>0.05)。见表1。
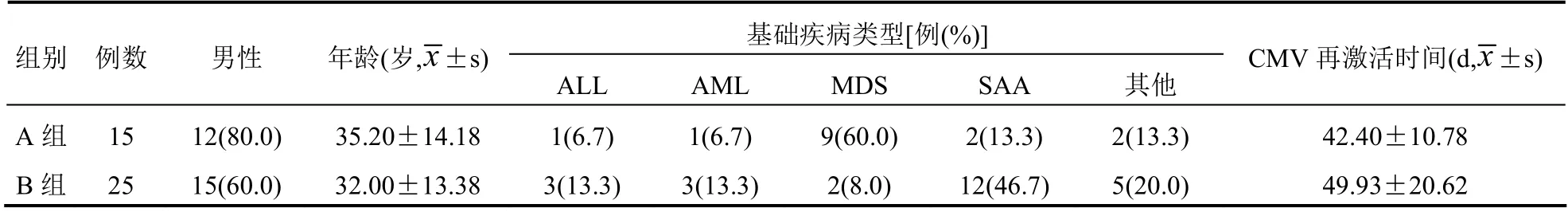
表1 两组患者一般资料比较
1.2 纳入与排除标准
纳入标准:1)allo-HSCT 后经巨细胞病毒核酸(CMV-DNA)检测诊断为合并CMV 血症;2)抢先治疗药物为更昔洛韦或缬更昔洛韦。
排除标准:1)术后合并其他并发症并导致抢救无效死亡;2)病情严重家属放弃治疗;3)联合使用其他抗病毒药物。
1.3 治疗与检测方案
所有患者在行allo-HSCT 后,均予以常规对症支持治疗。待白细胞植活第2 天开始以2 次/7 d 的频率采用荧光定量聚合酶链式反应(PCR)技术检测CMV-DNA 水平。对大于最低检出限(CMV-DNA=1000 copies/ml)的患者进行抢先治疗,医生将根据患者血常规及经济条件情况决定抢先治疗的用药方案(更昔洛韦/缬更昔洛韦)。经治疗后连续两次CMV-DNA 测定均低于最低检出限后,改为1 次/7 d的频率检测CMV-DNA 水平,并且用药量减半巩固14 d 后停药。停药后继续检测两个月以观察复发情况。两组患者在用药后均每周检测一次血常规,若出现白细胞、血小板或血红蛋白下降情况及时给予相应治疗。药品信息及用药剂量见表2。

表2 药品信息及用药剂量
1.4 疗效判定标准
用药后回访检测CMV 感染情况,自拟疗效判定标准:患者CMV 血症治愈后两个月内是否复发,复发判断标准为CMV-DNA>1 000 copies/ml。若复发则无效,未复发为有效。复发患者将继续进行治疗,其过程可通过决策树模型模拟,最终获得成本-效果数据。
1.5 成本确定
本研究是在全社会角度下进行,因此将纳入所有直接医疗成本、直接非医疗成本和间接成本[4]。本研究中,由于病程短,间接成本可忽略不计,只计算两组患者治疗周期内的直接成本,包括抗病毒药物成本、不良反应治疗成本、与抗病毒药物治疗相关的检验检查成本、住院及陪护费等。各项医疗价格按河北省物价局定价标准计算,缬更昔洛韦价格按照医药公司定价计算。两组患者均已监测CMV 血症治愈后两个月内的CMV-DNA 指标,并且将由于药物的使用所导致的血液学毒性的治疗成本也计入,通过病历及医嘱资料统计各项成本,进行成本-效果分析,同时比较增量成本-效果比,来选择最优的治疗方案。
A 组患者需要住院治疗,因此需计算直接非医疗成本。由于回顾性分析事先没有对家属陪护费用方面进行记录,因此陪护费将根据《住院病人陪护成本与生活护理需求》[5]一文中所示,市级陪护费用定为47.6 元/d,由于用药导致的不良反应成本也将计入。B 组患者口服药可在家服用且临床上无血液学不良反应,因此只计算药品费及诊断费。由表3 可知,A 组成本为64 374.83 元,B 组成本为10 670.77 元。

表3 两种方案具体成本
1.6 相关分析方法
成本-效果分析目的在于能直观地选择成本低,效果好的治疗方案。成本-效果比(C/E)即为单位效果所花费的成本,而增量成本-效果比为两种方案成本之差与效果之差的比(△ C/△ E),比值越低,则表明每增加一个单位效果所需的费用越低,方案实际意义越大[6]。
敏感性分析是为了验证不同假设或估算对基础分析结果的影响程度。相同的治疗方案在不同人群或不同医疗单位中的费用和效果可能不同[6]。
2 结果
2.1 临床疗效
所有患者均在CMV 血症发生后积极进行治疗,初次治愈后2 个月内复发情况:A 组3 例,治疗有效率80.0%(12/15);B 组3 例,治疗有效率88.0%(22/25)。B 组患者治疗有效率高于A 组,差异无统计学意义(χ2=0.471,P=0.493)。
2.2 成本-效果
本文以成本较低的B 组方案为参照进行增量成本-效果分析,增量分析结果表明A 组要想得到与B 组相同的有效率,单位效果上还需多花费6 713.01 元。总的来说缬更昔洛韦相比于更昔洛韦而言在抢先治疗allo-HSCT 术后CMV 血症方面有更好的临床效果和经济学评价。见表4。
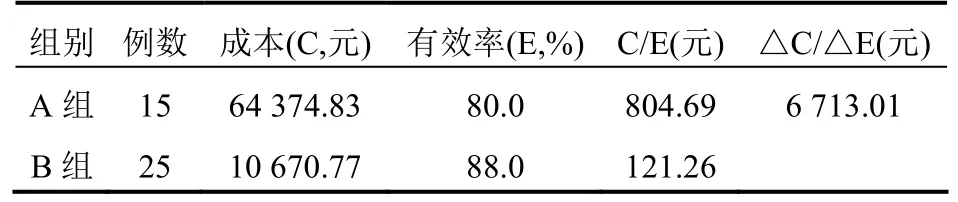
表4 两组患者成本-效果比较
2.3 敏感性分析
研究中采用的数据具有潜在的不确定性,为排除其他不确定因素对分析结果的干扰,本研究采用降低10%药品费用并且增加10%诊断费用的手段,进行敏感性分析,所得成本-效果分析结果与前述结果一致,说明此前分析的数据和结论可信。见表5。
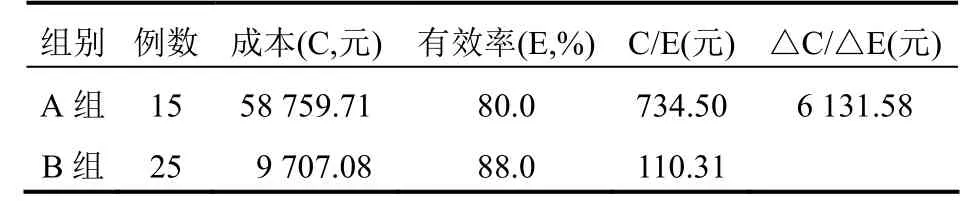
表5 两组患者用药方案的敏感度比较
3 讨论
CMV 感染是allo-HSCT 后最常见的病毒感染,若进展为CMV 病,可导致多脏器疾病,诱发死亡,不但影响患者生命质量及移植疗效,而且可明显增加移植成本,因此CMV 感染的防治至关重要[7]。因此,为减少CMV 病的发生,抢先治疗策略已被各移植中心广泛应用。口服缬更昔洛韦进行抢先治疗避免了用更昔洛韦治疗需要静脉滴注及住院的麻烦,减少了静脉炎、医院交叉感染等发生风险[8]。对于allo-HSCT 后患者而言,患CMV 血症后口服缬更昔洛韦进行抢先治疗疗效肯定,是较佳的选择,同时能缩短住院时间,居家治疗也更加安全便捷。目前,缬更昔洛韦在国内并没有得到广泛应用,主要原因之一是其价格昂贵且未纳入医保报销。因此需从经济学角度对其进行成本与效果综合分析,以得到直观的数据结果来证明其临床优势。
本研究基于真实世界病例数据利用药物经济学评价对更昔洛韦与缬更昔洛韦两种药物进行成本-效果分析,可为缬更昔洛韦在临床推广提供依据。本研究结果显示,与更昔洛韦比较,缬更昔洛韦治疗有效率更高;从药物经济学角度来说,更昔洛韦组为多获得一个健康效果所支付的成本比缬更昔洛韦组花费的更多,单位增量效果所需的成本也更多[9-10]。敏感性分析结果表明,当降低10%药品费用且增加10%诊断费用进行敏感性分析,其结果与基础分析结果具有一致性,即缬更昔洛韦在CMV 血症的抢先治疗方面具有更好的效果,口服缬更昔洛韦的治疗方式能为社会节约医疗资源,同时也能减轻患者经济负担和心理压力。
回顾性分析的研究方法要求所使用的数据来源于现实生活中,贴近实际,更具代表性,可避免随机对照临床试验环境所带来的限制[11]。药物经济学研究最主要的目的之一是促进合理用药,有效利用药品资源[12]。分析结果显示,从临床角度来说缬更昔洛韦相较于更昔洛韦更具优势。
总之,在临床治疗过程中,选择经济有效的方案能使有限的医疗资源得到最大程度利用,同时节约患者治疗成本,提高社会经济效益。但由于数据和方法上的不足,本研究也存在一定的局限性。1)与更昔洛韦和缬更昔洛韦相关的临床研究数量有限,结果的有效性尚待证实。本研究中暂未计算CMV二次再激活的成本-效果数据,因为在CMV 二次再激活后,需要继续跟踪治疗情况来获得其经济学分析数据,其中A、B 组分别有20%、12%的患者CMV二次再激活。由于这部分患者再治愈后仍有3 次甚至多次CMV 再激活的可能且回顾性分析起来较困难,因此可构建决策树模型进行分析。但在本研究中,CMV 二次再激活后存在多种药物联合使用的情况,且由于样本数量较少,药物经济学分析结果极大可能不会发生质的改变,且目前可用的相关文献数据较少,无法很好地完成模型研究,因此暂不进行CMV 二次再激活后的决策树模型分析。2)本研究样本量少,还应加大样本量,以期真正做到科学的药物经济学研究设计,降低由于样本量不足带来的误差。3)本研究部分使用简化和估算来计算成本,因此需要提高数据调查结果的准确性,且由于敏感性分析过程中变量由分析者确定,这可能会对研究结果造成潜在的偏倚。

