圈养孟加拉虎脂肪间充质干细胞的分离培养和生物学特性
冼伟杭,张天佑,赖健仪,王丙云,董贵信,3,陈志胜,陈胜锋,白银山,刘璨颖,张 晖,计慧琴
(1.佛山科学技术学院生命科学与工程学院,佛山,528200;2.广东长隆集团有限公司,广州,511430;3.广东华南珍稀野生动物物种保护中心,珠海,519031)
孟加拉虎(Panthera tigris tigris)是一种珍稀野生动物,保护这一珍稀动物除恢复栖息地外,还可通过圈养维持物种数量。目前圈养的孟加拉虎常发肾炎[1],常规治疗方法是使用抗菌消炎药物以及调节电解质和水盐平衡,但并不能修复受损器官组织结构,即不能完全恢复肾脏功能,可能导致孟加拉虎死亡。因此,为保护孟加拉虎,需要找到一种新型且有效地用于孟加拉虎肾炎治疗的方法。在这种情况下,一种涉及间充质干细胞(mesenchymal stem cells,MSCs)的疗法——再生疗法逐渐进入人们的视野。从中胚层起源的干细胞称为间充质干细胞,具备自我更新和多向分化潜能[2-4]。脂肪间充质干细胞(adipose derived mesenchymal stem cells,AD-MSCs)来源于脂肪,大量研究发现其在肾损伤治疗上具有疗效[5-12],并且具有来源丰富、操作简便、容易获取、体外增殖能力强等特征[13-15],目前已经从人、马、猪和牛等物种中成功分离[16-23]。ADMSCs 能通过分化途径分化为受损组织细胞[5,7-10]及通过旁分泌途径分泌因子发挥干细胞募集、血管再生、减轻炎症反应和抗细胞凋亡等作用[5-10,12],促进受损组织的修复,进而起到有效治疗肾损伤的效果[5-12]。
基于AD-MSCs 在治疗肾损伤方面的作用,认为其具备治疗虎肾病的潜能,但目前缺乏标准化的分离、培养和鉴定虎AD-MSCs 的方法。本试验拟研究虎AD-MSCs 的分离方法、培养体系以及生物学特性,为虎的肾病等疾病治疗提供种子细胞。
1 材料与方法
1.1 实验动物
长隆野生动物园1岁雌性孟加拉虎。
1.2 脂肪采集及原代AD-MSCs的分离和培养
对孟加拉虎进行腹部增生物切除手术时,在距离患处5 cm 处采集脂肪,然后结节缝合,将采集到的脂肪储存在含有10%双抗的1×phosphate buffered saline(PBS)中,冷藏保存运输到实验室。用含10%双抗的PBS 洗去组织上的血液,清洗干净后将组织放进50 mL 离心管中,用无菌器械将组织剪碎,加入0.1%Ⅰ型胶原酶消化1 h 至无明显组织块后终止消化;将消化好的组织过滤并离心,弃上清,用完全培养基将细胞重悬;进行细胞计数,然后将细胞密度调整到1×106个/mL 并转移到培养皿中,放置于培养箱37 ℃、5% CO2培养,24 h 后观察细胞贴壁情况。
1.3 细胞传代培养、生长特性观察及生长曲线的绘制
待细胞在培养皿生长面积达到80%,吸去上清,用PBS 清洗。加入胰酶消化,40 s 后加入终止液终止消化。离心弃上清,传代扩增培养。显微镜下观察细胞生长状态和活性,拍照记录。依次选取P3、P6、P9 代孟加拉虎AD-MSCs,调整细胞密度并接种于96 孔板,培养24 h 后,每天同一时间段选取5 孔,加入CCK8 孵育30 min,利用酶标仪测量并记录对应OD 值,每孔测量3 次取平均值,持续8 d。以横坐标为培养时间,纵坐标为OD 值绘制生长曲线。
1.4 细胞形态学观察
使用倒置显微镜对原代及传代细胞的形态进行观察并记录。
1.5 AD-MSCs成脂诱导分化试验
选取生长状态良好的P3 代细胞,调整细胞密度接种到24 孔板中培养,各选取3 个孔作为对照组和试验组。对照组用完全培养基培养,试验组加入诱导分化A 液,诱导分化A 液由88.5%基础培养基、10.0%胎牛血清、1.4%成脂诱导分化添加物A-Ⅰ和0.1%成脂诱导分化添加物A-Ⅱ构成。培养3 d后加入B 液培养1 d 为1 个循环,诱导分化B 液由90.0%基础培养基、9.8%胎牛血清和成脂诱导分化添加物B构成。试验组在培养3个循环后,弃上清,清洗,用多聚甲醛固定30 min,弃去多聚甲醛并清洗。用油红O 染色30 min,染色结束清洗多余染液,利用倒置显微镜观察并拍照记录。
1.6 AD-MSCs成骨诱导分化试验
选取生长状态良好的P3 代细胞,调整细胞密度接种到24 孔板中培养,各选取3 个孔作为对照组和试验组。对照组用完全培养基培养,试验组用成骨诱导分化培养基培养,培养14~21 d可见细胞表面有明显粗糙样物质,弃上清并清洗细胞,用多聚甲醛固定30 min,弃多聚甲醛并清洗,加入茜素红染液染色30 min,染色结束清洗多余染液置于倒置显微镜下观察并拍照记录。
1.7 总RNA提取及cDNA合成
将虎AD-MSCs 接种于6 孔板上,待细胞长满弃上清并用DEPC-H2O 清洗,然后按照以下步骤进行:(1)用TRIzol 液裂解细胞后离心。(2)离心结束弃上清加入氯仿,混合静置离心。(3)离心结束吸取上层水层至新的EP 管中,加入异丙醇混合离心。(4)离心结束后弃上清,加入乙醇,混合离心。(5)离心结束弃上清,沉淀室温干燥后加入RNase-free ddH2O溶解沉淀并检测浓度,结果显示A260/A280值为1.867,可用于cDNA 合成。(6)cDNA 合成使用TaKaRa 反转录试剂盒,依据试剂盒说明书操作,-20 ℃保存合成的cDNA。
1.8 PCR基因检测
将cDNA 全组基因作为模板进行PCR 体系扩增,电泳检测扩增产物,引物设计见表1。因产物大小在200~3 000 bp,所以需配制1.5% 的电泳胶,取0.75 g 琼脂粉加热溶解在60 mL 的1×TAE 缓冲液中,然后加入4 µL 核酸染液搅拌均匀,倒板并冷却30 min,冷却后依次加入DL2000 DNA Marker及PCR 产物,在电压120 V、电流200 mA 的条件下电泳20 min,电泳结束后在照胶仪下观察记录电泳结果。

表1 MSCs相关基因的引物序列Tab.1 Primer sequences of MSCs related genes
2 结果
2.1 细胞形态学观察
通过Ⅰ型胶原酶消化法得到原代培养的细胞呈圆形,部分贴壁细胞呈梭状,胞体透亮(图1A);培养48 h 后,大量细胞开始贴壁,细胞形态为长梭形,胞质较大,折光性强(图1B);培养72 h 后,细胞生长面积为70%~80%,可进行传代扩增培养(图1C);传代细胞形态为均匀梭形(图1D);传代培养至P6代细胞生长稳定(图1E);细胞形态没有发生改变(图1F)。
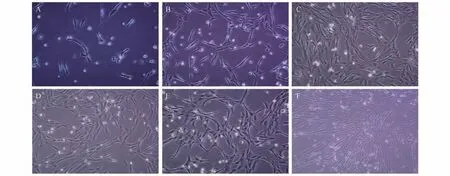
图1 孟加拉虎AD-MSCs生长状况Fig.1 Growth of AD-MSCs in Bengal tiger
2.2 AD-MSCs生长曲线
图2显示,P3、P6和P9代虎AD-MSCs的生长曲线均为S型,P3、P6和P9培养至第4天进入对数生长期,P3、P6代细胞培养至第7天进入平台期,P9代细胞培养至第8天进入平台期。与P3、P6代细胞比,P9代细胞增殖能力下降。符合MSCs生长曲线规律。
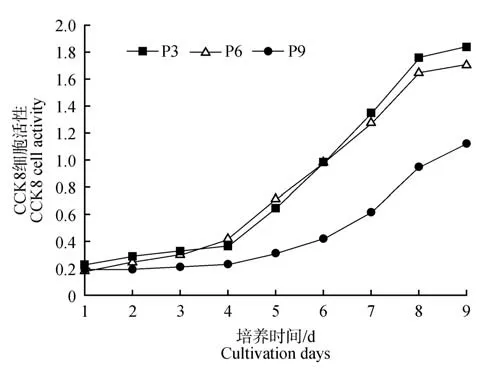
图2 孟加拉虎AD-MSCs生长曲线Fig.2 Growth curve of AD-MSCs of Bengal tiger
2.3 AD-MSCs成脂诱导分化
取生长状态良好的P3 代细胞进行成脂诱导分化,对照组细胞形态上没有明显变化,试验组细胞在加入诱导分化培养基4 d 后,胞体变大变圆,部分细胞发生融合,且可见胞质内出现大小不一的脂质颗粒,培养6 d 后脂滴增多变大。培养8 d,脂滴明显,用油红O 染色结果显示试验组的脂滴能红染(图3B),对照组不被染色(图3A),表明虎AD-MSCs具有脂向分化能力。

图3 孟加拉虎AD-MSCs成脂诱导分化结果(100×)Fig.3 Adipogenic differentiation of Bengal tiger AD-MSCs(100×)
2.4 AD-MSCs成骨诱导分化
取生长状态良好的P3 代细胞进行成骨诱导分化鉴定,对照组细胞形态上没有发生明显变化。试验组加入成骨诱导培养液培养7 d后,细胞形态发生明显变化,由长梭状变为鳞片状,细胞成片状堆积;诱导培养14 d 细胞表面可见粗糙样物质,此时利用茜素红进行成骨染色。显微镜下观察试验组可见细胞融合生长,视野内可见明显红染区域(图4B),表明成骨诱导条件下细胞形成钙结节。对照组视野下无明显红染区域(图4A)。
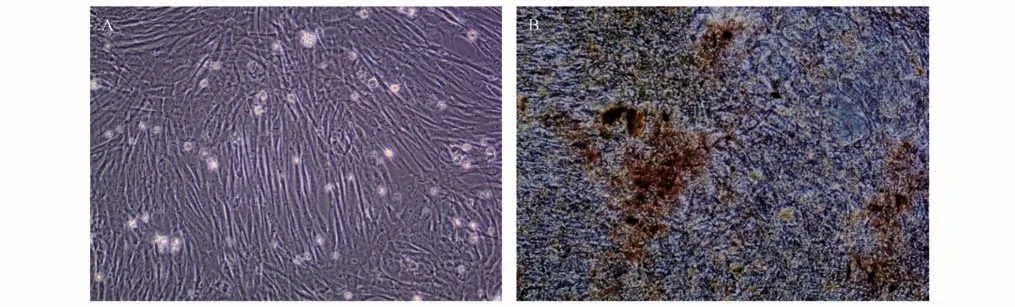
图4 孟加拉虎AD-MSCs成骨诱导分化结果(100×)Fig.4 Bone induced differentiation of Bengal tiger AD-MSCs(100×)
2.5 AD-MSCs表面标记物基因检测
PCR 基因检测结果如图5 所示,表面标记物CD90、CD105、CD29 和CD44 在相应范围有明显条带,CD34 在相应范围无条带,表明该细胞阳性表达CD90、CD105、CD29 和CD44,不表达CD34,结果符合间充质干细胞表面标记物特性。
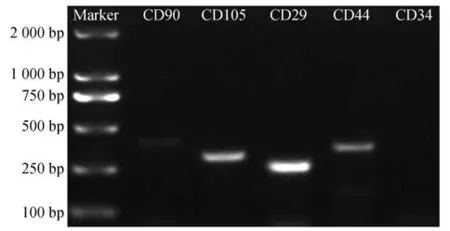
图5 孟加拉虎AD-MSCs表面标记物基因检测结果Fig.5 Detection results of AD-MSCs surface marker genes in Bengal tiger
3 讨论
圈养孟加拉虎常发肾炎疾病[1],恢复受损组织的再生疗法成为新的治疗选择。再生疗法是以MSCs 为基础的治疗方式[24]。MSCs 是一种起源于中胚层的干细胞,具有自我更新能力和多向分化能力[2-4],在体外培养能连续传代且保持细胞的形态和特性。诱导培养条件下,能分化为脂肪细胞、骨细胞和软骨细胞等多种细胞。MSCs 具有免疫原性低、趋化归巢、旁分泌和免疫调节等能力[2-3],因此广泛应用于再生医学的研究。AD-MSCs 与其他来源的MSCs 相比,具有来源丰富、供体创伤轻、易获得和体外增殖能力强的特点[13-15]。目前已经成功从多种动物上分离培养AD-MSCs,但虎脂肪来源的MSCs分离培养没有研究报道。在多种疾病的治疗上,ADMSCs被大量使用,其中在肾损伤治疗的研究中也取得进展,如犬、猫及小鼠的急性肾损伤、缺血性灌注肾损伤模型的治疗中具备效果[5-12]。不同种属的同种MSCs能表达相同表面标记物,相同表面标记物表达表明细胞具有相似的潜能[25-26],因此虎AD-MSCs的分离方法、培养体系的建立具有重要意义,为后续虎AD-MSCs 的应用建立基础,为虎肾病的治疗提供新式疗法。
AD-MSCs分离方法主要为胶原酶消化法。本研究采取Ⅰ型胶原酶消化法从脂肪组织分离得到虎的AD-MSCs。在显微镜下可见细胞形态为长梭形,生长方式为旋涡状生长,与已有研究[16-23]分离的ADMSCs 形态描述结果相符。对细胞进行多次传代培养,细胞形态保持不变,均为长梭形,P3、P6 和P9 细胞生长曲线符合MSCs 生长曲线规律。P3、P6 代细胞增殖能力差异小,与P3、P6代细胞比,P9代细胞增殖能力下降。有研究表明,MSCs 在体外培养条件下,P3 至P6 MSCs 增殖速度快、形态良好、活性强。MSCs传代至P9后,MSCs会出现空泡化、胞体变大及增殖缓慢等细胞老化现象[27]。根据MSCs 体外培养的特点可以为后续临床应用细胞代数的选择提供参考,同时也要求完善体外培养体系,延缓细胞老化。
本研究使用PCR 检测AD-MSCs 表面标志物,通过PCR 扩增得到相应MSCs 特定表面标记物基因片段。结果显示在区间范围内有CD90、CD44、CD105及CD29条带,无CD34条带。在诱导培养基条件下,AD-MSCs 可向脂肪、骨和软骨等方向分化。本试验分别对孟加拉虎AD-MSCs 进行成骨和成脂诱导分化,检测虎AD-MSCs 的多向分化能力。成骨诱导培养基主要成分为地塞米松、抗坏血酸和β-甘油磷酸,其中地塞米松和抗坏血酸有利于骨成熟和细胞外基质胶原的合成,而β-甘油磷酸钠有利于细胞内钙盐沉积和钙化形成。沉积的钙盐可用茜素红染液染成深红色以便在显微镜下观察。成脂诱导分化液中主要诱导因子有胰岛素、IBMX、罗格列酮和地塞米松,能够促进MSCs 向脂肪方向诱导分化。上述结果均符合国际MSCs 标准定义,即:表达CD44、CD90、CD105和CD29等MSCs表面标记物,不表达CD34等造血细胞表面标志物;在特定条件下可诱导分化为骨细胞和脂肪细胞[16-23,28-29]。
本研究不提供细胞流式鉴定结果,原因是目前可以获取的流式抗体因种属特异性,无法在虎ADMSCs 上表达,不适用于虎AD-MSCs 的流式细胞术鉴定。
综上所述,本研究成功建立虎AD-MSCs 原代分离培养方法,该方法操作简单方便,具有获得大量虎AD-MSCs的优势,同时通过诱导分化、表面标记物表达等鉴定试验,表明所获取细胞为虎AD-MSCs,为虎AD-MSCs的后续研究和临床应用提供稳定的细胞分离和培养方法。

