熔盐水合物选择性水解纤维素制备葡萄糖
梁皓童, 林健颖, 袁绍敏, 马巧智
熔盐水合物选择性水解纤维素制备葡萄糖
梁皓童, 林健颖, 袁绍敏, 马巧智
(华南农业大学材料与能源学院, 广州 510642)
针对目前熔盐水合物(MSH)对纤维素的溶解、 水解机理尚不明确这一问题, 本文系统地研究了纤维素在Li+, Na+, K+, Zn2+阳离子及Cl‒, Br‒, I‒阴离子所组成的MSH中水解的情况, 筛选出对纤维素水解效果最佳的熔盐——LiBr, 并研究了体系酸性对水解的影响规律. 结果表明, MSH中阳离子Na+和K+在水中的有限溶解度导致没有足够的阳离子与纤维素中的氧原子配位, 无法为糖苷键断裂提供足够的路易斯酸; MSH中的阴离子Cl‒的电负性不足以与纤维素中的羟基形成足够的新的氢键, 纤维素溶解度不足导致水解效果较差. 在非酸化体系中, 130 ℃, 5 h的反应条件下, 纤维素在LiBr熔盐体系内可以被选择性水解为水溶性低聚糖和葡萄糖单糖, 收率分别为57.2%和29.0%. 在酸性环境下, MSH能有效催化纤维素糖苷键断裂, 质量分数0.01%(HCl)LiBr熔盐体系于100 ℃水解纤维素30 min后, 产物以寡聚葡萄糖为主, 聚合度在4~13之间. 酸性的提升可以提高糖苷键的断键效率; 质量分数0.1%(HCl)LiBr在100 ℃, 30 min条件下水解纤维素, 葡萄糖得率可以达到90.9%.
纤维素; 葡萄糖; 熔盐水合物; 水热解聚; 酸性调控
木质纤维素是自然界存在的最丰富的生物质资源, 被认为是化石燃料极优的替代品. 纤维素作为木质纤维类生物质的主要组分之一, 大约占木质纤维素干重的40%~60%[1]. 纤维素是一种可再生天然有机高分子聚合物[2], 植物每年通过光合作用能产生大量纤维素类物质, 其年产能超过1010吨[3], 储量极为丰富. 在能源行业, 纤维素类物质的碳平衡接近中性, 其利用对环境保护发挥着至关重要的作用, 有助于减少因燃烧化石燃料造成的环境问题.
纤维素是由-葡萄糖单元通过-1,4-糖苷键连接的线性葡萄糖聚合物[4], 可以被水解生成葡萄糖单糖, 进而制备多种高附加值化学品和高品质燃料, 如各种醇、 5-羟甲基糠醛(HMF)、 乳酸、 葡萄糖酸、 2,5-二甲基呋喃、 戊酸酯和乙酰丙酸等[5]. 但纤维素中大量分子间和分子内氢键的存在导致高结晶度结构[6], 引起强疏水性, 极大限制了催化剂对活性作用位点的可及性、 降低水解效率. 近年来的研究表明, 纤维素可以溶解在离子液体[7]和一些特殊溶剂中, 这类溶剂能有效破坏纤维素的氢键结构、 降低结晶度[8]. LiBr, ZnCl2等熔盐水合物被认为是一种特殊的离子溶液, 它的阳离子可以和纤维素中的氧原子发生配位作用[9], 并且高负电性的卤族阴离子能够与纤维素中的羟基配位, 从而产生新的氢键, 继而破坏纤维素的高结晶度结构、 增加纤维素的溶解度[10]. 纤维素能在熔盐体系中得到比较充分的水解, 有助于纤维素进一步的转化利用. 近年来, 国内外学者对熔盐体系下纤维素的解聚反应进行了大量研究. Sen等[11]使用ZnCl2的浓盐溶液处理纤维素, 发现该体系对于纤维素分子间与分子内氢键的破坏有显著效果. 与传统的纯水解聚体系相比, 熔盐体系的反应条件更温和、 解聚效果更好. Yu等[12]确定了HCl/LiCl从纤维素生产葡萄糖的条件[2%(质量分数)HCl/50%(质量分数)LiCl溶液用于80 ℃下水解纤维素], 可以在1 h内获得高产率(>60%)的葡萄糖. Wang等[13,14]研究了在LiCl·3H2O中葡萄糖转化为5-羟甲基糠醛(HMF)和LA的过程, 在LiCl·3H2O和甲基异丁基酮(MIBK)组成的两相体系中, 辅以NbPO4/HZSM-5为催化剂转化纤维素合成乙酰丙酸, 产率达到94.0%; 并证明了该双相溶剂抑制了HMF与腐殖酸的二次反应.
体系内的酸度对纤维素的化学转化效果也有很大的影响. Rodriguez等[15]研究了不同浓度、 酸度LiBr/H2SO4溶液对纤维二塘(一种纤维素替代分子)水解的影响, 证实纤维素的溶解和剥离速率高度取决于溶液中的酸度和离子的总浓度. Shen等[16]研究表明在ZnCl2中加入少量HCl可以调节纤维素的溶胀和水解效率; HCl浓度升高有利于纤维素的水解, 当加入的HCl浓度达到1 mol/L, 纤维素全部水解为低聚糖或单糖. Sadula等[17]研究表明在LiBr-MSH(熔盐水合物)和酸的协同作用下木聚糖能有效转化为木糖(收率大于90%), 木糖的收率随LiBr和酸浓度的增加而增加, 但过高的酸浓度会导致木二糖和糠醛的出现. 总的来说, 尽管熔盐对纤维素的水解性能已有研究, 但水解作用机制尚不明确. 为了深入解析纤维素在熔盐中的水解特性, 明晰阴阳离子在水解反应过程中的贡献程度, 本文采用不同阴阳离子配比的熔盐溶液对纤维素进行水解. 以低聚糖和葡萄糖收率为评价标准, 对纤维素在非酸化和酸化熔盐体系中的水解情况进行了研究, 最终指导适配型熔盐体系的筛选, 同时通过探究酸度的改变对纤维素在熔盐体系中转化的影响规律, 掌握熔盐体系对纤维素的催化特性.
1 实验部分
1.1 试剂与仪器
微晶纤维素, 纯度99%, 阿拉丁(中国)试剂有限公司; 溴化锂(LiBr, 纯度99%)、 氯化锂(LiCl, 纯度98%)、 碘化锂(LiI, 纯度98%)、 氯化钠(NaCl, 纯度98%)、 溴化钠(NaBr, 纯度98%)、 碘化钠(NaI, 纯度98%)、 氯化钾(KCl, 纯度98%)、 溴化钾(KBr, 纯度98%)、 碘化钾(KI, 纯度98%)、 氯化锌 (ZnCl2, 纯度98%)和溴化锌(ZnBr2, 纯度98%), 美国Sigma-Aldrich公司; 硫酸(H2SO4, 质量分数98%)和盐酸(HCl, 质量分数36.7%), 广州化学市试剂厂.
LC-20AT型高效液相色谱(HPLC), 美国安捷伦公司; Rapiflex MALDI Tissuetyper 型基质辅助激光解吸飞行时间质谱仪(MALDI-TOF/TOF), 瑞士Bruker公司; GPC 50 型凝胶渗透色谱(GPC), 美国 Agilent公司; MIRA LMS 型扫描电子显微镜(SEM), 捷克TESCAN公司.
1.2 实验过程
1.2.1熔盐水合物的配制通过在去离子水中溶解特定量的无机盐来制备一系列的熔盐水合物, 熔盐水合物的阳离子水合数大于等于水和阳离子的摩尔比, 以LiBr为例, 将12 g LiBr固体加入50 mL离心管中, 再加8 g蒸馏水, 振荡超声至固体完全溶解, 存放好用于后续实验. LiI, NaBr盐常温溶解度略小于计算浓度, 采用提高温度溶解的方法, 分别升温为50和40 ℃; NaCl, KCl, KBr这3种盐在常温下的溶解度低于理论计算所需的浓度, 提高温度的方法并不能提升它们在水中的溶解度. 因此, 选择使用NaCl, KCl, KBr的饱和溶液来进行实验. NaCl加热至100 ℃溶解度为28%(质量分数), 建议配制浓度为26%(质量分数); KCl 加热至100 ℃时溶解度为36%(质量分数), 每升高10 ℃溶解度约增加1%, 建议配制浓度为25%(质量分数); KBr 加热至100 ℃时, 溶解度为50.9%(质量分数), 建议浓度配制为40%(质量分数). 其中每种MSH的水与盐的摩尔比列于表1.
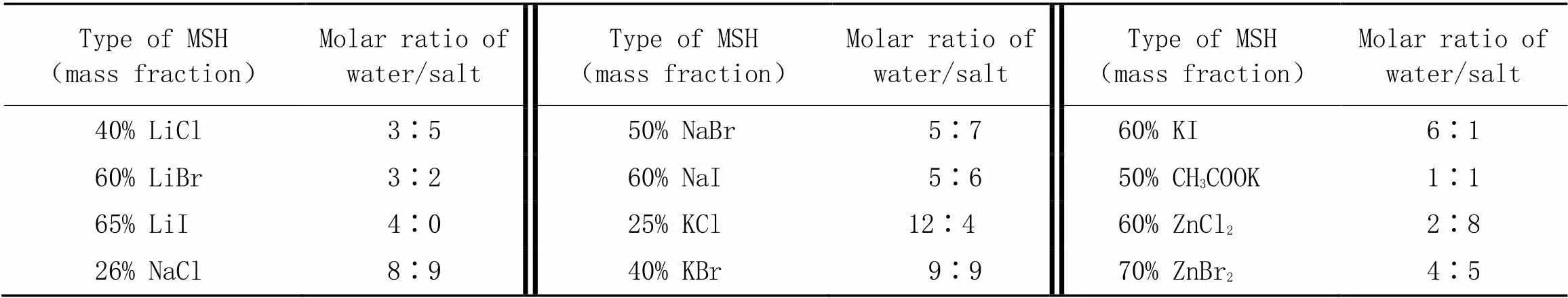
Table 1 Molar ratio of water to salt and cation coordination number in molten salt hydrate
1.2.2微晶纤维素在熔盐体系内的水热解聚为了了解纤维素在熔盐体系中的解聚机制, 提高纤维素的水解效率, 以微晶纤维素(MCC)为原料在熔盐体系下直接进行水解反应, 可分别获得葡萄糖、 水溶性聚糖、 无定型纤维素以及未反应纤维素4种产物, 实验流程如Scheme 1 所示.
Scheme 1Experimental process of preparing monosaccharide by converting microcrystalline cellulose in molten salt system
非酸化体系: 每次实验取100 mg微晶纤维素与6 g熔盐水合物加入厚壁耐压瓶, 密封好厚壁耐压瓶, 置于油浴锅中反应. 反应条件为130 ℃, 水解5 h, 收集水解产物, 收集后进行抽滤, 将固体、液体产物分开保存. 酸化体系: 每次实验取100 mg微晶纤维素和6 g 酸性熔盐水合物(HCl浓度为 0.05 mol/L)加入厚壁耐压瓶, 密封后置于油浴锅中反应. 反应条件为85 ℃, 水解30 min, 收集水解产物后进行抽滤, 将固液产物分开保存.
1.2.3分析检测方法将过滤后获得的液相产物用去离子水稀释10倍, 直接通过HPLC测量葡萄糖 浓度, 计算可得液相产物中的葡萄糖含量. 接着按照美国能源实验室(NERL)公布的方法, 通过使用 稀硫酸将水解液中的水溶性聚糖水解成葡萄糖来测量计算液相产物中水溶性聚糖的含量, 具体操作 方法如下: 将过滤后得到的1 g水解产物加入到厚壁耐压管(15 mL, 北京欣维尔有限公司)中, 再加入5 g 4%(质量分数)H2SO4, 在磁力搅拌下置于121 ℃的油浴锅中反应1 h. 通过HPLC检测葡萄糖含量, 计算得水溶性聚糖含量. 无定型纤维素的含量则是通过用稀酸水解固体产物后获得的葡萄糖量来进行定量. 将固体中的无定型纤维素水解成葡萄糖, 向过滤后获得的固相产物中加入30~40 mL 4%(质量分数)H2SO4, 在磁力搅拌下置于121 ℃的油浴锅中反应1 h, 经过过滤后用HPLC直接测定反应液中葡萄糖含量, 通过计算得到无定型纤维素的含量. 未反应纤维素的含量通过浓-稀酸水解固体产物后获得的葡萄糖量来进行定量. 先用去离子水冲洗固体剩余物表面残留的葡萄糖, 洗净的固体剩余物与1 mL 72%(质量分数) H2SO4混合, 在30 ℃的油浴锅中反应1 h. 然后向反应混合物中加入28 mL去离子水, 将浓度从72%(质量分数)稀释至4%(质量分数), 并在121 ℃下反应1 h. 经过过滤后用HPLC直接测定反应液中葡萄糖含量, 通过计算得到未反应纤维素的含量.
1.3 不同酸度LiBr熔液的配制
配制不同酸度的60%LiBr 溶液(MSH). 首先制备浓度(质量分数)分别为0.1%, 0.05%, 0.01%, 0.001%的HCl溶液. 然后向12 g LiBr中分别加入8 g各浓度HCl溶液, 振荡超声至固体完全溶解, 配制成各种酸度的60%LiBr溶液(MSH). 微晶纤维素在不同酸度熔盐下直接进行水解反应, 可分别获得葡萄糖、 水溶性聚糖、 无定型纤维素以及未反应的纤维素4种产物. 后续HPLC分析检测方法与1.2.3节一致.
1.4 纤维素水解后聚糖聚合度的分析
利用GPC和MALDI测定低聚糖分子量. 测定前需要通过透析移除水解液中的 LiBr 盐. 具体步骤如下: 将适量熔盐溶液的水解液直接加入15 cm的透析管中(T3, Cellu-Sep). 将透析袋置于1000 mL烧杯中并向其中加满去离子水, 以100 r/min的低速旋转搅拌, 直至管内溶液由黄色澄清溶液变为白色絮状沉淀. 随后将沉淀洗出, 在旋转蒸发器内蒸干, 水浴温度设定60 ℃.
旋蒸后得到的样品再经功能化修饰, 使之在四氢呋喃(THF)流动相内变得可溶, 可用于 GPC 以及 MALDI 的检测. 选取了5种不同的样品进行分析, 分别是微晶纤维素在LiCl, LiBr, LiI 3种熔盐体系中, 130 ℃的温度下, 经5 h水解的产物; 以及加酸熔盐部分的0.001%(HCl)LiBr(100 ℃, 30 min)和0.01%(HCl)LiBr(100 ℃, 30 min)的产物. 功能化方法如下: 将透析烘干后得到的5 mg干燥固体样品与0.2 mL异氰酸苯酯、 2 mL无水吡啶一起加入15 mL的厚壁耐压管内, 置于80 ℃油浴锅中反应24 h. 随后向反应后得到的黄色澄清液中加入0.5 mL甲醇终止反应, 再将反应后的混合物在65 ℃的真空干燥箱中过夜烘干. 经修饰后的材料可以溶于THF, 使用GPC以及MALDI对溶解后的产物进行分子量测定. 其中, GPC色谱柱和折光示差(RI)检测器温度保持在40 ℃, 流速为1 mL/min, 以THF作为流动相. 可测的相对分子量范围为104~3×106的聚甲基丙烯酸甲酯(PMMA)标准测量分子量. 衍生化后的聚糖分子量按公式w=519×DP+256计算(DP表示聚糖的聚合度).
MALDI检测: 样品经THF溶解后, 将溶液与10 mg/mL的2,5-二羟基苯甲酸按照体积比1∶1的比例混合. 经短暂的搅拌混合后取1 μL的样品在正离子线性模式下, 选取最小激光流进行检测. 产物分子量的测定范围在103~1.2×104之间.
1.5 不同酸度LiBr水解纤维素产物的微观形貌分析
通过SEM对0, 0.001%, 0.01%(HCl)LiBr 熔盐体系在100 ℃下水解30 min后得到的微晶纤维素产物进行了检测. SEM测试电压为2.0 kV, 样品在4 mm转子中充电, 转子的旋转频率为5000 Hz. 从SEM照片分析酸性LiBr熔盐水解纤维过程产物的形貌.
2 结果与讨论
2.1 非酸系熔盐体系中不同阴阳离子对纤维素水解的影响
为了筛选可有效将纤维素水解的熔盐水合物, 研究评价了几种不同的熔盐水合物在相同反应条件下(130 ℃, 水解5 h)催化纤维素水解的效果. 反应水解产物分布如图1所示. 结果表明, 在非酸化条件下, LiCl溶液与纤维素反应, 未反应纤维素得率64.1%, 无定型纤维素得率3.3%, 水解产物是淡黄色溶液和沉淀. 未反应纤维素得率较高的主要原因可能是: LiCl中路易斯酸Li+与纤维素中的氧原子产生反应而发生电子转移, 选择性地催化糖苷键断裂. 但路易斯碱Cl‒的电负性不足以与纤维素中的羟基形成足够的新的氢键, 阴阳离子的协同作用不强. 60% LiBr被证明是一种可克服结晶纤维素结构的高结晶度和高聚合度的熔盐水合物. 图1中的结果表明, 利用60% LiBr水解纤维素可获得29.0%的葡萄糖收率以及57.2%的水溶性聚糖收率, 表明纤维素经过熔盐处理后, 可选择性水解至葡萄糖或水溶性 聚糖.
通过观察60% LiBr水解纤维素的反应现象, 发现其形成了浅黄色透明溶液, 基本没有固体剩余[图2(A)], 表明60% LiBr可以很好地完全水解纤维素且不会反应过度. 利用60% LiBr高效水解纤维素是因为高负电的Br‒与纤维素中的羟基形成大量新的氢键, 增加了纤维素的亲水性. 同时, 浓盐溶液中大量的路易斯酸Li+选择性地催化糖苷键断裂. 阳离子和阴离子的协同作用降低了纤维素的结晶度和聚合度, 从而达到提高纤维素水解效率的目的. LiI溶液与纤维素反应, 水溶性聚糖得率1.89%, 无定型纤维素得率20.1%, 未反应纤维素得率43.1%. LiI中路易斯酸Li+与纤维素中的氧原子产生反应而发生电子的转移, 选择性地催化糖苷键断裂, 路易斯碱I‒具有较强的还原性, 阴阳离子的协同作用下对纤维素固有结构有较强的破坏性, 得到了一定量的无定型纤维素. 实验现象中水解产物为黑色浆液, 是该实验过程中I‒发生氧化生成了单质. I‒发生氧化生成单质在一定程度上降低了溶液中阴阳离子的协同作用.
NaCl, NaBr, NaI溶液与纤维素反应的实验现象如图2(B)所示, 产物以未反应纤维素为主, 得率分别为92.6%, 90.4%, 58.7%. 无定型纤维素得率分别为2.42%, 1.55%, 3.71%, 3种Na盐水解纤维素效果较差, 原因可能是: 低浓度的Na+受限于在水中的有限溶解度, 并没有足够的阳离子与纤维素中的氧原子发生作用, 无法为糖苷键断裂提供足够的路易斯酸度, 对纤维素固有结构的破坏性不强, 生成产物较少; 熔盐中的阴离子Cl‒的电负性不足以与纤维素中的羟基形成足够的新的氢键, 这意味着熔盐水合物中的负离子无法取代链内和链间的氢键, 不能破坏纤维素的原有结构, 并在结构上增强纤维素的亲水性, 导致纤维素水解性能不好[18].
KCl, KBr, KI, CH3COOK溶液与纤维素反应的实验现象如图2(C)所示, 反应后, 未反应纤维素得率分别为93.1%, 86.4%, 88.8%, 69.7%. K盐对纤维素的破坏能力不足主要受限于K+在水中的有限溶解度. 使用CH3COOK水解纤维素可以得到0.7%的葡萄糖收率和3.13%无定型纤维素收率, 熔盐溶液中阴离子与氢键结合能力越强, 溶解纤维素的能力也越强, 所以在溶解纤维素的过程中, CH3COO‒更容易与羟基形成氢键而实现纤维素的溶解[19, 20], 所以CH3COOK比其它K+熔盐溶液水解纤维素葡萄糖收率要多一些.
ZnBr2, ZnCl2催化微晶纤维素水解的过程中产生的葡萄糖量较少, 碳平衡较低, 其实验现象中水解产物为黑色浆液[图2(D)], 这可能是由于腐殖质的形成, 表明在这些条件下催化微晶纤维素水解反应过度.
2.2 在非酸熔盐体系水解得到的低聚糖分子量测定
使用了GPC对分子的摩尔质量进行测定, 依据1.4节中的方法对产物的聚合度进行相应的计算. 对微晶纤维素在LiCl, LiBr, LiI 3种熔盐体系中, 130 ℃下, 经5 h水解的产物采用GPC测试样品的平均摩尔质量(w)和DP.
相同条件(130 ℃, 5 h)下LiCl溶液水解后所得样品的w为1.256×105、 聚合度为241, LiI溶液水解后样品的w为8.27×104、 聚合度为159. LiI对纤维素内部的氢键以及糖苷键的破坏相较于LiCl更有效, 这得益于路易斯碱I‒电负性更强, 足以与纤维素中的羟基形成足够新的氢键, 阴阳离子协同作用强. 此外, 在LiBr 130 ℃ 5 h条件下, GPC未能检测出熔盐体系水解下转化产物的平均摩尔质量, GPC能检测到的最小聚糖的聚合度为115, 因此LiBr水解产物的聚合度应该是小于115的. 这也说明了Li盐部分, LiBr对纤维素内部氢键以及糖苷键的破坏效果最为显著. LiI与纤维素反应后呈现黑色浆液, 是碘单质的颜色; 不添加纤维素原料, 用LiI做空白实验, 用四氯化碳萃取, 四氯化碳呈现粉红色, 证明了反应后碘单质的存在. 在该实验过程中碘发生氧化生成了单质, 单质的形成使离子浓度下降, 降低了纤维素水解效果, 因此聚合度会比LiBr高.
2.3 在酸系熔盐体系中不同阴阳离子对选择性水解纤维素制备单糖的影响
结果如图3所示, 在酸化条件下, LiCl溶液与纤维素反应, 未反应纤维素得率88%, 无定型纤维素得率2.2%, 水解产物是白色溶液和沉淀. LiCl对纤维素解聚性能不好的原因与在非酸体系下的原因相同, 熔盐体系中阴阳离子的协同作用差. 在酸化体系熔盐对比研究中, 60%(质量分数)LiBr仍然表现出优异的性能, 水解纤维素可获得41.2%的葡萄糖收率以及46.9%的水溶性聚糖收率, 能显著地提高纤维素转化率, 促进纤维素的水解效率. 相比于非酸体系, 酸化体系下LiI的水解效率有较为明显的提升, 有12.9%的葡萄糖收率和61.9%的水溶性聚糖收率. 酸化下的反应条件为85 ℃, 30 min, 在该条件下I‒不会发生氧化反应生成单质, 路易斯碱I‒具有较强的还原性, 与Li+建立较强的阴阳离子协同作用, 同时酸的加入有利于纤维素的水解, 这也使得LiI的反应有较高的葡萄糖和水溶性聚糖得率.
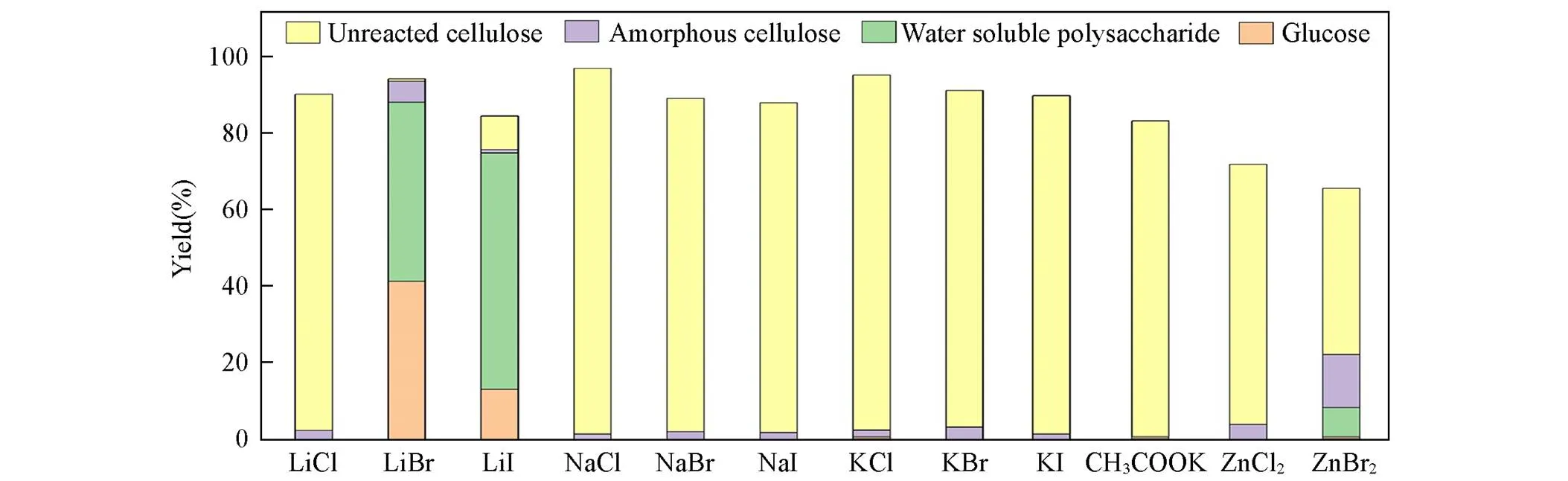
Fig.3 Product distribution after hydrolysis of microcrystalline cellulose in acid system
在酸性条件下, NaCl, NaBr, NaI, KCl, KBr, KI和CH3COOK溶液几乎不与纤维素反应, 反应后主要产物为未反应纤维素, 其余产物几乎没有(无定型纤维素得率均小于<2%), 结果与非酸熔盐体系下水解纤维素相类似. 7种熔盐对纤维素高结晶结构的破坏能力弱, 极大限制了酸对纤维素糖苷键的可及性并且酸用量较少, 因此即便有了酸的加入这7种熔盐对纤维素的水解能力仍较差.
在非酸体系条件下, ZnCl2和ZnBr2的反应产物呈现反应过度的黑色浆液状, 在酸化体系下, ZnCl2和ZnBr2纤维素轻微水解. 酸化体系下ZnCl2有3.7%的无定型纤维素收率; ZnBr2有13.9%的无定型纤维素以及7.6%的水溶性聚糖收率, 其原因可能是: 其高负电性的卤族阴离子Br‒与纤维素的羟基作用, 产生新的氢键, 使纤维素结构改变, 形成少量无定型纤维素, 同时其路易斯酸Zn2+产生了强酸性, 有利于水溶性聚糖的产生. 但由于酸化体系下反应条件不剧烈, 所以无定型纤维素以及水溶性聚糖的得率并不高.
在酸性条件下, LiCl, LiBr, LiI, NaCl, NaBr, NaI, KCl, KBr, KI, CH3COOK, ZnCl2和ZnBr2溶液与纤维素反应的实验现象见图4.

Fig.4 Experimental phenomenon diagram of the reaction solution after the acidification system reaction
2.4 酸度对纤维素在熔盐体系下转化的影响
基于上述实验结果, 纤维素在高浓度LiBr(60%)体系中极易发生水解, 且产物受酸度影响极大, 通过改变HCl 的添加量, 调节体系的pH 值, 对比不同pH 值下获得的产物收率(针对葡萄糖和水溶性低聚糖)和物理性质, 获得纤维素水解产物的调控规律.
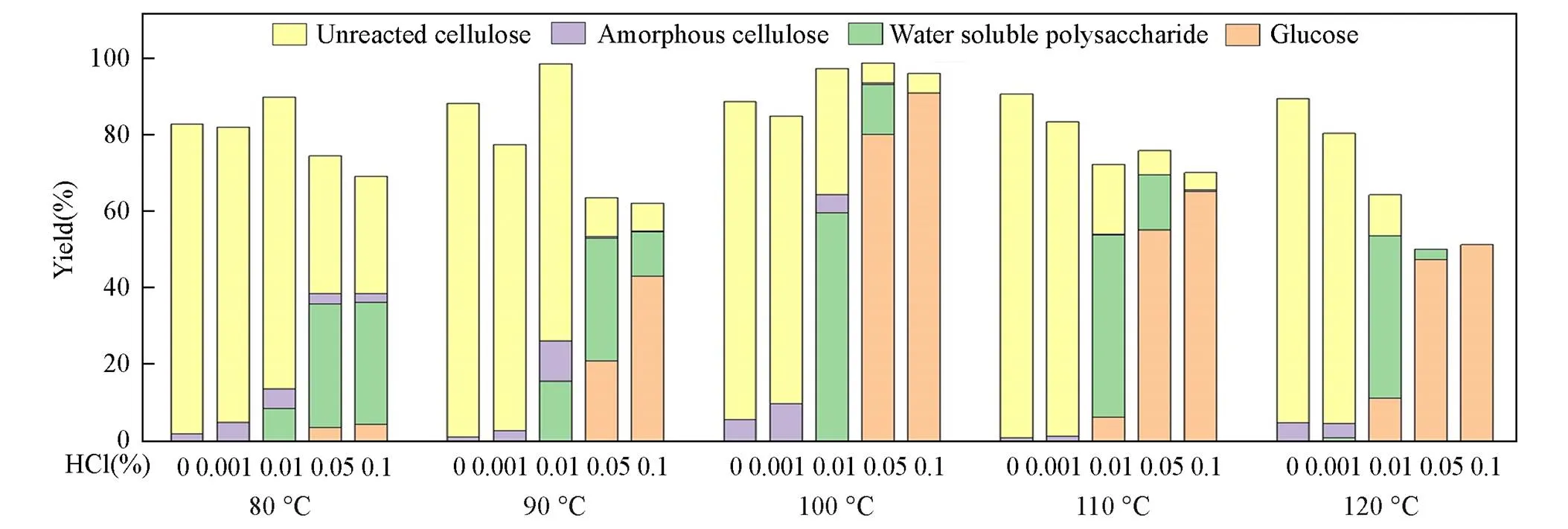
Fig.5 Effect of acidity on the transformation of cellulose in molten salt system
由图5可知, 不添加HCl或HCl质量浓度为0.001%时, 纤维素在实验温度下(80~120 ℃)基本不发生反应. 当HCl质量浓度为0.01%时, 纤维素在熔盐体系内水解生成水溶性聚糖的得率随温度的升高而升高, 80, 90和100 ℃水溶性聚糖得率分别为8.4%, 15.6%和59.6%. 反应温度达到110和120 ℃, 水溶性聚糖收率逐渐降低, 分别为47.7%和42.4%. 当HCl质量分数为0.05%时, 水解结果的趋势与0.01%时大致相同, 纤维素在熔盐体系内水解生成葡萄糖得率也随温度的升高而升高, 升高至120 ℃时略有降低. 这说明了温度升高有助于纤维素的水解, 但高温条件下葡萄糖收率降低, 产物颜色近乎黑色也表明过高的温度(110和120 ℃)以及酸性浓度增大这两点因素作用下容易使纤维素水解过度, 使水解得到的糖降解为胡敏素等副产物[21].
随着体系内酸性的增强, 转化率逐渐提升, 葡萄糖的收率不断增加, 并且纤维素的水解产物有着从未反应纤维素→无定型纤维素→水溶性聚糖→葡萄糖的转变趋势. 以100 ℃为例, 当HCl的浓度为0.001%时, 无定形纤维素收率为9.7%, 未反应纤维素收率为75.1%, 其余组分收率为0. 随着酸性增强, 浓度为0.01%时出现水溶性聚糖, 收率为59.6%; 未反应纤维素含量仅为33.0%. 当浓度为0.05%时, 水溶性聚糖收率降为13.0%, 转化为葡萄糖, 得率80.1%. 当浓度为0.1%时, 葡萄糖收率达到最高的90.9%. 酸浓度的提高使得生物质结构破坏严重, 因为糖苷键的断裂有赖于高浓度的氢离子[22,23]. 从碳平衡角度分析, 随着酸浓度的增加, 图5中所示物质总的得率逐渐小于100%, 这极可能是因为在较大酸浓度作用下糖降解而形成别的物质, 如糠醛和HMF[24].
不同温度、 不同酸性浓度的LiBr溶液水解纤维素的实验现象如图6所示.
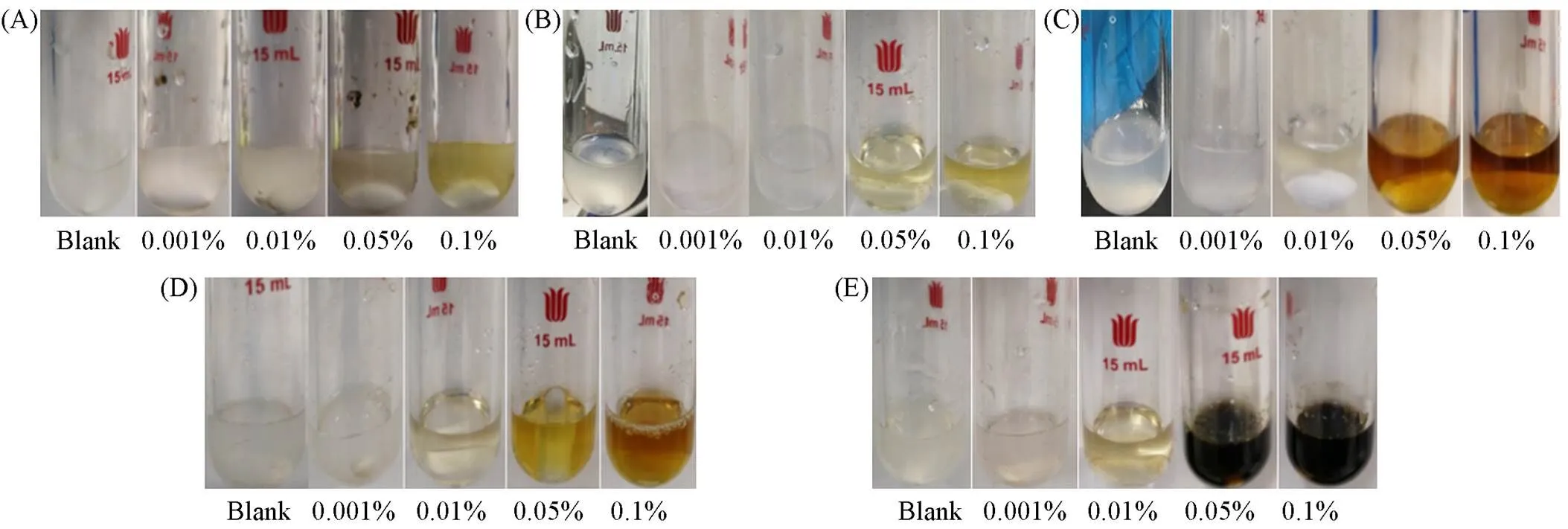
Fig.6 Physical map of hydrolysis of cellulose in LiBr solution with HCl different concentration(mass fraction) under acidic conditions
(A) 80 ℃;(B) 90 ℃;(C) 100 ℃;(D) 110 ℃;(E) 120 ℃.
为了进一步探究熔盐水合物在水解纤维素中发挥的作用, 将熔盐水合物水解纤维素与酸水解纤维素进行对比. 酸水解纤维素的结果列于表2中.
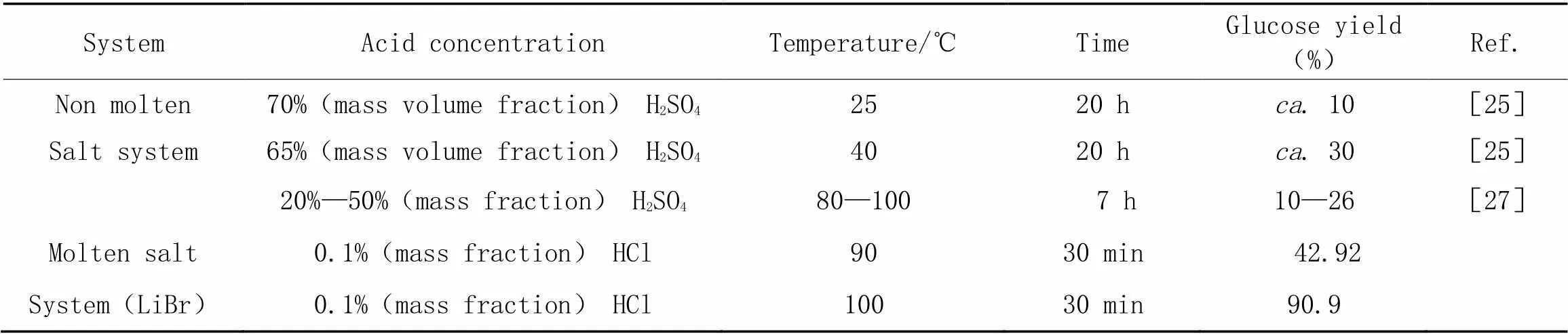
Table 2 Hydrolyzed cellulose in different systems and under different conditions
SriBala等[25]使用65%, 70%的H2SO4在25和40 ℃条件下水解纤维素20 h获得葡萄糖的得率分别约为30%, 10%. 根据Li等[26]的研究, 在180~220 ℃的条件下, 使用pH约为1.66的H2SO4水解纤维素, 最高的产率不超过50%. Kanchanalai等[27]使用20%~50% H2SO4在80~100 ℃条件下水解纤维素获得的葡萄糖得率为10%~26%. 除此之外, 还有利用低温和高酸浓度、 高温(超过150 ℃)和低酸浓度等方法水解纤维素, 但其葡萄糖产率均不高[25,28,29]. 而在LiBr熔盐体系下, 纤维素在90 ℃, 0.1% HCl条件下反应30 min便可以获得42.92%的葡萄糖得率. 当反应条件为100 ℃, 0.1% HCl时甚至可以获得90.9%的葡萄糖得率. 熔盐体系能够有效地破坏纤维素高结晶度结构, 增加纤维素溶解度, 致使糖苷键暴露. 苷键具有缩醛结构, 对酸不稳定, 而60% LiBr体系又能显著增强H+活性, 在熔盐和酸双重作用下苷键断裂形成苷元和碳正离子中间体, 继而溶剂化成糖, 因此熔盐与酸耦合作用具有远超单纯用酸水解纤维素的水解效率.
2.5 不同酸度熔盐体系水解得到的固体产物形貌
通过SEM对0, 0.001%和0.01%(HCl)LiBr熔盐体系在100 ℃下水解30 min后得到的微晶纤维素产物进行了检测. 如图7(A1)~(A3)所示, 未加入酸的LiBr水解纤维素产物呈现为较大的块状纤维素, 表面和切面都相对平整光滑. LiBr并未对纤维素造成明显破坏, 因此纤维素的形貌结构得以保留完整.

Fig.7 SEM images of solid products obtained from cellulose hydrolysis of LiBr at different acidities with different magnifications
(A1—A3) 0 (HCl)LiBr; (B1—B3) 0.001% (HCl)LiBr; (C1—C3) 0.01% (HCl)LiBr.
然而, 添加了0.001% HCl后, LiBr对纤维素的水解得到有效促进, 如图7(B1)~(B3)所示, 产物中出现了更多小块状纤维素, 其表面粗糙不规则, 并且形成了海绵结构, 部分纤维素转化为无定型状态. HCl的加入导致LiBr对纤维素发生明显的破坏作用.
进一步提高酸度至0.01%(HCl)LiBr体系, 产物呈现更小的块状颗粒, 每个颗粒的表面都十分粗糙, 并且固体颗粒呈多孔结构[图7(C1)~(C3)]. 与未加酸的0%(HCl)LiBr水解纤维素相比, 在SEM照片中观察到了明显的结构差异. HCl的加入使得纤维素在LiBr溶液中即使在较温和的反应条件下也发生了较为剧烈的水解.
2.6 酸性熔盐体系水解得到的低聚糖分子量测定
分别对0.001%(HCl)LiBr、 0.01%(HCl)LiBr熔盐体系100 ℃水解微晶纤维素30 min的产物进行了 MALDI检测. 0.001%反应产物以未反应纤维素和无定型纤维素为主, 0.01%产物则以水溶性聚糖为主, 两者聚合度存在明显差异. 检测的(0.001% LiBr, 100 ℃, 30 min)样品无法测出产物的分子量. 这说明0.001%水解产物的聚合度应该是大于23(MALDI所能检测到的最大聚糖的聚合度为23), 在该条件下纤维素水解产物冷却后会发生凝固现象, 分析是因为0.001%的酸性环境并不能很好地促进纤维素糖苷键的断裂, 使得纤维素的链式结构保存相对完好, 生成了水凝胶等物质[30,31], 这与MALDI测不出具体聚合度相印证. 0.01% LiBr熔盐体系100 ℃水解30 min后的产物分布图如图8所示. 该条件下水解产物得到一系列含不同葡萄糖单元的混合物, 产物聚合度在4~13之间. 酸度的增强有利于熔盐体系下纤维素糖苷键的断裂, 降低产物的聚合度, 当酸度增加到0.05%或0.1%时产物主要以单糖葡萄糖为主.

Fig.8 Distribution of product molar mass and polymerization degree of microcrystalline cellulose hydrolyzed at 100 ℃ for 30 min in 0.01%(HCl) LiBr solution
3 结 论
熔盐水合物水解纤维素能有效地打破纤维素表面的致密结构、 降低纤维素结晶度和聚合度, 通过添加微量均相酸进一步破坏内部氢键和断裂-(1,4)糖苷键, 实现纤维素在温和条件下高效水解, 在不同阴阳离子熔盐中, 阳离子Na+和K+在水中的有限溶解度导致没有足够的阳离子与纤维素中的氧原子发生作用, 无法为糖苷键断裂提供足够的路易斯酸度而导致纤维素水解性能不佳; 熔盐中的阴离子Cl‒的电负性不足以与纤维素中的羟基形成足够的新的氢键, 而导致纤维素水解性能不佳. 在非酸化体系中, 130 ℃, 5 h的反应条件下, 纤维素在LiBr熔盐体系内可以被选择性水解为水溶性低聚糖和葡萄糖单糖, 收率分别为57.2%和29.0%. 随着酸的加入, 即使体系的反应条件相对温和(温度为85 ℃、 时间为30 min), LiBr熔盐依旧具有相对较高的纤维素水解效率, 可获得41.2%的葡萄糖收率以及46.9%的水溶性低聚糖收率. 通过调节酸度来探究纤维素在熔盐体系中的转化规律, 当熔盐体系中酸性浓度较低时, 纤维素水解程度很小, 水解产物基本为未反应的纤维素, 而随着酸性的增强, 纤维素开始沿着从未反应纤维素→无定形纤维素→水溶性低聚糖→葡萄糖这一转变趋势发生转化. 在本实验设置的水解条件中, 酸性条件下纤维素水解产物分布受温度影响较大. 提高温度能够促进反应进行, 降低对熔盐体系中酸性浓度的要求. 随着温度的升高, 在同一HCl浓度下, 熔盐体系中的纤维素水解转化为葡萄糖的程度也逐渐增大, 但达到临界温度后继续升高温度会导致副反应的生成, 使得葡萄糖收率下降, 甚至会出现结焦现象. 相较于酸水解纤维素, 酸与熔盐耦合作用下极大降低了纤维素水解所需的酸用量, 0.1%(HCl)LiBr在100 ℃, 30 min条件下水解纤维素, 葡萄糖得率可以达到90.9%.
[1] Limayem A., Ricke S. C.,, 2012,(4), 449—467
[2] Chen X., Chen J. H., You T. T., Wang K., Xu F.,, 2015,, 85—91
[3] Ho N. A. D., Leo C. P.,, 2021,, 111100
[4] Batista⁃García R. A., Del Rayo Sánchez⁃Carbente M., Talia P., Jackson S. A., O’Leary N. D., Dobson A.D.W., Folch⁃Mallol J. L.,, 2016,(6), 864—882
[5] Jing Y. X., Zhang Y. Y., Lv Q., Gou Y., Liu X. H., Wang Y. Q.,, 2019,(23), 6236—6240
[6] Arantes V., Saddler J. N.,, 2011,(1), 1—17
[7] Zhao Q., Yam R. C. M., Zhang B., Yang Y. K., Cheng X. J., Li R. K. Y.,, 2009,(2), 217—226
[8] Lindman B., Karlström G., Stigsson L.,, 2010,(1), 76—81
[9] Medronho B., Lindman B.,, 2014,(1), 32—40
[10] Jiang Z. C., Fan J. J., Budarin V. L., Macquarrie D. J., Gao Y., Li T. Z., Hu C. W., Clark J. H.,, 2018,(5), 936—940
[11] Sen S., Martin J. D., Argyropoulos D. S.,, 2013,(8), 858—870
[12] Yu P. R., Hung W. C., Wan H. P.,, 2018,, 193—200
[13] Wang J. H., Cui H. Y., Wang Y., Zhao R. R., Xie Y. J., Wang M., Yi W. M.,, 2020,(13), 4240—4251
[14] Wang J. H., Cui H. Y., Wang J. G., Li Z. H., Wang M., Yi W. M.,, 2021,, 128922
[15] Rodriguez Q. N., Padmanathan A. M. D., Mushrif S. H., Vlachos D. G.,, 2019,(11), 10551—10561
[16] Shen C. P., Hu C. S., Zhang W. W., Lin X. Y., Qi W., Zhang Z., Gu J.,, 2022,(14), 7629—7647
[17] Sadula S., Oesterling O., Nardone A., Dinkelacker B., Saha B.,, 2017,(16), 3888—3898
[18] Rodriguez Quiroz N., Norton A M., Nguyen H., Vasileiadou E., Vlachos D. G., Energy F. R. C. E.,, 2019,(11), 9923—9952
[19] Shrestha R. P., Diyabalanage H. V. K., Semelsberger T. A., Ott K. C., Burrell A. K.,, 2009,(6), 2616—2621
[20] Tao T., Lu S. G., Fan Y., Lei W. W., Huang S. M., Chen Y.,, 2017,(48), 1700542
[21] Gil N., Ferreira S., Amaral M. E., Domingues F. C., Duarte A. P.,, 2010,(1), 29—35
[22] Sabiha⁃Hanim S., Norazlina I., Noraishah A., Suhaila M. H. N.,, 2012,
[23] Bensah E. C., Mensah M.,, 2013,, 1—21
[24] Castro E., Nieves I. U., Mullinnix M. T., Sagues W. J., Hoffman R. W., Fernandez⁃Sandoval M. T., Tian Z.,, 2014,, 76—83
[25] SriBala G., Vinu R.,, 2014,(21), 8714—8725
[26] Li Z. L., Zhang J. Y., Hou B. L., Wang A. Q.,, 2019,(6), 16585
[27] Kanchanalai P., Temani G., Kawajiri Y., Realff M. J.,, 2016,(1), 1672—1689
[28] Zhao H. B., Kwak J. H., Wang Y., Franz J. A., White J. M., Holladay J. E.,, 2006,(2), 807—811
[29] Zhou Z. Y., Liu D. H., Zhao X. B.,, 2021,, 111169
[30] Zainal S. H., Mohd N. H., Suhaili N., Anuar F. H., Lazim A. M., Othaman R.,, 2021,, 935—952
[31] Cai J., Zhang L.,, 2005,(6), 539—548
Glucose Production from CelluloseSelective Hydrolysis in Molten Salt Hydrate
LIANGHaotong, LINJianying, YUANShaomin, MAQiaozhi*
(,,510642,)
To address the challenges of the unclear mechanism of cellulose dissolution and hydrolysis in molten salt hydrate(MSH). This work systematically studied the hydrolysis of cellulose in molten salts hydrate consisting of different cations(., Li+, Na+, K+, Zn2+), and anions(., Cl‒, Br‒and I‒), and screened the best molten salt for cellulose hydrolysis, LiBr, and studied the effect of acidity on cellulose hydrolysis. The result indicated that the limited solubility of the cation Na+and K+resulted in the insufficient coordination between cations and oxygen atoms in the cellulose, which cannot provide sufficient Lewis acidity for glycosidic bonds cleavage. Additionally, the anion Cl‒in MSH has limited electronegativity, which cannot form massive hydrogen bonds with the hydroxyl groups in cellulose, resulting in a limited solubility and thereby caused negative effect on hydrolysis. Under the reaction conditions of 130 ℃ and 5 h in a non-acidified system, cellulose can be selectively hydrolyzed into water-soluble oligosaccharides and glucose with the yield of 57.2% and 29.0%, respectively. The results also show that the MSH can catalyze the cleavage of cellulose glycoside bonds and decrease the cellulose degree of polymerization(DP) in an 0.01%(HCl) dilute acidic MSH at 100 ℃ for 30 min ranging from 4 and 13. Improvement of acidity can enhance the cleavage efficiency of glycosidic bond cleavage. When the acidity increased to 0.1%(HCl), a high yield of glucose at 90.9% can be achieved at 100 ℃ for 30 min.
Cellulose; Glucose; Molten salt hydrate; Hydrolysis; Acid regulation
2023-04-28
马巧智, 女, 博士, 讲师, 主要从事生物质能源化利用研究. E-mail: maqzhi@scau.edu.cn
国家重点研发计划项目(批准号: 2018YFB1501402)、 国家自然科学基金(批准号: 51906072)、 广东省基础与应用基础研究基金(批准号: 2023A1515011661)和广州基础研究计划基础与应用基础研究项目(批准号: 202201010254)资助.
O643
A
10.7503/cjcu20230218
2023-09-01.
Supported by the National Key Research and Development Program, China(No.2018YFB1501402), the National Natural Science Foundation of China(No.51906072), the Guangdong Provincial Basic and Applied Basic Research Fund, China(No.2023A1515011661) and the Guangzhou Basic Research Program, Basic and Applied Research Project, China(No.202201010254).
(Ed.: V, K, S)