颈项透明层增厚胎儿的超声及遗传产前诊断
金 鑫,宋婷婷,王西林,杨 红
(空军军医大学第一附属医院妇产科,西安 710032;*通讯作者,E-mail:yanghong@fmmu.edu.cn)
胎儿颈项透明层(nuchal translucency,NT)为胎儿颈项透明带的最大厚度,是指胎儿的颈部后方皮下组织中淋巴液的空隙部位。既往研究[1,2]表明,NT增厚的胎儿染色体异常的发生率风险增高,NT值是早孕期(孕11~13+6周)进行胎儿超声筛查的重要指标,目前其测定已成为很多产前诊断中心的常规筛查项目之一[3,4]。染色体核型分析目前依然是应用最为广泛的细胞遗传学检测方法,为染色体非整倍体、易位、倒位检测的有效手段,但其分辨率较低,一般仅可检测10 Mb以上的染色体异常。近年来,随着染色体微阵列分析(chromosomal microarray analysis,CMA)在产前诊断中的广泛应用,NT增厚胎儿的染色体异常检出率显著提高,而且胎儿NT增厚除与染色体非整倍体相关外,亦与染色体微缺失/微重复相关[5,6],但先前研究对胎儿NT增厚的遗传学病因的研究尚不充分。在本研究中,我们纳入了181例因胎儿超声单纯NT增厚于我院进行产前诊断的孕妇,联合应用染色体核型分析及染色体微阵列分析技术对其进行遗传学产前诊断,探究其遗传性病因和预后,染色体异常的分布情况,为产前遗传学咨询提供参考。
1 对象与方法
1.1 对象
收集2017年1月至2022年12月在空军军医大学第一附属医院妇产科就诊并接受介入性产前诊断的181例超声检查提示单纯NT增厚胎儿的资料,其中30例孕妇为高龄。孕妇年龄为21~42岁(平均30.5岁)。165例进行羊膜腔穿刺的孕妇孕周为19~20+6周(平均19+5周),16例进行绒毛活检检测的孕妇孕周为11~13+6周(平均12+2周)。所有病例均进行染色体核型分析及CMA,胎儿的父母均于术前进行产前遗传咨询,完善术前相关检查并签署知情同意书。
1.2 方法
1.2.1 NT测量 所有孕妇于孕11~13+6周均进行超声检查测量胎儿NT厚度,参照英国胎儿医学基金会(Fetal Medicine Foundation of the United Kingdom, FMF)制定的标准进行,NT>3.0 mm为增厚[7]。根据NT值的大小对胎儿进行分组:3.0~3.4 mm组(n=73)、3.5~4.4 mm组(n=79)、≥4.5 mm组(n=29)。
1.2.2 绒毛活检/羊膜腔穿刺 常规消毒后超声引导下经腹行绒毛活检或羊膜腔穿刺术,抽取绒毛10~15 mg或抽取羊水30 ml。
1.2.3 染色体核型分析 绒毛/羊水细胞培养、收获、染色体制备及核型分析,按照常规方法进行。
1.2.4 基因组DNA提取及CMA检测 按照Qiagen试剂盒(QIAamp DNA Blood MiniKit)操作说明书进行基因组DNA提取。按照美国Affymetrix公司的CytoScanTM750k芯片检测的标准操作流程进行基因组DNA的消化、扩增、纯化、片段化、标记、杂交、洗涤及扫描,并用ChAS软件对数据进行分析。
1.2.5 CMA结果分析 对包含50个以上连续探针的缺失、重复及10 Mb以上的杂合性缺失(loss of heterozygosity, LOH)片段进行比对分析。通过内部基因芯片数据库及在线公共数据库如Database of Genomic Variants(DGV), Database of Chromosomal Imbalance and Phenotype in Humans using Ensemble Resources(DECIPHER), Online Mendelian Inheri-tance in Man(OMIM), UCSC Genome Browser, ClinGen Dosage Sensitivity Map等数据库判断所检出拷贝数变异(copy number variation, CNVs)的性质。根据美国医学遗传学与基因组学学会(American College of Medical Genetics, ACMG)指南及染色体微阵列分析在产前诊断中的应用(母胎医学协会2016年第41号实践指南)将CNVs分为5类:致病性CNVs(pathogenic CNVs, pCNVs),可能致病性CNVs(likely pathogenic CNVs, lpCNVs),临床意义不明的CNVs(variants of unknown significance, VOUS),可能良性CNVs(likely benign CNVs, lbCNVs),良性CNVs(benign CNVs, bCNVs)[8,9],此外片段>10 Mb LOH为意义不明确(variants of unknown significance, VOUS)变异,需结合患者临床表现、文献报道及其他技术方法方可明确该LOH是否有临床意义。
1.2.6 随访 对所有就诊病例均进行电话随访,了解妊娠结局以及新生儿的生长发育情况等信息。
1.2.7 统计学分析 用SPSS 28.0软件进行数据分析,用χ2检验比较不同组间的差异,P<0.05提示差异有统计学意义。
2 结果
2.1 染色体核型分析及CMA检测结果
在181例NT增厚的胎儿中,共检出致病性异常28例,检出率为15.47%(28/181),其中30例NT增厚合并高龄的异常率为36.67%(11/30);非高龄组单纯NT增厚胎儿中致病性染色体异常率为11.26%(17/151),高龄组NT增厚胎儿中的染色体异常率显著高于非高龄组的(P<0.01)。165例为羊水样本,检出致病性染色体异常24例,检出率为14.55%(24/165);16例为绒毛样本,检出致病性染色体异常4例,检出率为25.00%(4/16)。染色体核型分析检出染色体异常25例,其中23例为染色体非整倍体;1例结合CMA明确18号染色体18p11.32p11.21约15 Mb的缺失,1例结合CMA明确Y染色体部分重复及部分缺失,Yp11.2q11.222区域约14.7 Mb重复合并Yq11.222q12区域约8.8 Mb缺失。CMA亦检出染色体非整倍体23例,与染色体核型分析一致,检出拷贝数变异5例,CMA较核型分析额外检出3例微缺失病例,X染色体Xp21.1区域约93 kb的缺失,Y染色体Yq11.223q11.23区域约3.7 Mb的缺失,1号染色体1p36.22约1.49 Mb的缺失,CMA检出的拷贝数变异具体断裂点位置见表1。

表1 5例携带致病性拷贝数变异胎儿的临床资料及CMA检测结果
2.2 NT增厚胎儿染色体异常类型及分布
在28例染色体异常中,染色体非整倍体23例,其中以21三体为主,检出率为8.29%(15/181),占异常构成比53.57%(15/28);18三体综合征与Turner’s综合征的检出率均为2.21%(4/181),占异常构成比14.29%(4/28);染色体拷贝数变异即微缺失与微重复检出率为2.76%(5/181),占异常构成比17.86%(5/28)(见表2)。
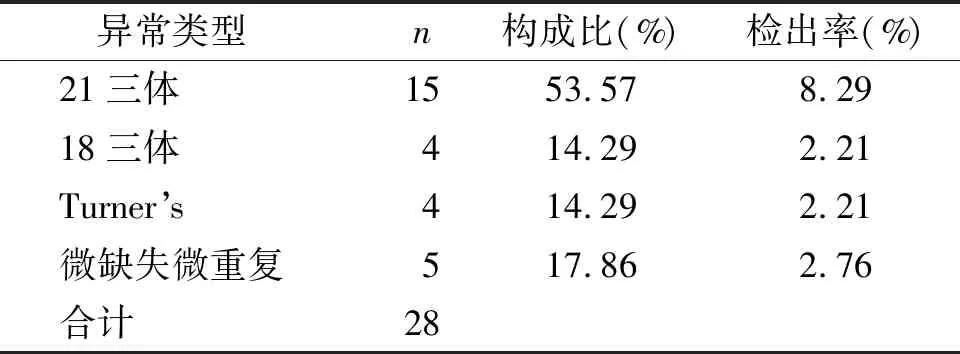
表2 181例NT增厚胎儿检出染色体异常的类型及分布
2.3 超声检查不同NT值与染色体异常相关性
超声提示NT增厚且未合并其他超声异常的181例胎儿中,NT介于3.0~3.4 mm之间73例,致病性染色体异常率为9.59%(7/73);3.5~4.4 mm 79例,致病性染色体异常检出率为16.46%(13/79);≥4.5 mm 29例,致病性染色体异常检出率为27.59%(8/29)(见表3)。应用趋势卡方检验比较不同NT厚度的胎儿染色体异常发生率,差异具有统计学意义(χ2=82.253,P=0.000)。

表3 不同NT厚度的胎儿遗传学检测结果 例(%)
2.4 随访结果
本研究中检出的28例致病异常胎儿25例终止妊娠,2例失访,1例Turner’s综合征患儿出生;3例可能致病性异常胎儿中1例终止妊娠,1例出生10 d后夭折,1例出生6月内未见明显异常;4例意义不明确的病例中1例引产,3例出生后6月内未见明显异常;146例CMA及核型分析未检出异常的胎儿中30例失访,随访到116例,3例引产,2例早产,其余胎儿出生后未见明显异常。
3 讨论
NT值是胎儿颈后皮下积液的超声临床表现,出现在胚胎发育的第10~14周,最早于1992年Nicolaides等[10]提出NT增厚与染色体异常有一定的相关性,近年来越来越多的研究发现NT增厚与染色体异常密切相关,且主要与染色体非整倍体相关,最常见的异常有21三体、18三体及性染色体异常[11]。亦有研究报道显示NT增厚与拷贝数变异有一定的相关性[12],本研究联合应用染色体核型分析及CMA检测探讨超声单纯NT值增厚与染色体的相关性,明确非整倍体及拷贝数异常。本研究中,单纯NT异常胎儿致病性染色体异常检出率为11.26%,NT增厚合并高龄的致病性异常检出率为26.67%,略低于王游声等[13]报道的单纯NT增厚胎儿染色体异常率(14.92%)及NT增厚合并高龄的染色体异常率(45.71%),这可能与研究对象选取的孕妇产前诊断指征及样本量有关。本研究显示NT增厚胎儿中,21三体最为常见,与先前研究报道一致。此外,本研究分析的181例超声检查发现的NT增厚胎儿16例于孕11~13+6周进行绒毛活检,检出4例染色体非整倍体,异常检出率约为25.00%(4/16),其中21三体2例,18三体1例,Turner’s综合征1例,遗传咨询后,21、18三体孕妇终止妊娠,胎儿为Turner’s综合征的孕妇选择继续妊娠,足月剖宫产一女,产后6月内未见明显异常。NT值增厚与染色体异常明确相关,进行介入性产前诊断非常必要,由于NT超声检查需在11~13+6周做,与绒毛活检取样时间一致,且与羊膜腔穿刺相比,并未明显增加胎儿丢失率,因此对NT值增厚的胎儿,绒毛活检有一定的优势,若胎儿存在染色体异常,即可在孕早期选择终止妊娠,尽可能减少对孕妇的伤害,绒毛活检可作为早期介入性产前诊断筛查染色体异常的重要指标之一,有效减少染色体异常患儿的出生。
胎儿NT值增厚除与21三体、18三体等染色体非整倍体外,还与染色体微缺失微重复有一定的相关性。相关研究报道显示有超过50种与NT增厚相关的遗传病,如22q11.21微缺失综合征、Williams-Beuren综合征、Wolf-Hirschhorn综合征等[14,15]。本研究检出1例18p缺失综合征,亦有其他研究NT增厚胎儿为18p综合征的报道[16],18p缺失综合征的患者临床表现多样,包括身材矮小、轻中度精神阻滞、智力偏低、颅面部异常、运动障碍、先天性心脏病等;1例Y染色体复杂异常,为Y染色体部分区域重复合并部分区域缺失,文献报道[17]显示包含SRY基因的重复区域可能有性反转的表现,Yq11.222q12区域缺失的男性患者可能有严重少弱精症的临床表现;1例Y染色体Yq11.223q11.23区域约3.7 Mb缺失;1例1号染色体1p36.22区域约1.49 Mb缺失,该区域缺失较为罕见,包含CASZ1,TARDBP,MASP2等24个OMIM基因,患者可能有肌张力低,举止异常、发育迟缓等临床表现;1例X染色体Xp21.1区域约93 kb缺失,该区域缺失范围较小,但该区域涉及DMD基因的第49,50号外显子,该基因部分外显子缺失可导致杜氏进行性肌营养不良症(Duchenne muscular dystrophy, DMD)或贝氏进行性肌营养不良(Becker muscular dystrophy, BMD),为X连锁隐性遗传病,患者大多数为男性,DMD在活产男婴中发病率约为1/3 500,患者多于3~5岁发病,6岁后出现行走困难,12岁前丧失行走能力,30岁左右死于心肺衰竭[18],该病例为CMA检测的意外发现,CMA可检测出由大片段缺失所导致的单基因病。本研究中检出的染色体异常胎儿中,除1例Turner’s综合征胎儿足月出生、3例失访外,其余均于遗传咨询后决定终止妊娠,有效降低出生缺陷。
除致病性染色体异常外,本研究亦在NT增厚胎儿中检出3例可能致病性变异及4例意义不明确的变异,为遗传咨询带来巨大的挑战。可能致病的染色体变异中,1例为2号染色体2q13q14.1区域约1.72 Mb重复,2例为15号染色体15q11.2区域约518 kb的重复。2号染色体2q13q14.1区域有约1.72 Mb的重复,该区域重复较为罕见,涉及BUB1,BCL2L11,ANAPC1等7个OMIM基因,Decipher、ISCA、NCBI等数据库既有该区域可能致病的报道,亦有意义不明确的报道[19,20],ClinGen数据库显示部分证据支持该区域存在3倍剂量敏感致病性(3倍剂量敏感性评分为“2”),但该区域重复具有不完全外显率,患者可能无明显的临床表现,也可能有特殊面容、发育迟缓、注意力不集中多动症、肌张力低等临床表现,夫妻双方进行遗传咨询后终止妊娠。15q11.2的重复较为常见,为包含15号染色体BP1~BP2的拷贝数变异,涉及TUBGCP5,CYFIP1,NIPA2,NIPA1共4个OMIM基因,数据库及文献报道显示该区域重复可能与发育迟缓、语言表达能力差、注意力不集中多动症、肌张力低等有一定的相关性[21,22],但具有不完全外显率,且外显率较低,多数患者无明显临床表现。本研究中的2例15q11.2重复病例中,1例出生后6月内未见明显异常,1例伴有心脏畸形,出生10 d后夭折,但此例夭折病例与15q11.2理论上无相关性,可能存在其他相关基因异常。意义不明确的病例中1例为20号染色体20q11.21q13.12区域13.97 Mb的杂合性缺失,涉及NNAT,BLCAP及L3MBTL1父源表达的印迹基因,20号染色体母源单亲二倍体的患者可能有产前及产后生长发育迟缓,产后喂养困难等临床表现[23],由于CMA尚不能明确该杂合性缺失的来源,临床意义尚不明确,但夫妻双方结合超声检查情况进行遗传咨询后终止妊娠。本研究检出的其余意义不明确病例均出生,随访知出生后未见明显异常。因此,对于CMA检出的可能致病及意义不明确变异需详尽的临床遗传咨询,充分了解胎儿出生后可能存在的异常及异常发生率,减少孕妇及家属的焦虑。
本研究亦分析了不同NT值大小与染色体异常的相关性,发现随着NT值的增高,染色体异常风险显著增加,NT值大于4.5 mm时,致病性染色体异常率高达27.59%,这与文献报道基本一致[24]。
本研究联合CMA与染色体核型分析明确NT增厚与染色体非整倍体及拷贝数变异的相关性,丰富了NT增厚胎儿染色体异常类型分布谱系,为产前遗传咨询提供更多的信息。NT增厚胎儿进行绒毛活检检测,能早期发现染色体异常,可作为早期介入性产前诊断筛查染色体异常的重要指标之一,有效减少染色体异常患儿的出生。除染色体非整倍体外,CMA较染色体核型分析能检出更多的染色体结构异常,且能够明确染色体断裂点的具体位置及异常区域所包含的基因,有助于精准判断胎儿的预后及出生后可能的临床表现,为临床遗传咨询提供准确的数据支撑,有效降低出生缺陷率。

