室间隔缺损合并缺陷乏养菌致感染性心内膜炎
——附1 例报告
郑双林 马芳芳 王莹莹 谢华斌
缺陷乏养菌(Abiotrophia defectiva)是一种营养变异型链球菌(nutritionally variantstreptococci,NVS),属于革兰阳性球菌,是存在于人体口腔、消化道、泌尿道中的正常菌群[1]。既往感染性心内膜炎(infective endocarditis,IE)史、心脏病史以及机械瓣膜置换均为感染该菌的重要危险因素,当患者免疫力低下时,定植于呼吸道、消化道的缺陷乏养菌可经血行途径引起菌血症、IE 以及中枢神经系统感染[2]。有研究结果显示,缺陷乏养菌占所有链球菌致IE 病例的4.3%~6.0%[3]。室间隔缺损是一种常见的先天性心脏病,分为膜周型、干下型和肌型,是罹患IE 的危险因素之一,患者常需在体外循环下行室间隔缺损修补术治疗[4]。本研究从1 例室间隔缺损伴IE 患者的外周静脉血及赘生物标本培养分离出缺陷乏养菌,回顾并分析该患者的临床资料,同时收集国内外相关文献,以期了解缺陷乏养菌的相关特性,为室间隔缺损合并缺陷乏养菌致IE 的诊断与治疗提供依据,现将结果报告如下。
1 临床资料
患者女性,54 岁,以“反复胸痛3 年,再发1 个月余”于2021 年10 月12 日入住本院。患者1 个多月前出现胸痛症状,就诊于当地医院,心脏彩超提示“先天性心脏病,室间隔缺损,缺损右室面赘生物形成”,多次血培养提示缺陷乏氧菌,考虑IE,予以“青霉素静脉滴注,1 200 万U,每日1 次”治疗1 个月,5 d 前复查心脏彩超提示赘生物消失,建议上级医院评估室间隔缺损手术治疗,遂就诊本院,门诊以“IE、先天性心脏病:室间隔缺损”收治入院。
入院查体:体温36.6 ℃,脉搏83 次/min,呼吸频率20 次/min,血压119/73 mmHg(1 mmHg≈0.133 kPa),意识清楚,双肺呼吸音清晰,心律齐,胸骨左缘第3~5 肋间可闻及3/6 级收缩期杂音;腹平坦,无压痛及反跳痛,双下肢无水肿。2021 年10 月12 日心脏彩超示:室间隔缺损(干下型,少量左向右分流),2021 年10 月15 日经食道超声心动图示为室间隔缺损(干下型,少量左向右分流),肺动脉瓣上可见长约12.7 mm 的赘生物(图1A)。患者住院期间的主要实验室检验结果见表1。

表1 1 例室间隔缺损合并缺陷乏养菌致感染性心内膜炎患者住院期间的部分检验指标
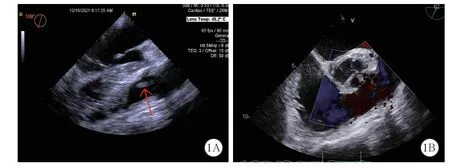
图1 1 例室间隔缺损合并缺陷乏养菌致感染性心内膜炎患者术前(1A)及术后(1B)经食道超声心动图
入院当天,根据患者临床症状、彩超结果以及外院就诊史,立即采集4 份血样进行培养,19 h 后皆报告为阳性,细菌鉴定提示为缺陷乏养菌。考虑当地医院青霉素治疗方案不规范,同时食道超声心动图提示赘生物形成,表明IE 尚未完全控制,调整抗菌药物方案为头孢曲松(2 g,每日1 次)+庆大霉素2 mg·kg-1·d-1(53 kg,100 mg,每日1 次)。患者反复胸痛3 年,完善冠状动脉造影,排除冠心病,同时心功能分级为Ⅲ级。患者未见绝对手术禁忌证,于2021 年10 月20 日在全麻体外循环下行“室间隔缺损修补术+赘生物摘除术”。术中可见右心室增大,右心室流出道表面震颤,室间隔缺损位于干下,约10 mm×10 mm,肺动脉瓣上可见长约13 mm的条形赘生物。手术过程顺利,术后给予强心、利尿、止血、抗感染治疗。将术中切除的赘生物组织送检微生物培养,2 d 后结果回报检出缺陷乏养菌。
患者术后多次复查感染指标见表1,相关炎症指标水平逐步下降,于10 月20 日、11 月6 日、11 月12 日送检血培养,结果均为阴性,提示抗感染治疗有效。术后复查经食道超声心动图示:室间隔缺损修补术后,心室水平未见明显残余分流(图1B)。10 月21 日、10 月25 日、11 月01 日、11 月11 日复查心脏彩超均提示为室间隔缺损修补术后未见明显异常。术后4 周抗感染治疗期间,给予营养支持、强心、利尿等对症支持治疗,患者恢复效果佳,复查结果满意,于2021 年11 月12 日出院,嘱注意休息、保暖、优质蛋白饮食,出院后定期复查。患者出院后1 周、2 周、1 月常规门诊复查,情况良好,未复发。
2 血液与赘生物细菌培养及鉴定
临床怀疑IE,分别从患者双侧肘静脉采集血培养标本,每瓶约10 mL,置于培养仪培养,连续自动监测,当厌氧瓶、需氧瓶报告为阳性后,进行涂片和革兰染色,显微镜下可见革兰阳性链球菌。同时在血平板、巧克力平板接种传代,置于35 ℃,5% CO2培养箱培养。24 h 后血平板菌落生长不良,巧克力平板未见细菌生长。继续培养48 h后,血平板可见少量细小、灰白、不溶血的菌落生长,涂片镜检为革兰阳性球菌,呈链状排列。术中送检的赘生物组织培养前经彻底研磨,使其匀浆化,将研磨液接种于血平板和血培养瓶中,后续处理同上。
同时从血培养及赘生物培养所得菌落中挑取单个菌落,涂满血平板后在3 个不同角落点种金黄色葡萄球菌ATCC25923。培养24 h 后,可见靠近金黄色葡萄球菌的区域有细小、灰白的菌落,而远离金黄色葡萄球菌的菌落生长不明显,为赘生物所培养出菌落的“卫星现象”(图2C)。最后挑取单个菌落进行质谱分析,鉴定结果皆为缺陷乏养菌,因目前的体外药敏试验不可靠,未进行药敏分析。
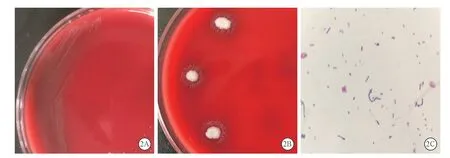
图2 1 例室间隔缺损合并缺陷乏养菌致感染性心内膜炎患者缺陷乏养菌培养48 h 形态
3 讨论
缺陷乏养菌主要定植于健康人群口腔中,但也可存在于肠道和泌尿生殖系统中,大部分通过血流途径进入体内[5]。日益增加的感染缺陷乏养菌的病例报道显示,快速明确病原菌有利于及早治疗缺陷乏养菌致IE 以及预防相关并发症的发生。目前临床诊断IE 主要以血培养结果为依据,但该方法阳性率低、培养周期长。术中心脏赘生物的病理检查及病原菌培养结果是诊断的“金标准”,但赘生物标本来源珍贵,不适用于每个患者,因此需要与血培养相互补充与验证。由于赘生物形成过程特殊,病原体不附着于其表面,而是包裹在赘生物深部,因此培养前需将赘生物制备成均质组织,而均质组织能破坏内部组织结构,使赘生物深部的病原体得以释放,从而提高赘生物的阳性率。本例患者自身基础情况尚可,适宜手术干预,且获取的赘生物标本和血培养结果均提示为缺陷乏养菌,因此高度怀疑该菌为致患者IE 的病原菌。
1961 年,Frenkel 和Hirsch 首次在IE 患者的血培养的样本分离出一种呈“卫星现象”生长的特殊草绿色链球菌,并将其命名为营养变异型链球菌[6]。该变异型链球菌经过16S rRNA 基因测序分析,显示其与其他链球菌的相似度低,故将其从链球菌属中独立出来,分为乏养菌属和颗粒链球菌属,目前乏养菌属仅发现缺陷乏养菌一个菌种[1,7]。而质谱仪的出现大大缩短了缺陷乏养菌的鉴定时间,有研究以16S rRNA 测序为标准,验证了质谱仪鉴定营养变异型细菌的性能,鉴定结果全部正确[8],而本病例分离出的菌株通过质谱仪鉴定,结果显示,与对照数据库比较符合率高,可信度较高。
缺陷乏养菌感染引起IE 的病例较为少见,部分心内膜炎患者培养结果常为阴性,由于命名法的改变以及获得阳性培养样本的困难,缺陷乏养菌致IE 的发生频率难以准确估计[9]。研究表明,缺陷乏养菌对心内膜的亲和力较高,这是由于其所产生的大量胞外多糖易与细胞外基质中的纤连蛋白结合,从而利于毒力扩散[10]。既往瓣膜性心脏病或其他心脏疾病常与缺陷乏养菌诱导的心内膜炎有关,由于心脏结构异常引起血液的强力喷射和涡流,损伤心内膜组织,促进该菌的吸附和大量繁殖,使患者发生充血性心力衰竭和需要手术干预的频率增高[11]。除心内膜炎外,缺陷乏养菌感染还与内膜脊髓炎、脑脓肿、脑膜炎和脓毒性关节炎有关[10]。本例患者有室间隔缺损的先天性心脏病,是感染缺陷乏养菌的重要危险因素,考虑因机体免疫功能低下,细菌侵入心脏内膜,在肺动脉瓣膜沉积、繁殖并形成赘生物,造成瓣膜组织损伤。结合患者治疗过程中的临床症状、心脏彩超以及脑钠肽的检查结果,判定为IE 相关瓣膜病心功能不全并发症。
严格的营养要求和缓慢的生长特性阻碍了缺陷乏养菌的最佳微生物鉴定时间。特殊的营养要求使缺陷乏养菌的培养需在富含维生素B6 和L-半胱氨酸的培养基中进行,若不添加营养补充剂,将在金黄色葡萄球菌或表皮葡萄球菌附近呈“卫星现象”生长[12]。对革兰染色不定或生长缓慢的乏氧菌,卫星试验对后续鉴定有重要的指导意义。与其他链球菌相比,缺陷乏养菌的生长周期更长,菌落呈白灰色,为非溶血性,本病例中的菌种为革兰阳性苛氧菌,呈链状排列,染色结果常不确定,在不同营养条件下菌体表现为多形性,可呈球状或球杆状[13]。
缺陷乏养菌引起的心内膜炎往往治疗进程缓慢,由于频繁的血管栓塞发生和瓣膜组织破坏,相较于其它链球菌引起的心内膜炎发病率和病死率更高[14]。由于其特殊的生长特性,目前对缺陷乏养菌药敏试验没有统一的检验标准,阻碍了临床决定抗菌药物治疗方案,研究数据表明,缺陷乏养菌感染致IE 的治疗失败率高达41%[11]。缺陷乏养菌对青霉素有着明显的耐药性,其最低杀菌浓度超过最低抑菌浓度的32 倍[12]。分析原因可能为在营养条件或高渗介质中暴露于青霉素或分解酶时,缺陷乏养菌会失去部分或全部细胞壁从而成为L 型细菌,使相关靶向细胞壁的抗菌药物失效[10]。根据美国心脏协会(American Heart Association,AHA)指南建议,缺陷乏养菌性心内膜炎与肠球菌性心内膜炎治疗方案相同,可联合使用氨苄青霉素或苄青霉素+庆大霉素4~6 周,在青霉素过敏时,可单独使用万古霉素[11,15]。缺陷乏氧菌对青霉素敏感率仅为10.8%,且对万古霉素和头孢曲松更敏感,对氨基糖苷类具有耐药性,少数菌落对左氧氟沙星、红霉素和克林霉素具有耐药性。当缺陷乏氧菌对青霉素耐药时,头孢曲松联合庆大霉素为可选择的抗感染治疗方案[15]。本例患者入院前已在当地医院使用青霉素1 个月,入院后血培养仍为阳性,病原菌尚未彻底清除,考虑到青霉素的耐药率较高,将治疗方案调整为头孢曲松联合庆大霉素。尽管抗菌药物可明显降低IE 的病死率,但当心脏瓣膜结构受到破坏而出现严重并发症导致抗感染治疗无效时,手术具有关键作用[16]。根据AHA 关于心脏瓣膜的治疗指南,该患者虽然心脏瓣膜结构未遭到严重破坏,但是存在室间隔缺损,出现心力衰竭症状,故适用于手术干预[15]。目前关于缺陷乏养菌感染的临床数据不足,尚无统一的抗菌治疗标准,临床上如果遇见类似致病菌不明的病例,可先经验性用药,主要选择针对葡萄球菌属或链球菌属的抗菌药物,再根据细菌鉴定和药敏结果调整用药方案[16]。
综上所述,正常菌群可在免疫力低下时成为致病菌,本例患者存在室间隔缺损危险因素时,由缺陷乏养菌引起了IE,该患者同时接受了抗感染治疗和心脏手术,最终痊愈出院。对不明原因发热的患者,若有先天性心脏病,需要考虑IE 的可能。正确识别特殊的病原体,并予以通过规范合理的治疗是改善IE 患者的预后的关键。
利益冲突所有作者均声明不存在利益冲突

