分泌超高血清甲胎蛋白的胃肝样腺癌1例
王承霞,夏雷,王晓,莫冬萍
作者单位:江苏省肿瘤医院、南京医科大学附属肿瘤医院、江苏省肿瘤防治研究所,a检验科,b病理科,cCT室,江苏 南京210009
胃癌是常见的消化系统恶性肿瘤之一,发病率和病死率均居前列[1]。而胃肝样腺癌(HAS),是胃癌中特殊且少见的类型,发病率极低,仅为0.3%~1.0%[2]。HAS在组织形态学上同时具有腺癌和肝细胞样分化特征,由日本学者于1986年报告而得名[3]。HAS主要好发于中老年男性,临床表现无特异性,与普通胃癌相比,恶性程度高,早期常伴有淋巴结及肝脏转移,预后极差。本研究报告1例分泌超高血清甲胎蛋白(AFP)的胃肝样腺癌老年病人。
1 资料与方法
1.1 一般资料 男,70岁,因“发现胃小弯部腺癌1周”于2021年10月22日入江苏省肿瘤医院。2021年10月14日病人出现心悸头晕,伴恶心,无呕吐、腹痛、腹胀等不适,后解黑便两次,遂到当地医院,行胃镜检查提示:胃小弯侧见巨大溃疡,延及胃角及部分体小弯。病理提示“胃小弯”腺癌,Lauren分型:混合型。颅脑+全腹部CT检查提示:两侧基地节区、侧脑室旁腔隙性梗死及缺血灶。老年性脑改变,透明隔腔增宽。胃窦胃壁不规则增厚,肝胃间隙及腹膜后多发肿大淋巴结,考虑转移,AFP>1 000 μg/L。门诊拟“胃癌”收住入院。病人或其近亲属知情同意,本研究符合《世界医学协会赫尔辛基宣言》相关要求。
1.2 家族史、既往史 病人无肿瘤家族史,既往无肝炎、肝硬化病史,因消化道出血,有输血史,嗜烟嗜酒50余年,发病以来,病人一般状态良好,饮食正常,大小便正常,睡眠正常,体质量无变化。
1.3 诊疗经过
1.3.1 诊断依据 入院完善相关检查,血常规结果提示:白细胞计数6.55×109/L,血红蛋白91 g/L,红细胞计数3.52×1012/L;肝癌三项结果提示:AFP为9 950 μg/L,甲胎蛋白异质体(AFP-L3)为1 290 μg/L,AFP-L3%为12.96%,异常凝血酶原(DCP)为215.9 μg/L;其他肿瘤指标、甲状腺功能、凝血常规未见明显异常;肝功能指标正常;肝炎标志物阴性。会诊外院病理片示,窦小弯活检:浸润性癌,倾向腺癌;胃活检免疫组化结果:神经细胞黏附分子CD56-,嗜铬素A少量+,突触素Syn(-),人表皮生长因子受体2(Her-2)(-),上皮性钙黏附蛋白(E-cad)+++,程序性死亡配体-1(PD-L1)(NXR003)联合阳性评分(combined positive score,CPS)评分=10,胸苷酸合成酶(TS)+20%,程序性死亡分子-1(PD-1)(-),人胸腺嘧啶核苷磷酸化酶(TP)+10%,增殖指数(Ki-67)+++90%,抑癌基因P53错义突变型,错配修复基因PMS2+,错配修复基因MSH2+,错配修复基因MSH6+,错配修复基因MLH1+。诊断:胃活检为低分化腺癌(图1)。上腹部MR平扫+增强:胃窦癌侵犯胃壁全层,伴腹腔多发淋巴结肿大及稍肿大;右肾囊肿;腹膜后小淋巴结;余上腹部未见明显占位征象(图2)。会诊外院CT片示:胃窦、胃小弯侧胃壁增厚强化,符合癌征象,伴浆膜面及周围脂肪间隙受侵,瘤旁、肝胃韧带间、胰腺周围、腹腔干旁多发淋巴结转移。根据病史、病理、影像学检查,该病人确诊为:胃恶性肿瘤,腺癌,美国东部肿瘤协作组(ECOG):1分,cTNM:TxN2M0。

图1 胃活检免疫组织化学染色结果(×200)
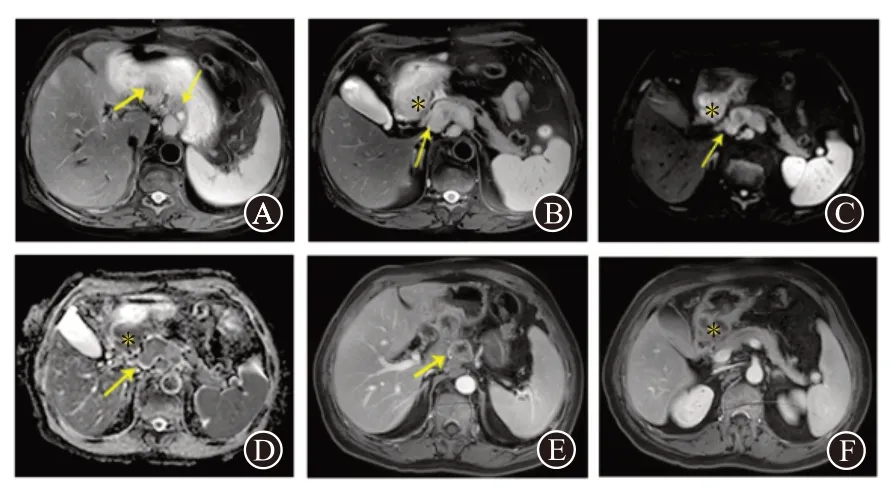
图2 胃肝样腺癌1例磁共振成像影像学检查结果:A为T2WI示肿大淋巴结呈高信号;B为T2WI示病灶及肿大淋巴结呈高信号;C为病灶处DWI呈高信号;D为ADC呈低信号;E~F为磁共振成像增强,胃窦胃壁明显不规则增厚伴强化
1.3.2 治疗过程 病人局部多发淋巴结转移,建议行转化治疗。考虑病人高龄,且有消化道出血风险,暂不考虑三药联合和需要使用激素的紫杉类药物,且病人拒绝深静脉置管,与病人家属沟通后,拟行SOX(第1天给予奥沙利铂225 mg治疗+第1~14天给予替吉奥60 mg治疗,1天2次,)方案化疗,于2021年10月26日进行首次化疗,化疗过程顺利,耐受可。2021年11月16日复诊,肝癌三项提示:AFP为14 048 μg/L,AFP-L3为2 234 μg/L,AFP-L3%为15.90%,DCP为17.30 μg/L,第2天予SOX方案化疗。3周后(12月8日)复诊血常规:白细胞计数4.62×109/L,血红蛋白86 g/L,红细胞计数3.63×1012/L;肝癌三项:AFP为10 650 μg/L,AFP-L3为1 555 μg/L,AFPL3%为14.60%,DCP为40.03 μg/L;其他指标无明显异常。复查CT:胃角及胃窦部仍见病灶,腹腔多发肿大淋巴结;肝、胰、脾、左肾未见明显占位(图3)。建议加用免疫治疗。12月10日予SOX方案第3次化疗。化疗后19 d(12月29日)血常规:白细胞计数3.94×109/L,血红蛋白93 g/L,红细胞计数3.72×1012/L;肝癌三项:AFP为16 375 μg/L,AFP-L3为2 541 μg/L,AFP-L3%为15.51%,DCP为35.76 μg/L。免疫组织化学:PD-L1(NXR003)CPS评分=10,再次建议加用免疫治疗。于2021年12月31日,SOX化疗方案(前1天给予信迪利单抗200 mg免疫治疗+第1天给予奥沙利铂225 mg治疗+第1~14天给予替吉奥60 mg治疗,1天2次)方案化疗,化疗过程顺利。

图3 胃肝样腺癌1例腹部增强CT检查结果:A为CT增强轴位示肝胃间隙肿大淋巴结;B为CT增强轴位示胃窦部病灶
2 结果
该病人从2021年10月22日入院至12月29日经过肿瘤化学治疗3个周期,AFP以及AFP-L3仍然居高不下,结合MRI和CT报告,未见肝区占位征象,在排除胃癌及肝癌双原发癌的可能,进一步对胃病理切片进行免疫组化检测,结果显示:人类婆罗双树样基因(SALL4)(+++),磷脂酰肌醇蛋白聚糖(GPC3)(+++),共同型急性淋巴细胞白血病抗原(CD10)(散+),尾型同源盒基因(CDX-2)(-),AFP(散+),符合肝样腺癌(图4),故考虑该病人为HAS。HAS的治疗目前暂无统一的标准,且与胃腺癌伴或不伴肝转移的治疗并无明显区别[4]。该病人在接受免疫治疗后,于2022年1月17日复诊,肝癌三项提示:AFP为8 026 μg/L,AFP-L3为1 470 μg/L,AFPL3%为18.32%,其他指标无明显异常。化疗后复查CT示:胃角胃窦病灶较前稍退缩,腹腔及腹膜后多发肿大淋巴结较前缩小不明显,肝、胰、脾、左肾未见明显占位。于2022年1月20日,2月25日继续(前1天给予信迪利单抗200 mg免疫治疗+第1天给予奥沙利铂225 mg治疗+第1~14天给予替吉奥60 mg治疗,1天2次)方案化疗,化疗过程顺利。于3月22日,AFP降至157 μg/L。

图4 胃病理组织免疫组织化学染色结果(×200):4A为肿瘤呈SALL4阳性反应;4B为肿瘤呈GPC3阳性反应;4C为肿瘤呈CD10阳性反应;4D为肿瘤呈AFP阳性反应
3 讨论
HAS是临床上一种非常罕见[5],但恶性程度很高的胃部肿瘤[6],70%~80%的病人AFP升高,可发生于胸腺、胃、胰腺、肺、子宫、膀胱等器官,其中最常见的部位是胃。HAS好发于老年男性,原发灶多位于胃窦部,其次是胃体部,贲门部少见,胃镜下以溃疡型病变为主[7],侵袭性极强,病人易出现肝脏和淋巴结的转移,预后极差,出现死亡的概率相对较高[8-10]。有学者对328例HAS病人回顾性分析发现,45.6%的病人是胃窦部病变,男性占77.0%,80.6%的病人血清AFP水平升高,69.6%血管侵犯,78.4%和36.9%病人出现淋巴结转移和术前远处转移,5年无病生存期DFS和疾病特异性生存期DSS分别是20.7%和29.2%,与普通胃癌相比,HAS表现出明显的临床病理学特征和更差的预后[7,11]。
3.1 诊断和鉴别诊断 本例病人为HAS的好发人群,以非特异性消化道症状为主要表现,病变发生在HAS好发部位胃窦部,胃镜见胃小弯侧巨大溃疡,延及胃角及部分体小弯,胃活检提示低分化腺癌;上腹部MR平扫+增强提示胃窦癌侵犯胃壁全层,伴腹腔多发淋巴结肿大及稍肿大,腹膜后小淋巴结;全腹部增强CT提示胃角及胃窦部见病灶,腹腔多发肿大淋巴结;初步诊断为“胃恶性肿瘤,腺癌,ECOG;1分,cTNM:TxN2M0”。考虑该病人自身条件,先进行SOX化疗方案3个周期,但是血清AFP(>1 000 μg/L)浓度居高不下,引起我们关注,排除胃癌及肝癌双原发癌的可能性,对胃病理组织进行免疫组化检测,结果示:SALL4(+++),GPC3(+++),CD10(散+),CDX-2(-),AFP(散+),符合肝样腺癌。HAS临床表现不具有特异性,血清AFP增高是特征性表现,但并不是所有HAS均有此表现。病理活检是HAS诊断的金标准,在病理切片中必须有胃腺癌分化区及肝细胞癌样分化区两个区域,二者之间相互移行过渡;肝转移病灶排除原发性肝癌;免疫组织化学染色可在肿瘤细胞内可以检测到AFP、肝细胞抗原1(Hep Par1)、SALL4、α1-抗胰蛋白酶(α-1-AAT)、α1抗糜蛋白酶(α-1-ACT)和GPC3等[12]。除了与普通胃癌肝转移相鉴别,更重要的是与产甲胎蛋白胃癌(AFPGC)的鉴别。AFPGC定义为血清AFP>20 μg/L或者免疫组化AFP阳性的胃癌。AFPGC镜下表现至少包含3种不同形态的病理类型,包括肝样,分化形态类似于HCC(55.6%~77.8%),胚胎性或卵黄囊来源的肿瘤类型(4.4%~11.1%)和胚胎胃肠型(11.1%~26.7%),其生存期比HAS病人长[7,13]。
3.2 免疫联合化疗 HAS的早期诊断及根治性手术切除是目前唯一治愈病人的手段。但是,HAS恶性程度高,早期容易发生转移,部分病人在确诊时已经失去手术机会,预后极差。Gaeta等[14]报道1例在幽门前区患有息肉样肿块的老年病人,通过免疫组化发现AFP、α-1-AAT、α-1-ACT以及Hep Par1为强阳性最终确诊为胃肝样腺癌,对早期发现和治疗,延长病人生存时间具有重要意义。本例病人经过单纯化疗第4、5周期加用信迪利单抗免疫治疗后,血清AFP浓度有所下降,胃角胃窦病灶较前稍退缩,腹腔及腹膜后多发肿大淋巴结较前缩小不明显,肝、胰、脾、左肾未见明显占位。在信迪利单抗免疫联合治疗第3个周期后,AFP降至157 μg/L。信迪利单抗是重组全人源免疫球蛋白G型抗PD-1单克隆抗体,通过结合PD-1并阻断PD-1与PD-L1和PD-L2的结合,解除免疫抑制效应,激活T细胞功能,增强T细胞对肿瘤细胞的免疫监视能力和杀伤能力,进而产生肿瘤免疫应答[15-16]。研究发现,以PD-1/PD-L1为代表的免疫检查点抑制药联合化疗在治疗非小细胞肺癌、食管癌、宫颈癌等方面疗效显著,PD-L1 CPS≥5病人免疫联合化疗对比单纯化疗死亡风险降低30%,2年总生存期提高12%[17]。本例老年病人PD-L1 CPS=10,接受信迪利单抗联合化疗药物治疗耐受可,疗效稳定,血清AFP浓度明显下降。在一项随机、双盲探索信迪利单抗联合化疗对比化疗一线治疗晚期胃/胃食管接合部腺癌的研究[18]中发现,在全人群和PD-L1 CPS≥5的病人中,与化疗比较,信迪利单抗联合化疗表现出总生存期和无进展生存期获益。
综上所述,本例病人在后续的治疗过程中,除了常规监测血清AFP外,同时定期复查腹部磁共振成像或CT,条件允许下尽快进行根治性手术切除,防止发生肝转移。临床诊疗过程中出现老年男性不典型上腹部不适,胃镜及影像学出现胃部肿物、溃疡、淋巴结转移,同时出现无法解释的AFP异常升高,应该考虑HAS的可能,尽早行组织病理检查进行免疫组化染色,避免误诊和漏诊,做到早发现、早治疗,延长病人的生存期。

