基于PARP-1裂解引发非小细胞肺癌细胞凋亡的蟾酥抗肿瘤机理研究*
毛佩芝 吴纪恒 王龙虎 严荧燕 汪志春
1 宁波市妇女儿童医院 浙江 宁波 315000
2 浙江大学医学院附属儿童医院 浙江 杭州 310058
3 浙江大学药学院 浙江 杭州 310058
4 江苏京蟾生物资源开发有限公司 江苏 盱眙 211700
非小细胞肺癌(NSCLC)是目前发病率和死亡率均排前列的恶性肿瘤[1]。临床试验以及实践证明,中药在提高放化疗效果、改善肿瘤耐药反应、降低术后复发和转移、延长病人生存期、提升生存质量等方面具有明显的优势[2,3]。蟾酥为蟾蜍科动物中华大蟾蜍(Bufobufo gargarizans)或黑框蟾蜍(BufomelanostictusSchneider)的干燥分泌物,是我国传统名贵中药材。研究显示,蟾酥的主要药效物质是蟾毒配基类成分,其在抗肿瘤、免疫调节以及减轻癌痛等方面有显著疗效[4,5]。因此,蟾酥及其制剂广泛用于抗肿瘤,治疗肺癌效果尤佳[6-8]。然而蟾酥抗肿瘤的作用机制复杂,作用靶点尚未明确,加上它又是毒性中药,其应用受到限制[9,10]。因此,探索蟾酥抗肿瘤的结合靶点及其作用机制,对其精准用药具有重要意义。
分子对接技术可以通过算法模拟小分子与受体大分子蛋白之间的结合作用方式。在计算机辅助药物设计中,模拟分子对接是关键步骤,即通过算法预测药物分子与靶点结合互相作用的方式和过程[11]。分子对接技术在中药活性成分筛选和靶点确证方面有着广泛的应用前景。
本文在前期研究的基础上[12],采用半柔性分子对接技术,研究蟾酥有效成分与PARP 蛋白间的相互结合方式,从结合自由能、疏水作用、构象稳定性、结合亲和力等方面探讨配体抑制活性的概率,初步探究蟾酥抗肿瘤作用机制。然后,在虚拟分析的基础上,开展流式细胞术检测沙蟾毒精引起的A549 细胞凋亡实验,并检测沙蟾毒精给药后A549 细胞中cleaved PARP 的表达量,以达到与分子对接预测结果相互佐证的目的。本文研究的意义在于为蟾酥的精准用药和新药开发提供新的研究基础。
1 材料与方法
1.1 细胞与试剂:A549和H157细胞由浙江大学中药药理实验室提供。标准品沙蟾毒精(CAS:464-74-4)、远华蟾毒精(CAS:472-26-4)、华蟾毒它灵(CAS:1108-68-5)购自上海源叶生物科技有限公司,质量分数均高于98%。噻唑蓝(MTT)试剂盒(上海碧云天生物技术有限公司);Annexin V/PI 凋亡检测试剂盒(中国Biosharp 公司);PARP 一抗(Abcam 公司,批号:ab227244);山羊抗兔二抗(Abcam公司,批号:ab7090)。
1.2 仪器:酶标仪(美国BIO-TEK 公司);FC 500MCL 流式细胞仪(美国Beckman Coulter 公司);化学发光成像仪(美国Bio-Rad公司)。
1.3 软件和数据:Autodock 软件由美国斯克利普斯研究所开发,免费授权。PARP 蛋白晶体结构来源于数据库(https://www.rcsb.org/)。三维结构来源于(https://zinc.docking.org/substances/home/)。软件运行于Windows操作系统下。相关软件均已授权或免授权。
2 方法
2.1 蛋白结构预处理:在蛋白质数据库中,搜索PARP-1 蛋白(蛋白号:5DS3)晶体结构文件,基源为大肠杆菌。利用Pymol软件去除水分子和多余的配体,得到PARP-1蛋白结构。之后添加电荷和极性氢原子,应用Autodock软件对小分子化合物进行能量优化,检查可旋转的化学键,另存为pdbqt[Protein Data Bank,Partial Charge(Q),& Atom Type(T)]文件。
2.2 Autodock 分子对接:Autodock 4.2 软件运行于Windows 系统下,依次加载蛋白晶体结构(受体)和小分子化合物(配体)。用Auto Grid 计算格点能量,采用拉马克遗传算法对接运算,用半经验的自由能评价方法评价各配体与蛋白之间的结合情况。参数设置:将参数“能量最大评价次数”确定为2500000,运行次数确定为100,其他参数为默认设置。根据相关文献[13]报道,确定蛋白活性口袋的氨基酸残基和中心点坐标(X、Y、Z):Gly 863、Ser 904、Tyr 907、Tyr 896、Lys 903 和Arg 878,中心坐标为(30.571,15.384,44.088)。
2.3 PILP 分析:PILP(Protein-Ligand Interaction Profiler)是一个在线的蛋白配体非共价联系的分析工具。将Autodock 生成的PDB 文件导入PILP,经算法处理,以展示受体与配体之间的非共价键作用,包括氢键、π-π堆积、疏水作用等。
2.4 细胞培养及MTT检测:选用第3代至第8代的A549和H157 细胞置于培养瓶中,在37℃、5% CO2及饱和湿度的细胞培养箱内培养,每隔12h观察并记录细胞生长状态1 次,以确保细胞状态良好。在细胞培养72h 后,加入MTT 20μL,再孵育4h 后于酶标仪490nm 处测定吸光度值,并计算细胞抑制率。
2.5 Western Blot:将培养的细胞用PBS 冲洗细胞2次,再加入蛋白酶抑制剂和RIPA预混液,提取A549细胞总蛋白样本,并检测蛋白浓度;将蛋白样本上样在10%SDS-PAGE 凝胶梳孔中,电泳,转膜,封闭,一抗(1∶899)中孵育;过夜后,洗膜,二抗孵育,洗膜;ECL 发光显影,凝胶成像仪曝光,拍照,应用ImageJ软件检测条带灰度值,将目的条带灰度值对比内参条带灰度值,得到目的蛋白的相对表达量。
2.6 Annexin V-FITC 检测细胞凋亡:将对数生长期细胞用胰酶消化制得悬液并将细胞接种于24 孔板,分组同上。药物处理24h后消化、离心,预冷PBS重悬,将细胞密度调至1×105/mL,1000r/min 离心5min,弃上清,加入500µL 结合液轻轻重悬细胞,加入5µL Annexin VFITC,轻轻混匀;再加入5µL 碘化丙啶,轻轻混匀,室温下避光孵育10min,上流式细胞仪检测。
3 结果
3.1 分子对接结果:蟾酥主成分与PARP-1 蛋白靶点对接结果见表1。对接结果综合了半经验化的自由能评价评分抑制常数值(Ki)参与对接的氨基酸残基等数据。PARP-1 分别与沙蟾毒精、嚏根草配基、嚏根草醇、华蟾毒它灵、远华蟾毒精、19-氧代华蟾毒它灵和19-氧代华蟾酥毒基相互作用的最低结合自由能分别为-5.72、-6.47、-6.52、-5.81、-6.25、-6.16、-6.80 KJ/mol。通过拉马克算法分析,得到了PARP 蛋白(5DS3)和小分子配体的最佳对接方式,如图1 所示。
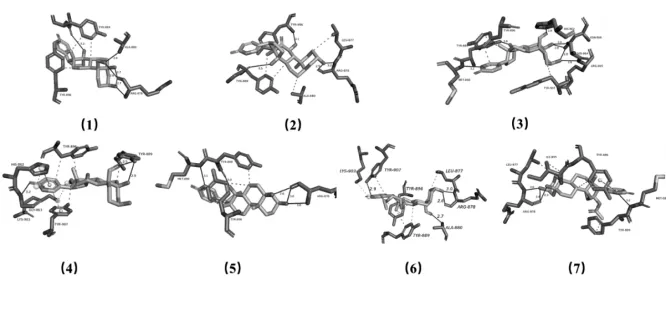
图1 有效成分与PARP-1对接模式图
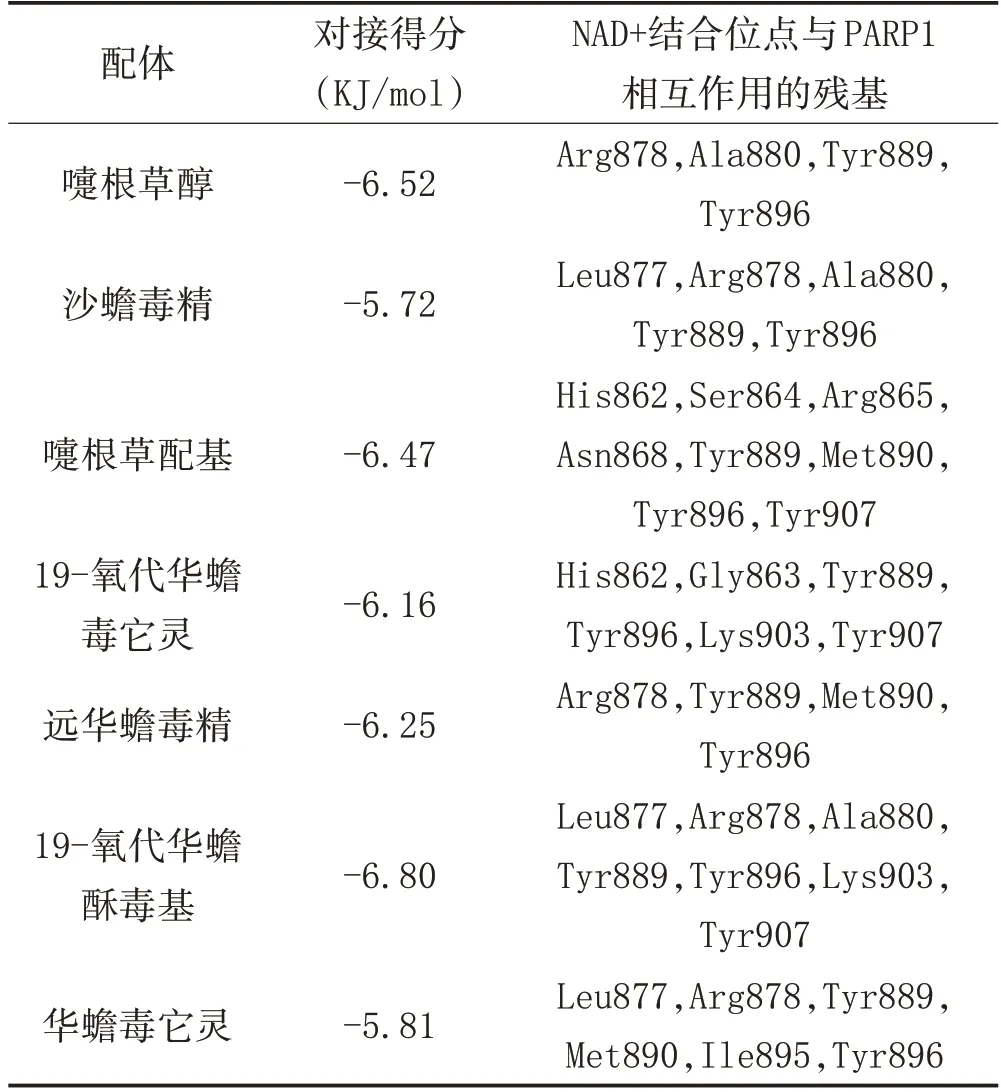
表1 蟾酥抗肿瘤活性成分与PARP蛋白的分子对接结果
3.2 体外活性试验结果:为了验证上述分析结果,本文选择其中代表性化合物(沙蟾毒精、远华蟾毒精和华蟾毒它灵),考察有效成分对癌细胞(A549和H157)的生长抑制作用,如表2所列。试验结果表明,它们都能显著抑制肿瘤细胞的生长,这与虚拟分析的结论相吻合。
表2 3种活性成分对A549、H157肺癌细胞的抑制作用(±s,n=3)

表2 3种活性成分对A549、H157肺癌细胞的抑制作用(±s,n=3)
IC50(ng/mL)A549 H157沙蟾毒精12.37±3.61 8.89±1.43远华蟾毒精27.79±17.52 23.72±7.27华蟾毒它灵23.40±4.28 131.32±21.16
与空白对照比较,给药干预A549 细胞、H157 细胞72h,各组细胞增殖受到抑制,细胞增殖抑制率随给药浓度上升而增高,差异具有统计学意义(P<0.01),且500ng/mL浓度组增殖抑制效果最佳(图2)。
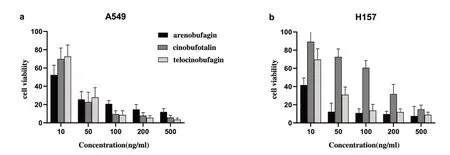
图2 三种化合物对A549、H157细胞的增殖抑制作用
3.3 沙蟾毒精诱导A549 细胞凋亡结果:我们进一步测试了蟾酥抗肿瘤成分沙蟾毒精诱导A549细胞凋亡的效果。结果如图3所示。与对照组(0ng/mL)比较,处理组细胞的凋亡率明显升高(P<0.05),且呈浓度依赖性,其中25ng/mL浓度组细胞凋亡比例最高。
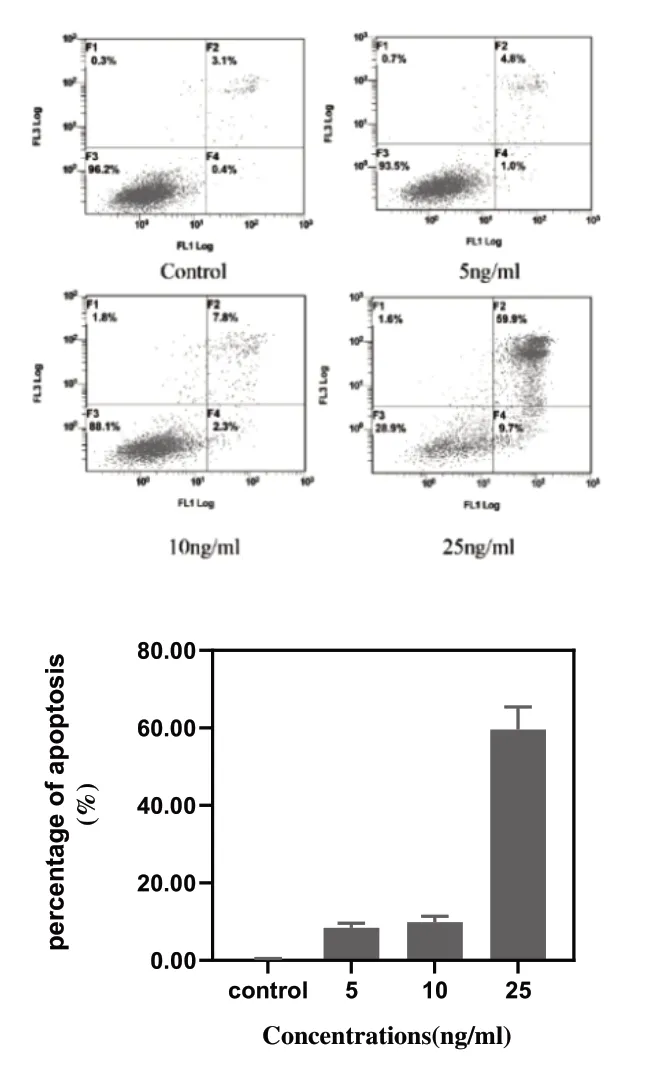
图3 沙蟾毒精诱导A549细胞凋亡实验结果
3.4 诱导PARP 蛋白裂解结果:图4 是免疫印迹法探究沙蟾毒精诱导A549 细胞的PARP 蛋白裂解的实验结果。由图4 可知,与对照组(0ng/mL)相比,处理组的cleaved PARP 表达量明显增加且呈浓度依赖性。分子生物学实验结果与Autodock软件模拟结果相一致。
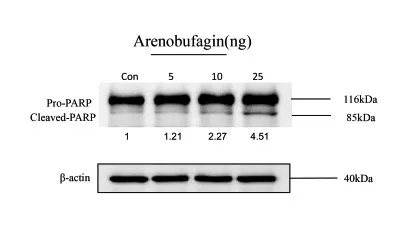
图4 免疫印迹法测定PARP蛋白的表达量
4 讨论
PARP-1 是近年来肿瘤治疗的一个热门靶点,而PARP-1抑制剂能够靶向抑制DNA损伤修复过程,体外试验和临床试验均证实PARP-1 抑制剂具有较强的抗肿瘤效果,其已进入临床使用并取得了一系列令人满意的疗效[14]。由于肿瘤细胞基因组不稳定,其存活非常依赖DNA 损伤应答修复机制[15]。PARP-1 最重要的功能是参与碱基切除与修复,在单链DNA损伤修复中发挥重要作用[16]。PARP 在细胞DNA 损伤后可以被激活,并识别DNA单链损伤缺口,最终结合到缺口上进行修复。根据已有文献[17]报道,蟾酥成分单体能够通过诱导肿瘤细胞凋亡抑制其生长。
首先本研究通过Autodock分子对接技术和PILP分析平台,模拟并预测了蟾酥有效成分的抗肿瘤作用靶点。结合表1 和图1 所示,沙蟾毒精等7 种化合物均能与PARP-1的NAD+结合口袋中的部分氨基酸残基发生氢键、盐桥等相互作用,且与PARP-1 结合活性较强,说明这些化合物可能阻断PARP-1 蛋白对损伤DNA 的修复作用,并以此发挥抗肿瘤活性。他们与PARP-1 结合的差异,在于各种结合自由能的差异,反映出配体与受体之间具有相当的亲和力。
其次是结合的氨基酸残基种类和结合方式的不同,由此可能导致最终药效活性的差异。这7种化合物均属于蟾毒配基类成分。根据文献[13],对于蟾毒配基类分子的母核而言,在C-17位有α-吡喃环的甾体A/B顺式、C/D顺式结构基本骨架对于维持其药理活性至关重要。3-OH和5β-OH取代基能够增加其活性,而C-3位的大取代基则不利于此类化合物的活性,可能是由于3位的大取代基会增大分子的极性。根据筛选结果,具有11α-羟基和12-羰基的沙蟾毒精表现出最强的药理活性,说明此结构特征有利于增强其活性;对于19-氧代华蟾酥毒基、19-氧代华蟾毒它灵和华蟾毒它灵而言,16β-乙酰氧基有利于其分子活性增强;此外,嚏根草醇的C-10位羟甲基;嚏根草配基,19-氧代华蟾毒它灵和19-氧代华蟾酥毒基的C-10位的醛基能够增强其化合物活性,这与相关研究结果一致[18],说明相对于蟾酥中的其他成分,我们筛选出的化合物具有对药效活性更有利的取代基团,使得这些化合物在蟾酥对肺癌细胞产生细胞毒作用。
本研究通过分子对接技术成功预测PARP-1 有可能为蟾酥抗肺癌的肿瘤靶点,随后通过对沙蟾毒精、远华蟾毒精和华蟾毒它灵进行药效验证,证明3种成分具有显著的肺癌细胞抑制作用。它们在细胞毒活性强弱排序为沙蟾毒精、远华蟾毒精、华蟾毒它灵。参考已上市的靶向PARP 蛋白的小分子药物奥拉帕利(Olaparib)对A549 细胞的IC50 值:(13.38±1.2)µg/mL[19],以及现行质量标准中的脂蟾毒配基对A549 细胞的IC50 值:(8.83±2.1)µg/mL[20]。对比实验结果可以发现,本文筛选出的小分子的IC50值显著低于奥拉帕利和脂蟾毒配基,意味着更强的抑制作用。
最后本研究选择其中含量最高的沙蟾毒精,探究其对细胞凋亡的作用及诱导PARP蛋白裂解的作用。结果表明,沙蟾毒精可以显著诱导PARP蛋白发生裂解,并诱导A549细胞凋亡,由此抑制肿瘤细胞增殖,该结果与分子对接预测结果相互佐证。

