二草清肝汤含药血清对人源HL-7702肝细胞凋亡的影响及其机制研究*
黄健莹 欧阳钦 吴春明 刘三海 王丽佳 赵安静 谢远太
浙江中医药大学附属温州市中医院 浙江 温州 325000
浙南名老中医任侠民先生以温州道地药材鸡骨草和垂盆草,创立二草清肝汤(EQD),临床和基础研究证实对急性肝衰竭(ALF)有一定的疗效[1]。前期实验显示二草清肝汤(EQD)对免疫性肝损害大鼠的肝细胞凋亡具有保护作用,其机制与肝细胞内的PI3K/AKT/GSK3β 信号途径的活化受抑制有关[2];最新研究显示ALF 小鼠肝组织Tott 样受体4(TLR4)mRNA 表达明显升高,EQD 能下调肝组织的TLR4 mRNA 表达[3]。据此,我们推测EQD 可能是通过肝细胞TLR4/PI3K/AKT/GSK3β 信号通路调控肝细胞凋亡。因此,本研究拟以脂多糖(LPS)构建人源HL-7702 肝细胞凋亡模型,在分子和细胞水平检测相关凋亡信号分子表达情况,为EQD 用于防治ALF 提供实验依据。
1 材料与方法
1.1 实验动物和细胞:BALB/C,雄性,周龄6~8w,30只,许可证号:SCXK(湘)2019-0004,购自湖南斯莱克景达实验动物有限公司;饲养环境:温度20~26℃,湿度40%~70%。人源HL-7702 肝细胞(货号:CL-0190),购自普诺赛生物公司。
1.2 实验药物:所用中药材均购自温州永安堂中药饮片公司,按原方比例(鸡骨草、垂盆草、茵陈各15g,制大黄3g,茯苓、泽泻、苍术各10g,陈皮、甘草各6g),水煎2次合并药液,过滤浓缩至含生药3.3g/mL,加入其两倍的乙醇拌匀,沉淀后取得上清液;回收乙醇后浓缩得浸膏,加入糊精、蔗糖混匀,制粒即得。实验前取蒸馏水溶解,按1∶2∶3 比例分别制成二草清肝汤小剂量、中剂量和大剂量,以备实验时用。
1.3 试剂:Annexin V-FITC/PI Apoptosis Kit(批号:AP101-100-kit,MULTI SCIENCES 联科生物);GSK3β(批号:22104-1-AP,protein tech);Cy3 Goat Anti-Rabbit IgG(批号:As007,ABclonal);即用型DAPI 染液(批号:KGA215-50,凯基);CCK-8 法细胞增殖检测试剂盒(批号:KGA317,凯基生物);Trizon Reagent(批号:CW0580S,CWBIO);超纯RNA 提取试剂盒(批号:CW0581M,CWBIO);HiScript Ⅱ Q RT SuperMix for qPCR (+gDNA wiper)(批号:R223-01,Vazyme);ChamQ Universal SYBR qPCR Master Mix(批号:Q711-02,Vazyme);50×TAE 缓冲液(批号:T1060,Solarbio);6×DNA Loading Buffer(批号:GH101-01,TRANS);50bp DNA Ladder(批号:MD108,TIANGEN);Gsafe Red plus 核酸染料(批号:GK20002,GLPBIO);琼脂糖粉(批号:75510-019,Invitrogen);LPS(批号:L2880,Sigma)。
1.4 仪器:旋涡混合器(XH-C,常州越新仪器制造有限公司);低温高速离心机(TGL-16D,常州中捷实验仪器制造有限公司);流式细胞仪[Novo Cyte 2060R,艾森生物(杭州)有限公司];热恒温培养箱(DHP-9054,山东博科生物);电热恒温鼓风干燥箱(HGZF-101-1,上海跃进医疗器械有限公司);荧光显微镜(CKX53,OLYMPUS);高压锅(YS20ED,苏泊尔);全自动样品快速研磨仪(Tiss-12,上海净信实业发展有限公司);高速台式冷冻离心机(H1750R,湖南湘仪实验室仪器开发有限公司);微型离心机(D1008E,SCJLOGEX);旋涡混合器(XH-C,常州越新仪器制造有限公司);紫外分光光度仪(NP80,Nano Photometer);电泳仪(DYY-8C,北京六一生物科技有限公司);普通PCR 扩增仪(TC-EA,杭州博日科技有限公司);荧光PCR仪[CFX Connect实时,伯乐生命医学产品(上海)有限公司];超高灵敏度化学发光成像系统仪[ChemiDocTM XRS+,伯乐生命医学产品(上海)有限公司]。
1.5 实验方法:分述如下。
1.5.1 小鼠急性肝衰竭模型构建和含药血清的制备:分组:空白对照组(n=6)、LPS 组(n=6)、LPS+EQD 低剂量组(n=6)、LPS+EQD 中剂量组(n=6)、LPS+EQD 高剂量组(n=6);灌胃:制取二草清肝汤EQD,LPS+EQD 低剂量组为0.2mL/d,LPS+EQD 中剂量组为0.3mL/d,LPS+EQD 高剂量组为0.4mL/d,灌胃,1 日1 次,共12 天;正常组和LPS 组同时予3mL/kg·d 的生理盐水灌胃,1 日1 次,共12 天。末次给药4h 后,除空白对照组外所有小鼠均腹腔注射D-Gal(800mg/kg)和LPS(7.5mg/kg),制备ALF 小鼠模型。末次注射LPS 24h后,处死各组小鼠。取各组肝组织和血清进行后续实验。
1.5.2 细胞处理:弃去细胞培养上清,用1×PBS 洗2遍,加入0.25%胰酶(含0.02% EDTA)消化,待细胞变圆加入培养基终止消化并收集细胞悬液至10mL 离心管中,1000rpm 离心3min,弃去上清液加入培养基重悬细胞,计数,根据实验需要对细胞铺6孔板和96孔板,将细胞根据实验需要进行稀释,96 孔板每孔3000 和5000 个细胞,均匀地铺到细胞培养板中,做好标记,放置培养箱中培养,待细胞完全贴壁后,按照分组,加入不同剂量的含药血清100μL 预处理2h,然后再加入10μg/mL 的10μL LPS处理24h,空白对照组加入100μL+10μL的生理盐水。
1.5.3 流式检测凋亡:收集1~3×106个细胞,加1mL PBS,1500rpm 离心3min,洗两遍;用双蒸水将5×Binding Buffer稀释为1×Binding Buffer;取300μL预冷的1×Binding Buffer 重悬细胞;每管各加入5μL Annexin V-FITC 和10μL PI;轻微混匀后,室温避光孵育10min;再向每管中加入200μL 预冷的1×Binding Buffer;混匀后上流式仪检测。
1.5.4 免疫荧光:细胞的固定:弃上清后PBS浸洗3次,每次3min;用4%的多聚甲醛固定15min,PBS 浸洗培养皿3 次,每次3min。打孔:0.5%Triton X-100(PBS 配制)室温通透20min。PBS 浸洗培养皿3 次,每次5min,移液枪吸干PBS,在培养皿上滴加5%BSA,37℃封闭30min。一抗:移液枪吸掉封闭液,不洗,每个培养皿滴加足够量的稀释好的一抗;GSK3 bate(1∶200)4℃孵育过夜;PBS 浸洗培养皿3 次,每次3min,移液枪吸干培养皿内多余液体后滴加稀释好的荧光二抗Cy3(1∶200),37℃孵育30min,PBS 浸洗培养皿3 次,每次3min。注意:从加荧光二抗起,后面所有操作步骤都尽量在较暗处进行。复染核:滴加DAPI 避光孵育5min,对标本进行染核,用PBS浸洗多余的DAPI;封片:用20%甘油封闭培养皿,然后在荧光显微镜下观察采集图像。
1.5.5 实时荧光定量PCR(qPCR):采用Trizon 试剂提取总RNA,用UV-Vis 分光光度计测定RNA 浓度和纯度。然后,对提取的RNA 进行逆转录和荧光定量PCR 检测。β-actin 作为内参,bax、bcl-2 和active-caspase3 的相对表达量根据2-△△Ct法计算。序列见表1。

表1 PCR引物序列、产物长度及退火温度
1.5.6 Western blot 检测:弃掉培养皿中的细胞培养液,每孔加入100μL 的细胞裂解液,置于冰上20 min。用细胞刮将细胞刮至一侧,移液枪吸入已做好标记的EP管中。12000rpm离心10min,弃沉淀,取上清液移至新的EP 管(BCA 测定),总蛋白置于-20℃保存。根据BCA 试剂盒测定蛋白浓度,蛋白变性,上样进行十二烷基苯磺酸钠凝胶电泳(SDS-PAGE)1.5h,后用300mA 恒流转膜1.5h。用PVDF膜孵育一抗,4℃过夜,次日PVDF膜室温孵育二抗2h,洗膜,用发光液浸湿PVDF膜后放置于超高灵敏度化学发光成像系统样品放置区运行程序显影成像。
1.6 统计方法:应用SPSS 20.0 软件进行统计分析。所有实验重复3次,定量结果采用均数±标准差(±s)表示。两组之间定量数值比较采用独立样本t检验,多组之间定量数值比较采用单因素方差分析,两两比较采用S-N-K法。检验水准α=0.05。
2 结果
2.1 EQD 对HL-7702 肝细胞凋亡影响:如图1 所示,LPS、不同剂量EQD 分别处理人源HL-7702 肝细胞后,流式检测各组细胞的凋亡情况,可以看出,与对照组相比,LPS 处理后,HL-7702 肝细胞凋亡率显著上升(P<0.05)。与LPS 组比较,加入低、中、高EQD 分别处理后,HL-7702 肝细胞凋亡率显著下降(P<0.05),且中、高剂量EQD 下降更显著(P<0.05)。说明EQD 可以显著抑制LPS引起的HL-7702肝细胞凋亡。
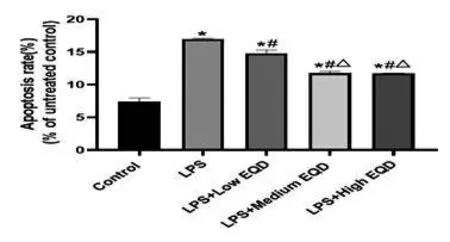
图1 流式检测各组细胞凋亡率
2.2 EQD 对HL-7702 肝细胞中GSK3β 核易位的影响:如图2所示,采用LPS及不同剂量EQD分别处理HL-7702肝细胞后,免疫荧光检测各组细胞中GSK3β表达情况,可以看出,GSK3β 主要在HL-7702 的细胞质表达,细胞核有少量表达。且与对照组比较,LPS 处理后,HL-7702中GSK3β 表达显著上升,且趋向于向细胞核中聚集(P<0.05)。与LPS组相比,加入低、中、高EQD分别处理后,HL-7702 肝细胞中GSK3β 表达显著下降,且中、高剂量下降更显著,趋向于向细胞质中聚集(P<0.05)。说明EQD 可以显著抑制HL-7702 肝细胞中LPS 诱导后的GSK3β表达。
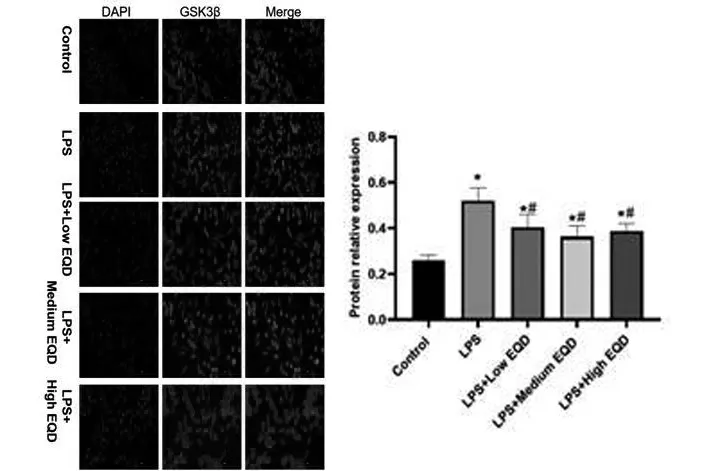
图2 免疫荧光检测GSK3β核异位情况
2.3 EQD对HL-7702肝细胞中凋亡相关基因Bax、Bcl-2和炎症因子TNF-α、IL-6 mRNA表达水平的影响:如图3所示,采用LPS 及不同剂量EQD 分别处理HL-7702 肝细胞后,qPCR 检测各组细胞中Bax、Bcl-2 和TNF-α、IL-6 mRNA 表达水平情况,与对照组比较,LPS 处理后,HL-7702肝细胞中的Bax、TNF-α、IL-6显著上升,Bcl-2 表达显著下降(P<0.05)。与LPS 组比较,加入低、中、高EQD分别处理后,HL-7702肝细胞中Bax、TNF-α、IL-6显著下降,Bcl-2 表达显著上升(P<0.05)。说明EQD 可以抑制LPS引起的凋亡和炎症反应。
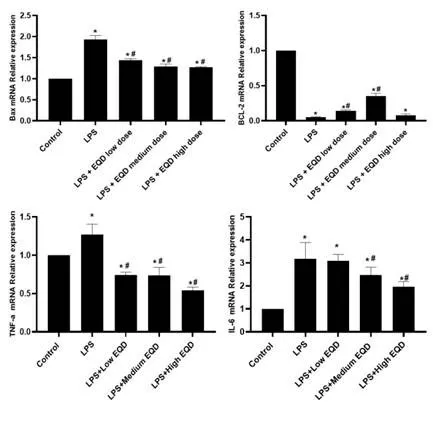
图3 qPCR检测各组小鼠肝组织中凋亡相关基因Bax、Bcl-2 和炎症因子TNF-α、IL-6 mRNA表达水平
2.4 EQD 对HL-7702 肝细胞中下游蛋白AKT、GSK3β 及其磷酸化表达水平的影响:如图4 所示,LPS、不同剂量EQD 分别处理HL-7702 肝细胞后,Western-blot 检测各组细胞的AKT、GSK3β及其磷酸化表达情况,可以看出,与对照组比较,LPS 处理后,AKT、GSK3β、p-AKT、p-GSK3β 表达显著上升(P<0.05)。与LPS 组比较,加入低、中、高EQD分别处理后,AKT、GSK3β表达显著上升(P<0.05),p-AKT、p-GSK3β 表达显著下降(P<0.05)。说明EQD可以显著抑制HL-7702肝细胞中LPS诱导后的p-AKT、p-GSK3β表达。
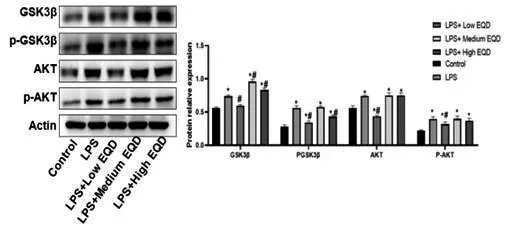
图4 Western blot检测各组细胞中GSK3β、p-GSK3β、AKT、p-AKT蛋白表达水平
3 讨论
急性肝功能衰竭(ALF)的最主要病理形态学特征是肝细胞坏死,而肝细胞坏死的基础是肝细胞凋亡,大量肝细胞凋亡导致ALF 的发生[4]。笔者经前期实验研究发现,人源HL-7702 细胞内有TLR4 介导PI3K/AKT/GSK3β 信号通路,并且TLR4 通过PI3K/AKT/GSK3β 通路介导了HL-7702 细胞凋亡的调控。目前尚未发现任何西药可以有效地阻抑肝细胞凋亡的发生。基于肝细胞凋亡在ALF 中的作用,能否以TLR4 为靶点,通过其介导PI3K/AKT/GSK3β 信号通路来干预肝细胞凋亡的发生,从而为临床治疗ALF提供新的思路。临床研究证实二草清肝汤EQD对治疗ALF有较好疗效。实验发现,EQD能降低免疫性肝损害大鼠的血清TNF-α、IL-12 水平,抑制其肝细胞Bax的表达,促进Bcl-2的表达,对免疫性肝损害大鼠的肝细胞凋亡具有保护作用,其机制与肝细胞内的PI3K/AKT/GSK3β 信号途径的活化受抑制有关[2]。
本次流式细胞仪检测的结果表明EQD 可以显著抑制LPS 引起的HL-7702 细胞凋亡。同时,免疫荧光检测GSK3β 核易位的结果说明EQD 可以显著抑制HL-7702细胞中LPS 诱导后的GSK3β 表达,而GSK3β 是TLR4/PI3K/AKT/GSK3β 信号通道中重要的下游分子。TLR4/PI3K/AKT/GSK3β 通路是最重要的介导细胞凋亡的信号通路,能够介导多种生物学效应,对细胞凋亡、存活起调节作用[5]。有研究表明,肝损伤和ALF时TLR4表达增加,TLR4/PI3K/AKT/GSK3β 通路呈激活状态,肝细胞凋亡率增加[6]。而本次Western-blot 实验研究显示,EQD可以显著抑制HL-7702 细胞中LPS 诱导后的p-AKT、p-GSK3β 表达,提示加入EQD 后,TLR4/PI3K/AKT/GSK3β通路呈抑制状态,小鼠HL-7702 细胞凋亡率下降,与流式细胞仪结果相一致。
Bcl-2 家族是TLR4/PI3K/AKT/GSK3β 信号通路重要的下游底物,主要包括抗凋亡基因Bcl-2和促凋亡基因Bax;TLR4/PI3K/AKT/GSK3β 信号通路激活的表现就是释放大量的炎症细胞因子,引起细胞凋亡,其中TNFα、IL-6是最典型的炎症细胞因子[7,8]。而本次qPCR检测结果显示,EQD可以抑制LPS引起的凋亡和炎症反应,对HL-7702肝细胞凋亡有干预作用。
实验结果提示,EQD 预处理可以显著降低由LPS 诱导的人源HL-7702 肝细胞凋亡率,这种作用可能是通过抑制TLR4/PI3K/AKT/GSK3β 信号通路中重要蛋白分子的表达,如TLR4、AKT、GSK3β、Bax、Bcl-2 等来实现的。有关EQD 的具体干预机制尚需进一步动物实验进行研究证实。

