七氟醚后处理联合右美托咪定对心肌缺血/再灌注损伤小鼠的心肌保护作用机制
金 辉,肖志博,葛树胜,吴小精,尹顺花,李 媛
衰老是心血管疾病发展的重要危险因素,可引起心脏结构的改变和功能的不断退化[1-2]。衰老改变心脏能量代谢和线粒体功能,导致心功能下降,还将引起心肌细胞死亡和不良结构重塑,从而加重心肌梗死、心力衰竭和其他心血管疾病对心脏的损伤[3-4]。心肌梗死后恢复缺血心肌的血液供应对于限制急性心肌梗死造成的损害至关重要,但再灌注阶段,心肌血流的恢复会对心肌造成二次损伤,该过程被称为心肌缺血/再灌注损伤(myocardial ischemia-reperfusion injury,MI/RI)[5]。右美托咪定(dexmedetomidine,Dex)是一种高度选择性的α2-肾上腺素能受体激动剂,具有镇痛、镇静和阿片类药物特性,适用于重症病人的镇静[6]。Dex对缺血/再灌注(I/R)损伤的心脏保护作用已有广泛研究[7],证实Dex前处理或后处理对I/R损伤心肌细胞均具有保护作用[8]。但Dex对I/R损伤的保护作用还仅限于动物模型水平的研究,暂未大规模应用于临床[9-10]。而在临床实践中发现,挥发性麻醉剂可改善缺血后的心脏功能并减少梗死发生,这种现象被称为麻醉后处理(anesthetic postconditioning)的保护效应[11-12]。有证据证明,七氟醚(sevoflurane,Sev)后处理(sevoflurane postconditioning,Sev-postC)可减轻病人的心肌再灌注损伤[13],但其确切的分子机制尚未完全阐明。巨噬细胞迁移抑制因子(macrophage migration inhibitory factor,MIF)是一种多效性炎症细胞因子,广泛表达于各种细胞类型[14]。MIF响应各种刺激,可由低氧诱导因子-1α(HIF-1α)诱导,从细胞内分泌至胞外,通过调节其他促炎细胞因子的释放来控制炎症反应进程[15]。最近许多研究证明,MIF在保护缺血后的心肌方面具有一定作用,且该作用独立于其促炎特性。这些研究表明,经过短暂缺血(≤30 min)的心脏会释放MIF,随后MIF将激活腺苷酸活化蛋白激酶(AMPK)并抑制JNK通路和氧化应激,从而保护心脏免受I/R损伤[16]。另有研究表明,MIF参与麻醉剂异氟烷预处理诱导的心肌细胞保护[17]。这些特征提示MIF在缺血预处理诱导的心肌保护中发挥潜在的作用。
基于上述证据,MIF可能在Sev-postC减轻缺血心肌损伤的过程中也发挥重要作用。本研究拟通过构建在体MI/RI小鼠模型,观察联合用药Dex与Sev-postC对心肌的保护作用。同时,通过体外构建缺氧/复氧(hypoxia/reoxygenation,H/R)心肌细胞模型,并敲低或过表达心肌细胞中的MIF因子,检测敲低或过表达MIF后对Sev与Dex的协同增效作用的影响,探索Sev协同增效作用的分子机制。
1 材料与方法
1.1 实验动物及材料
20只31周龄雄性C57BL/6J小鼠,体质量(250±10)mg,无特定病原体(SPF)级,购自海南药物研究所有限责任公司。H9c2细胞购自武汉普诺赛公司;Dex和Sev购自北京阳光生物公司(货号分别为YT-1732234和YZ-1612540);V-异硫氰酸荧光素(annexin V-FITC)/碘化丙啶(propidium iodide,PI)双标记流式细胞术检测试剂盒(货号A13199)、Lipofectamine 3000购自Thermo Fisher(美国,货号L3000075);CCK-8细胞计数试剂盒(货号96992);兔抗大鼠MIF、兔抗大鼠甘油醛-3-磷酸脱氢酶(GAPDH)、山羊抗兔IgG(H+L)辣根过氧化物酶(HRP)二抗购自Abcam(美国);MIF siRNA和siRNA NT寡核苷酸以及pcDNA3.1(+)和pcDNA3.1(+) MIF OE质粒合成或构建于上海生工生物公司;血清肌钙蛋白I(cTnI)、乳酸脱氢酶(LDH)、脑钠肽(BNP)、肌酸激酶同工酶(CK-MB)购自武汉华美生物公司。
酶标仪(型号800TS)购自美国BioTek公司;流式细胞仪(型号Attune NxT)购自美国Thermo Fisher公司;麻醉蒸发器(型号BS-S6100 Plus)购自广州碧森医疗公司(中国)。
1.2 实验方法
1.2.1 实验动物分组
造模手术前对小鼠适应性饲养1周。每笼4只小鼠,饲养于温度和湿度受控的SPF级鼠房,具备12 h/12 h光照/黑暗循环,小鼠可以随意进食和饮水。将所有小鼠随机分为假手术(Sham)组、I/R损伤模型(Model)组、Dex组、Dex联合Sev-postC(Dex+Sev-postC)组,每组5只。
1.2.2 MI/RI损伤小鼠模型的构建
将小鼠置于30 ℃加热垫上。小鼠腹腔注射2%戊巴比妥钠(60 mg/kg)麻醉。麻醉后,夹趾试验无反应,行气管插管。呼吸机参数设置为与麻醉小鼠的呼吸频率同步,然后,将气管插管连接到呼吸机。术前开始记录小鼠心电图。Model组经胸骨左缘第三肋间开胸,用7-0丝线结扎左冠状动脉左前降支(left anterior descending,LAD)。30 min后,松开结扎线进行再灌注。成功建立模型后,通过心电图识别ST段。Sham组小鼠打开其胸部,仅将7-0丝线放置于LAD相应部位但未结扎。手术后,连续监测小鼠心电图1 h未见再灌注性心律失常和心脏出血时,关闭胸腔,但不缝合心包;之后向经历手术的小鼠肌内注射青霉素(400 kU/kg)防止感染,待其清醒后再从30 ℃加热垫上移开,随后进行24 h再灌注[18]。再灌注结束后,小鼠腹腔注射2%戊巴比妥(60 mg/kg)麻醉下采集其腹主动脉血样,然后行腹腔注射2%戊巴比妥(100 mg/kg)安乐死小鼠,取其心脏进行后续检测。

图1 各组HE染色图
MI/RI造模手术后,Sham组和Model组小鼠均腹腔注射生理盐水,Dex组小鼠术后腹腔注射10 μg/kg的Dex[7],Dex+Sev-postC组小鼠在灌注前持续吸入2.5% Sev 15 min,然后开始再灌注[19]。
1.2.3 苏木精-伊红(HE)染色和Masson染色
HE染色:心脏经10%中性甲醛溶液于4 ℃固定48 h以上,随后进行石蜡包埋和切片,制备成5 μm切片。切片经二甲苯脱蜡,梯度乙醇水化后,使用苏木精染色液染色5 min,然后分化液分化3 s,再进行切片复蓝约3 s。随后依次用85%和95%乙醇脱水各4 min。之后,切片用伊红染色液染色5 min,无水乙醇脱水3次,每次5 min,二甲苯透明化2次,每次2 min。最后,切片用中性树胶封片。在Nikon光学显微镜下镜检并进行病理学分析和拍照。Masson染色:5 μm切片使用Masson A溶液染色15 h,然后在65 ℃烘箱中加热30 min,随后用自来水冲洗切片。将Masson B溶液和C溶液混合,并染色切片1 min,用1%盐酸乙醇处理1 min。用Masson D溶液染色6 min,再用Masson E溶液浸泡1 min,用Masson F溶液浸泡15 s。之后,切片用1%冰醋酸分化3次,每次8 s;无水乙醇脱水3次,每次5 min。二甲苯透明化后,用中性树胶封片。在Nikon光学显微镜下光镜镜检并进行病理学分析和拍照。
1.2.4 酶联免疫吸附试验(ELISA)
小鼠腹主动脉血样以3 000×g离心,收获血清样品。按照ELISA试剂盒的说明书对血清cTnI、LDH、BNP、CK-MB进行测定。使用BioTek酶标仪在450 nm下读取吸光值。
1.2.5 细胞培养和H/R细胞模型的构建
细胞实验分为4组,其中对照(Control)组细胞培养于添加10%胎牛血清(FBS)的完全DMEM培养液中,并在常氧条件下培养于通入5%CO2的37 ℃恒温、湿润的细胞孵育箱中正常培养。H/R损伤细胞模型组(H/R组):使用H9c2心肌细胞在体外诱导H/R损伤细胞模型。H9c2细胞培养于含有10% FBS的完全DMEM培养液中,置于上述细胞培养箱中培养。将2×106细胞种于6孔板,适应性贴壁培养24 h后,更换细胞培养液为无血清、无葡萄糖的DMEM培养液,并将细胞培养物转移至37 ℃恒温湿润的低氧细胞培养箱中,缺氧培养8 h。然后更换为DMEM完全培养液,并将细胞培养物转移至常规细胞培养箱中正常培养2 h。Dex组:细胞经历缺氧培养8 h,然后复氧培养2 h后,加入1 μmol/L的Dex处理12 h,随后终止药物作用,再继续培养12 h[20]。Dex联合Sev处理(Dex+Sev)组向细胞加入1 μmol/L的Dex后,将细胞培养板放置在37 ℃恒温、密封的玻璃腔室中,通过麻醉蒸发器向玻璃腔室加入浓度为3.4%的Sev处理细胞6 h,然后在正常培养条件下继续维持培养细胞18 h[21]。Dex联合Sev处理并分别转染敲低对照组(Dex+Sev+siRNA NT组)或敲低MIF组(Dex+Sev+MIF siRNA组)、过表达对照组(Dex+Sev+pcDNA3.1组)、过表达MIF组(Dex+Sev+pcDNA3.1-MIF组)细胞先进行siRNA转染或过表达质粒转染,然后再开始H/R体外诱导和药物处理。
1.2.6 转染
在H9c2细胞中敲低MIF:MIF siRNA引物序列为5′-AGCAGCTGGCGCAGGCCACCG-3′;siRNA NT引物序列为5′-CGTCCTGTGGTGCTCTACACC-3′。
在H9c2细胞中过表达MIF:将MIF的开放阅读框(ORF)克隆至pcDNA3.1(+)载体中,构建过表达MIF的pcDNA3.1-MIF OE质粒。MIF ORF正向引物序列为5′-TAGTGGCACGAGCGACCC-3′,反向引物序列为5′-TTGGCTGCGTTCATGTCGT-3′。
使用Lipofectamine 3000转染H9c2细胞,转染与细胞铺板同时进行,转染时将2×106H9c2细胞种于6孔板的每皿中,使得贴壁后的细胞汇合度达到45%~50%,同时更换细胞培养液为无血清、无抗生素的DMEM培养液。分别将10 μL Lipofectamine 3000和4 μg去内毒素的pcDNA3.1(+)或pcDNA3.1-MIF OE质粒DNA溶解于50 μL无血清、无抗生素的DMEM中;分别将5 μL的Lipofectamine 3000和100 pmol/L的MIF siRNA或siRNA NT溶解于50 μL无血清、无抗生素的DMEM中。然后轻轻混匀脂质体和DNA溶液并准确孵育20 min,随后于3 min内将混合液缓慢滴加至细胞培养物中,转染6 h后更换为含10% FBS的完全DMEM培养液,转染48 h后收获细胞样品,进行后续指标检测。
1.2.7 CCK-8细胞存活能力测定
将3×104细胞种于96孔板的每孔中,并按照实验要求对各组细胞进行处理。结束处理后再连续培养36 h。将含有10% CCK-8试剂的完全DMEM培养液加入每孔中,于37 ℃再孵育细胞2 h。然后使用BioTek酶标仪在450 nm下读取吸光值。
1.2.8 FITC-Annexin V/PI双标记流式细胞术测定
按照实验要求对各分组细胞进行处理。消化6孔板每皿细胞,制备成单细胞悬液。然后立即加入冰预冷的PBS,于4 ℃离心,弃上清,重复3次清洗细胞。加入Annexin V-FITC/PI双标记流式细胞术检测试剂盒自带的、4 ℃预冷的Annexin-Binding Buffer,并将细胞稀释至1.5×106/mL,每组样品取100 μL细胞悬液进行后续处理:向其中加入5 μL的Annexin V-FITC和5 μL的PI,室温避光孵育15 min,然后向加入400 μL的Annexin-Binding Buffer,置于冰上待测。上机Thermo Fisher流式细胞仪对细胞凋亡情况进行分析。
1.2.9 蛋白免疫印迹法(Western Blot)
向每皿6孔板细胞样品中加入100 μL含有蛋白酶抑制剂预混液的RIPA裂解液裂解细胞并提取细胞总蛋白样品,使用BCA蛋白质定量试剂盒定量总蛋白质的浓度,每个样本取25 μg总蛋白进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)凝胶电泳,采用半干转印法进行转膜。使用含10%脱脂牛奶的TBS-T缓冲液于室温对聚偏二氟乙烯(PVDF)膜封闭1 h。然后在4 ℃条件下孵育一抗过夜。抗体稀释度:兔抗大鼠MIF(1∶2 000稀释),兔抗大鼠-GAPDH(1∶5 000稀释)。第2天加入二抗山羊抗兔IgG(H+L)HRP二抗(1∶10 000稀释),于37 ℃孵育1 h。用TBS-T缓冲液洗膜后,滴加ECL发光底物进行化学发光。在Bio-Rad多色荧光成像分析系统下进行图像采集。
1.3 统计学处理

2 结 果
2.1 Sev-postC增强Dex对I/R心肌的保护作用
HE染色结果显示,Sham组小鼠心肌纤维排列规则,无破损或坏死间隙,心肌细胞核呈梭形或椭圆形;Model组小鼠心肌纤维结构断裂溶解,心肌间隙扩大,梗死处有炎性细胞浸润;Dex组小鼠心肌纤维断裂和炎症细胞浸润有所改善;Dex+Sev-postC组小鼠心肌纤维结构破坏得到明显改善,基本无炎症细胞浸润,很少见坏死间隙。详见图1。Masson染色显示,Sham组心肌组织无纤维化,无胶原蛋白沉积;Model组心肌组织纤维化程度明显,心肌细胞明显减少,胶原蛋白沉积增加;Dex组小鼠心肌细胞减少得到改善,胶原蛋白沉积减少;Dex+Sev-postC组心肌组织纤维化得到明显改善,心肌细胞排列整齐,几乎无胶原蛋白沉积。详见图2。ELISA检测血清心肌损伤指标cTnI、LDH、BNP、CK-MB结果显示,与Sham组比较,Model组cTnI、LDH、BNP、CK-MB水平均明显上升(P<0.01);与Model组比较,Dex组和Dex+Sev-postC组cTnI、LDH、BNP、CK-MB水平明显下调(P<0.05或P<0.01);与Dex组比较,Dex+Sev-postC组cTnI、LDH、BNP、CK-MB水平明显下调(P<0.05或P<0.01)。详见图3。
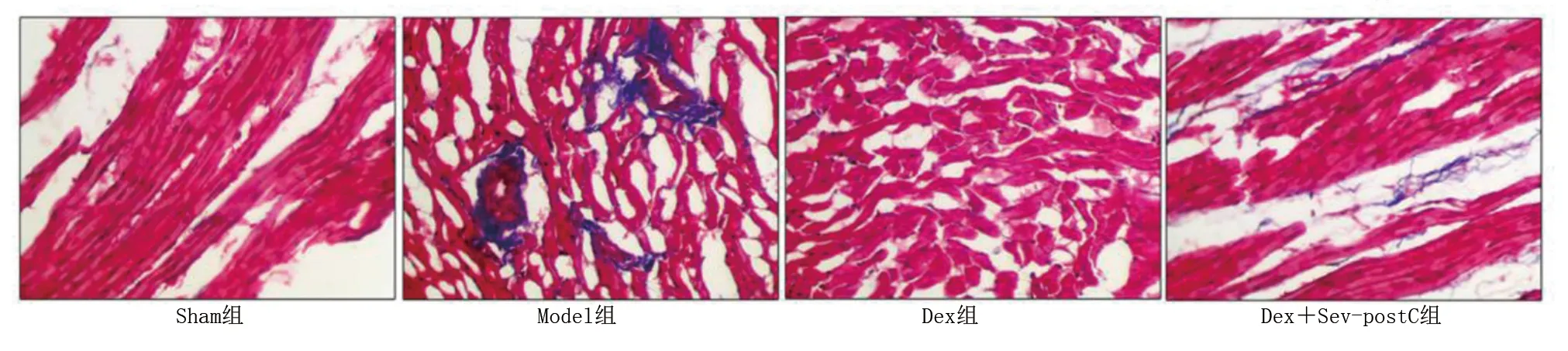
图2 各组Masson染色图

图3 各组血清cTnI、LDH、BNP、CK-MB水平比较
2.2 敲低MIF能够抑制Sev对Dex心肌保护的增强效应
Western Blot检测H9c2细胞中MIF表达,与siRNA NT组比较,MIF siRNA组MIF表达明显降低(P<0.01)。细胞存活能力测定结果显示,与Control组比较,H/R组细胞存活能力明显降低(P<0.01);与H/R组比较,Dex组、Dex+Sev+siRNA NT组和Dex+Sev+MIF siRNA组细胞存活能力明显上升(P<0.05);与Dex+Sev+siRNA NT组比较,Dex+Sev+MIF siRNA组细胞存活能力明显下调(P<0.05)。细胞凋亡率测定结果显示,与Control组比较,H/R组凋亡率明显升高(P<0.01);与H/R组比较,Dex组、Dex+Sev+siRNA NT组和Dex+Sev+MIF siRNA组细胞凋亡率明显降低(P<0.01);与Dex+Sev+siRNA NT组比较,Dex+Sev+MIF siRNA组细胞凋亡率明显升高(P<0.05)。详见图4~图6。

图4 siRNA NT组与MIF siRNA组MIF表达比较

图5 各组细胞存活能力、细胞凋亡率比较

图6 流式细胞仪检测各组细胞凋亡率
2.3 过表达MIF能够进一步增强Sev对Dex心肌保护的增强效应
Western Blot检测H9c2细胞中MIF表达,与pcDNA3.1组比较,pcDNA3.1-MIF OE组MIF表达明显升高(P<0.01)。细胞存活能力测定结果显示,与Control组比较,H/R组细胞存活能力明显降低(P<0.01),Dex+Sev+pcDNA3.1组和Dex+Sev+pcDNA3.1-MIF组与Control组比较差异无统计学意义(P>0.05);与H/R组比较,Dex组、Dex+Sev+pcDNA3.1组和Dex+Sev+pcDNA3.1-MIF组细胞存活能力明显上升(P<0.05或P<0.01);与Dex组比较,Dex+Sev+pcDNA3.1组和Dex+Sev+pcDNA3.1-MIF组细胞存活能力明显升高(P<0.05)。细胞凋亡率测定结果显示,与Control组比较,H/R组细胞凋亡率明显升高(P<0.01),Dex+Sev+pcDNA3.1-MIF组与Control组比较差异无统计学意义(P>0.05);与H/R组比较,Dex组、Dex+Sev+pcDNA3.1组和Dex+Sev+pcDNA3.1-MIF组细胞凋亡率明显降低(P<0.01);与Dex组比较,Dex+Sev+pcDNA3.1组和Dex+Sev+pcDNA3.1-MIF组细胞凋亡率明显降低(P<0.01);与Dex+Sev+pcDNA3.1组比较,Dex+Sev+pcDNA3.1-MIF组细胞凋亡率明显降低(P<0.05)。详见图7~图9。
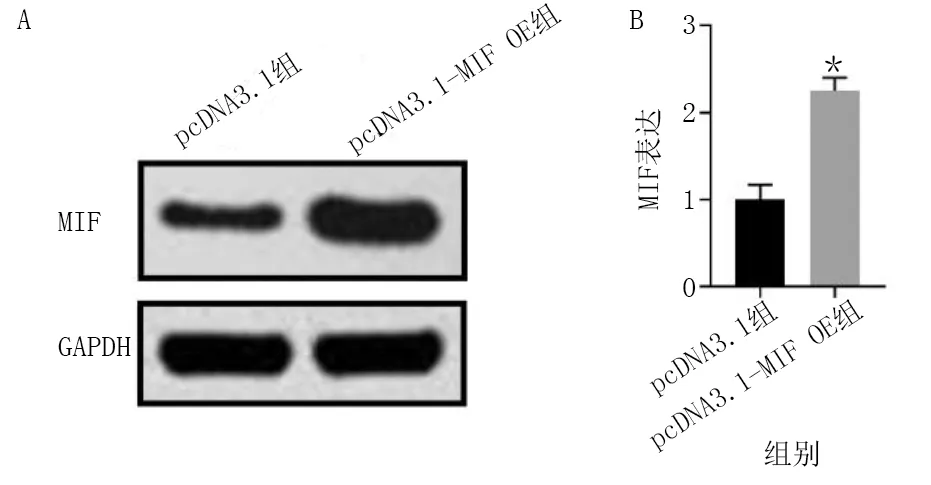
图7 pcDNA3.1组与pcDNA3.1-MIF OE组MIF表达比较

图8 各组细胞存活能力、细胞凋亡率比较

图9 流式细胞仪检测各组细胞凋亡率
3 讨 论
衰老是心血管疾病发展的重要危险因素,衰老能加重心肌梗死、心力衰竭和其他心血管疾病对心脏的损伤[3-4]。目前对Dex的心脏保护作用已有很多临床前研究,如小鼠心脏缺血15 min/再灌注45 min后开始Dex治疗能有效缩小梗死面积[7]。而且在合并症存在的情况下Dex也能发挥心肌保护功能。在2型糖尿病大鼠中,Dex后处理可缩小心肌梗死面积[22]。另外,即使存在急性高血糖,但Dex仍能保护I/R损伤大鼠的心肌[23]。有冠状动脉内皮功能障碍的大鼠心脏发生I/R损伤后,Dex能够发挥抑制心肌死亡和保护心脏功能的作用[24]。Dex的心脏保护作用有望转化为临床应用。本研究结果再次证实Dex对I/R的心肌具有明显的保护作用,Dex处理能够明显缓解模型小鼠心肌细胞的损伤和胶原蛋白的沉积,明显减轻心肌损伤,提示Dex对I/R心肌的有效保护作用。
临床实践中发现麻醉后处理,特别是Sev-postC能够有效缓解病人的心肌I/R损伤。Sev-postC通过上调O-GlcNAc转移酶介导的O-GlcNAc-RIPK3减少心肌I/R损伤诱导的心肌坏死性凋亡[25]。Sev-postC通过一氧化氮(NO)-依赖性机制恢复自噬通量防止心肌I/R损伤[19]。Sev-postC通过激活Janus激酶2(JAK2)-信号转导和转录激活因子3(STAT3)通路保护心肌免受I/R损伤[26]。本研究探索联合应用Dex与Sev能否缓解心肌I/R损伤,结果显示Sev-postC能够发挥与Dex协同保护心肌的作用。与单纯Dex处理比较,联合Dex与Sev-postC能够明显缓解I/R损伤小鼠心肌纤维化和心肌损伤。
本研究进一步分析了Sev-postC的分子作用机制。有研究显示,Sev-postC发挥心肌保护功能的分子作用通路主要有Toll样受体4(TLR4)/髓样分化因子88(MyD88)/核转录因子κB(NF-κB)通路[27],microRNA-145/颗粒酶K(GZMK)分子作用轴[28],以及低氧诱导因子-1(HIF-1)/B淋巴细胞瘤-2基因/腺病毒E1B相互作用蛋白3(BNIP3)通路[29]等。MIF是一种多效性炎症细胞因子。最近许多研究表明,MIF在缺血预处理诱导的心肌保护中发挥潜在的作用[17]。本研究发现,Sev能够通过MIF因子发挥与Dex的协同保护作用。敲低MIF后,Sev对Dex心肌保护的协同作用将被抵消;而过表达MIF将进一步增强Sev对Dex心肌保护的协同保护功能。
虽然本研究未深入探讨Sev是否通过microRNA发挥调节MIF因子表达并协同Dex对心肌实现保护功能。但初步证明Dex联合Sev-postC能够进一步发挥对I/R心肌的保护功能,而且这种协同增效的作用是通过MIF因子实现的,这为临床应用Dex与Sev等缓解心肌再灌注损伤提供了有力的临床前动物模型水平的研究数据。总之,本研究证实Sev-postC通过MIF因子增强Dex对MI/RI小鼠的心肌保护作用。

