基于列线图构建尿毒症高通量血液透析患者心力衰竭的预测研究
刘兴芽 王清英 徐建英

【摘要】 目的 探讨基于列线图构建尿毒症高通量血液透析(HFHD)患者心力衰竭预测模型的临床价值。方法 选取2021年5—12月新干县人民医院收治的115例终末期尿毒症行HFHD患者,将患者分为心力衰竭组(45例)、未发生心力衰竭组(70例)。对比发生与未发生心力衰竭患者的基础资料,根据Logistics多因素回归结果建立列线图模型。结果 单因素分析显示,年龄、透析龄、心血管病史、糖尿病史、QT间期离散度与心力衰竭发生关系密切(P<0.05)。将上述有明显差异的变量纳入多因素回归分析,年龄≥60岁、透析龄≥36月、QT间期离散度≥63 ms为影响尿毒症HFHD患者心力衰竭发生的独立危险因素(P<0.001)。该列线图模型初始C-index为0.718,采用重复Bootstrap自抽样方法验证后C-index为0.723,且经Hosmer-Lemeshow检验该模型拥有良好的区分度和一致性(χ2=8.123,P=0.633)。结论 基于年龄、性别、透析龄、心血管病史4个影响因素搭建列线图模型能够针对HFHD拥有较好的区分度,将会对降低心力衰竭发生率以及改善预后具有较为显著的社会及经济效益。
【关键词】 列线图; 尿毒症高通量血液透析; 心力衰竭
中图分类号:R459.5 文献标识码:A
文章编号:1672-1721(2023)29-0024-03
DOI:10.19435/j.1672-1721.2023.29.008
尿毒症为肾脏终末期表现,可引起疲乏、水肿等症状,由于肾脏难以发挥正常功能,较多毒性物质及代谢终产物潴留于体内,形成持续微炎症状态[1-2]。尿毒症患者采用高通量维持性血液透析(HFHD)可在治疗过程中利用维持性血液透析代替肾脏功能,进而代谢毒性物质,纠正水电解质紊乱,稳定内环境。临床研究显示,炎症可加速动脉粥样硬化进展,增加不良心血管事件发生的风险。HFHD能够帮助患者清除体内中大分子毒素及炎症物质,减轻炎症反应,降低心血管疾病的发生率[3-4]。针对许多尿毒症患者经过HFHD治疗仍然出现心力衰竭情况,需要着重关注相关的危险因素,及早干预,以预防并减少心血管不良事件的发生。通过列线图构建HFHD患者的心力衰竭预测模型至关重要[5]。在尿毒症HFHD患者与普通人群之间,每个风险因素所表现的评分模型存在巨大差异,因此构建一个基于尿毒症HFHD患者发生心力衰竭事件的模型十分有必要。鉴于此,本研究旨在构建并绘制一个基于尿毒症HFHD患者发生心力衰竭事件模型相应的列线图预测模型,以便能够有效预测尿毒症HFHD患者心力衰竭事件的发生。
1 资料与方法
1.1 一般资料 选取2021年5—12月新干县人民医院收治的115例终末期尿毒症行HFHD患者,将患者分为心力衰竭组(45例),未发生心力衰竭组(70例)。收集影响心力衰竭发生的相关因素,对比发生与未发生心力衰竭患者的资料,根据Logistics多因素回归结果建立列线图模型。纳入标准:符合终末期尿毒症诊断标准;年龄≥18岁,性别不限;开展HFHD≥3个月。排除标准:合并恶性肿瘤者;存在心力衰竭史者;更换家庭住址、个人信息资料者;中途退出研究者;随访资料不全者。剔除标准:研究中选择退出或失访患者;耐受性及依从性较差,无法保证按时治疗者。
1.2 方法 所有患者均接受HFHD治疗,并进行长期随访。(1)基线资料统计方法。设计一般资料调查问卷,收集患者性别、年龄、体质量指数、原发病、透析龄、QT间期离散度、心血管病史、脑血管病史、糖尿病、高血压等基础资料。(2)心力衰竭评估方法。随访6个月,统计心力衰竭发生情况,心力衰竭患者符合《中国心力衰竭诊断和治疗指南2014》中心力衰竭的诊断标准,经过CT、核磁共振等检查确诊为心力衰竭。
1.3 统计学方法 采用SPSS 23.0统计学软件分析数据,计量资料以x±s表示,采用t检验,计数资料以百分比表示,采用χ2检验,等级资料以秩和检验,多因素使用Logistic回归分析,通过受试者工作特征(ROC)曲线并采用1 000次Bootstrap自法检验模型区分度。采用Hosmer-Lemeshow检验评价模型一致性,P<0.05為差异有统计学意义。
2 结果
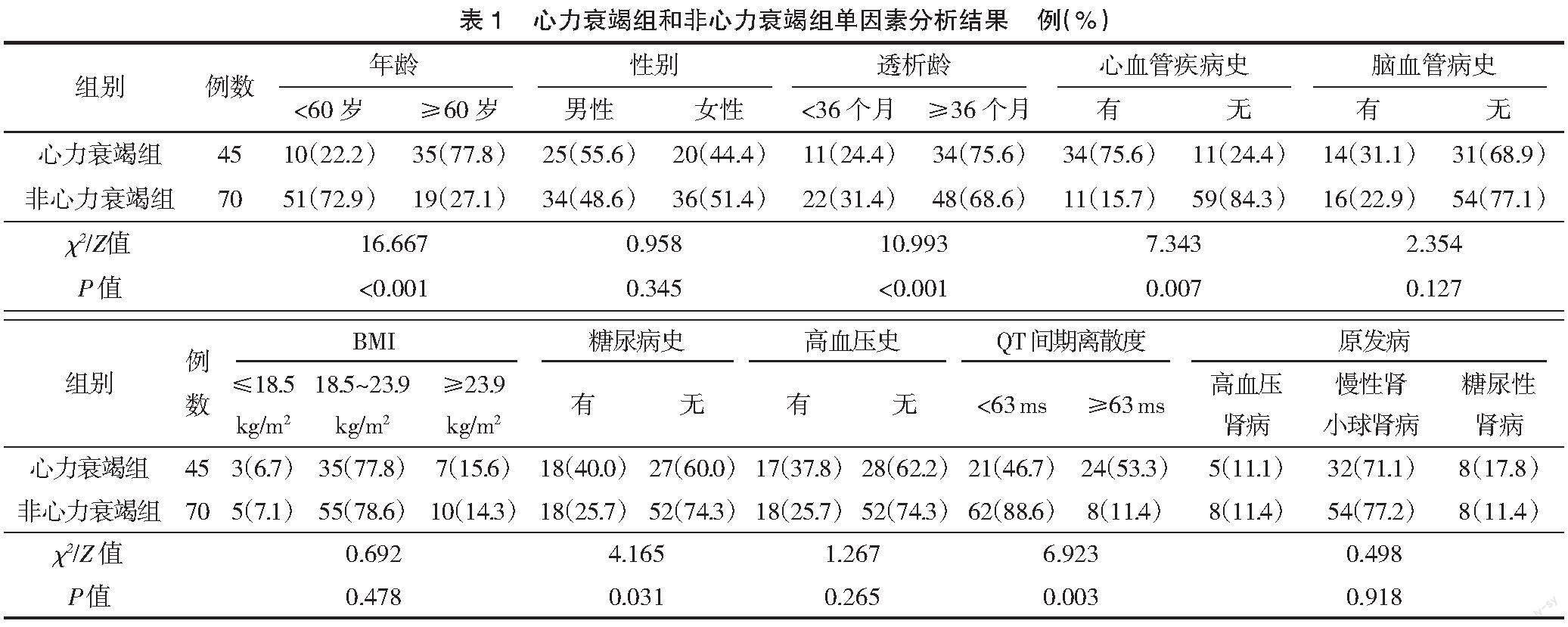
2.1 单因素Cox回归分析 单因素分析结果显示,年龄≥60岁、透析龄≥36个月、心血管病史、糖尿病史、QT间期离散度是尿毒症HFHD患者发生心力衰竭的危险因素(P<0.05),见表1。
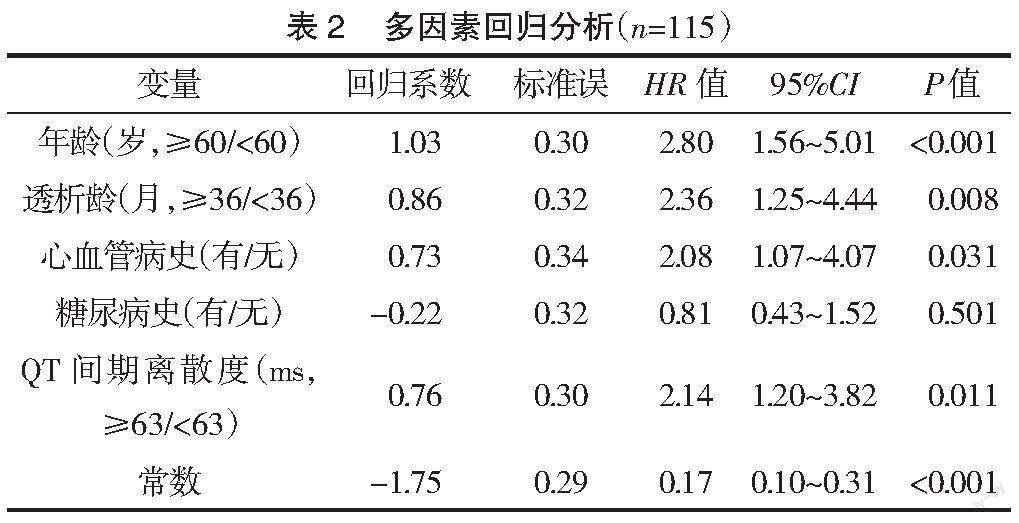
2.2 多因素Cox回归分析 多因素分析显示,年龄≥60岁、透析龄≥36个月、QT间期离散度≥63 ms是尿毒症HFHD患者发生心力衰竭的独立危险因素(P<0.05),见表2。
2.3 尿毒症HFHD患者列线图模型构建与评估 借助获得的多因素回归系数(β)进行列线图模型构建,评分模型的计算公式为Cox(p)=-1.75+1.03(年龄≥60=1)+0.73x(存在心血管疾病史=1)+0.86x(透析龄≥36=1)+0.76x(QT间期离散度≥63=1)。1个尿毒症HFHD患者年龄≥60岁,年龄轴画定向垂直线,得出该例患者的分数为100分,同理无心血管疾病史为0分,透析龄≥36个月为80分,QT间期离散度≥63 ms为70分,该例患者的总分为250分。然后从总分轴处画出风险垂直线,得出该名尿毒症HFHD患者的发生心力衰竭的风险为70%,见表3。
该列线图模型初始一致性指数(index of concordance,C-index)为0.718,采用重复Bootstrap自抽样方法验证后C-index为0.723,且经Hosmer-Lemeshow检验该模型拥有良好的区分度和一致性(χ2=8.123,P=0.633)。研究得出本次模型初始C-index数据为0.719(95%CI为0.652~0.786),见图1。然后利用重复Bootstrap自抽样方式对数据进行1 000次内部验证得出C-index数据为0.722(95%CI为0.656~0.788),见图2。之后利用Hosmer-Lem-eshow检验得出χ2=8.124,P=0.632。由此可见本研究建立的列线图模型具备良好的区分度和一致性。
3 讨論
尿毒症的主要治疗方式是血液透析。在血液净化技术发展下,维持性血液透析运用十分广泛,已经成为治疗尿毒症的首选疗法。在开展高通量维持性血液透析过程中,由于该疗法代替了人体的肾脏代谢功能,极易引起体内的炎症反应,在一定程度上会加速动脉粥样硬化,从而提升心血管事件发生概率。人体的心肾功能是互相影响的,肾功能降低与心力衰竭密切相关。心血管疾病是血液透析患者主要死亡原因,占维持性血液透析死亡患者的40%以上,包括心力衰竭、动脉粥样硬化性心脏病等,其中以心力衰竭为主[6-7]。可见,降低尿毒症血液透析患者心力衰竭发生率较为重要。研究表明,维持性血液透析治疗1 年以上的尿毒症患者大部分会出现心功能减退、心脏结构改变等,多数患者会出现左室心肌肥厚和左室舒张功能减退,患者发生心力衰竭的风险较高[8-9]。HFHD能减少血膜反应、氧化应激和炎症反应,清除中大分子毒素,减轻体内炎症反应,降低心血管疾病的发生率。即使接受HFHD治疗,仍有较多尿毒症患者出现心力衰竭。因此,构建尿毒症HFHD患者心力衰竭的预测模型较为重要[10]。
尿毒症患者主要并发症是心血管疾病,这也是尿毒症血液透析患者死亡的主要原因,其中以心力衰竭为主。对尿毒症血液透析患者进行心力衰竭发生风险的评估十分重要,以便于采取一级预防措施、开启早期治疗、调整治疗方案,从而改善预后[11]。疾病的发生包含多种病理生理途径,单一的生物标志物无法全面评估心力衰竭的发生风险。若将多种生物标志物纳入风险模型,或许可以提升预测的准确度[12]。本次临床研究纳入尿毒症HFHD患者作为研究对象,收集年龄、性别、透析龄等相关影响因素,对比发生与未发生心力衰竭患者的资料,根据Logistics多因素回归结果建立列线图模型。单因素分析结果显示,年龄、透析龄、心血管病史、糖尿病史、QT间期离散度是尿毒症HFHD患者发生心力衰竭的危险因素(P<0.05)。将上述有明显差异的变量纳入多因素回归分析中,年龄≥60岁、透析龄≥36个月、QT间期离散度≥63 ms是尿毒症HFHD患者发生心力衰竭的独立危险因素(P<0.001)。该列线图模型初始C-index为0.719,1 000次内部验证后C-index为0.722,且经Hosmer-Lemeshow检验该模型拥有良好的区分度和一致性(χ2=8.123,P=0.633)。
本次试验中年龄≥60岁是一项独立危险因素,将该因素列入模型中是因为年龄较大的患者身体机能较差,本身合并较多基础病。透析龄≥36个月是一项独立危险因素,这是因为透析时间越长,患者自身的肾功能衰竭情况越严重,患者体内会出现尿毒症毒素潴留,肾功能容量负荷加大,动静脉内瘘加重,以上种种原因均会加大心力衰竭事件发生的概率。QT间期离散度≥63 ms也是一项独立危险因素。QT间期离散度增加可能是因为在透析过程中为快速纠正酸中毒,导致人体离子交换异常或心肌细胞膜酸碱度失衡,患者在透析过程中会失去大量水分,进而引发交感神经兴奋,最终导致心肌细胞异常。
综上所述,基于列线图构建尿毒症HFHD患者心力衰竭的预测模型拥有良好的区分度和一致性。关注人群特殊性,将各种可能的影响因素全面纳入风险模型,能够提升预测的准确性,旨在为及早预测尿毒症HFHD患者心力衰竭的发生提供新的思路,降低病死率,从而改善患者预后。
参考文献
[1] 党晓莉,张作鹏,冯菁,等.高通量血液透析对尿毒症患者微炎症及营养不良的影响[J].临床和实验医学杂志,2020,19(7):754-757.
[2] LI F,WANG Y,SUN L,et al.Vancomycin-resistant enterococ-cus faecium pneumonia in a uremic patient on hemodialysis:a case report and review of the literature[J].BMC Infect Dis,2020,20(1):167.
[3] LU Y C,WU C C,TSAI I T,et al.Associations among total p-cresylsulfate, indoxyl sulfate and hippuric acid levels with hemodialysis quality indicators in maintenance hemodialysis patients[J].Clin Chim Acta,2021,516(65):83-91.
[4] 梁玉枫,陈勇平,涂淑珍,等.预测自体动静脉内瘘成熟的列线图模型的建立[J].中国血液净化,2019,18(2):110-114.
[5] 许武红,邹原方,梁翔.血栓调节蛋白升高是维持性血液透析患者心血管疾病的危险因素[J].中国血液净化,2015,14(4):224-226.
[6] 郑雅,张开贵,徐静.个体化预测维持性血液透析患者发生医院感染的风险列线图模型的建立[J].中国中西医结合肾病杂志,2021,22(5):448-451.
[7] 杨文领,何莲,李育梅,等.维持性血液透析患者血氧化三甲胺与心力衰竭的相关性及其影响因素[J].中华肾脏病杂志,2021,37(2):121-129.
[8] 吴艺青,陶静,华建武,等.维持性血液透析患者高透析间期体重增长与营养状态的关系[J].中国中西医结合肾病杂志,2018,19(5):440-442
[9] 李富强.血液透析和腹膜透析对慢性肾衰竭尿毒症患者微炎症状态的影响及与心血管疾病的关系[J].临床内科杂志,2019,36(11):748-750.
[10] 梅游英,余晓玲,孔曼丽,等.预测维持性血液透析患者心血管事件发生风险列线图模型的建立[J].中国血液净化,2020,19(2):108-112.
[11] 李友河,彭翔,薛志强,等.维持性血液透析患者心电图QT间期离散度与心血管事件的相关性[J].海南医学,2018,19(2):108-112.
[12] 刘爱群,陈剑敏,朱丽娜,等.慢性肾衰规律血透患者QT间期离散度与室性心律失常的相关性研究[J].国际泌尿系统杂志,2016,36(4):584-587.

