上皮性卵巢癌患者血清外泌体miR-200c与组织NRP1表达、辅助化疗反应及预后的关系
赵晓娟,魏珂,高隽,靳新星,董菲
(咸阳市第一人民医院 妇科,陕西 咸阳 712000)
上皮性卵巢癌症(epithelial ovarian cancer,EOC)占所有类型卵巢癌(ovarian cancer,OC)病例的90%,其特征是组织病理学、临床和分子异质性[1-2]。EOC确切病因仍不清楚[3],不良结局与延迟诊断以及耐药肿瘤细胞的持续存在有关[4-5]。对于晚期疾病,通常无法经手术治疗[6]。为了改善这些患者的预后,迫切需要具有高灵敏度和特异度的无创快速诊断方法。微小RNA(microRNA,miRNA)是19~25个核苷酸的小非编码RNA,可以通过与互补的靶mRNA杂交来调节基因表达,导致mRNA降解或直接抑制翻译[7]。miRNA为人类基因表达提供了一种新的调控机制,并在多种生物过程中发挥重要作用[8]。尤其是存在于循环外泌体中的miRNA,其结构稳定,被认为是多种病理机制中有价值的生物标志物来源之一[8-9]。miR-200c是miR-200家族成员,其表达失调与OC的发生发展和耐药性密切相关[10-11]。它可以通过促进上皮间质转化、侵袭性、肿瘤生长和转移来充当肿瘤促进剂[11]。另外,miR-200c过表达可改善不同类型癌症(包括OC)对各种化疗药物的反应,并且其低表达与获得性耐药有关[10,12]。神经纤毛蛋白1(neuropilin1,NRP1)是一种跨膜糖蛋白,已被证明在肿瘤发生、癌症侵袭和血管生成中发挥关键作用[13]。据报道,NRP1表达在OC组织中上调,并与OC分级分期、多药耐药性和预后不良有关[14-15]。最近,有研究指出miR-200c可通过靶向NRP1使耐药的OC细胞敏感[10]。但血清外泌体miR-200c与NRP1的关系及其在预测OC患者化疗反应和预后中的应用价值尚未见报道。本研究通过分析EOC患者血清外泌体miR-200c表达与组织NRP1表达、辅助化疗反应及预后的相关性,以确定miR-200c作为肿瘤生物标志物的潜力。
1 对象与方法
1.1 研究对象
选取2018年2月至2022年10月在我院诊治的135例新诊断的EOC(112例浆液性、5例黏液性、12例子宫内膜样、6例透明细胞癌)和30例良性肿瘤(20例浆液性和10例黏液性)患者。收集135例EOC患者的癌组织、48例癌旁正常卵巢组织(距癌组织>2 cm)以及30例良性肿瘤组织样本,另收集所有参与者的血清(EDTA-K2抗凝剂)样本,储存在-20 ℃直至使用。两组患者年龄相匹配,分别为31~88(64.53±12.19)岁和28~85岁(63.40±15.50)岁,具有可比性(P>0.05)。入选标准:病理学确诊,所有患者均有手术卵巢组织可用;EOC患者接受初级减瘤手术和术后标准化疗。排除标准:既往或伴发其他癌症或分析用组织材料不足,未完成标准化疗方案的EOC患者。本研究遵循《赫尔辛基宣言》,已获得医院医学伦理委员会审核批准,所有受试者均出具书面知情同意书。通过电子病历获取EOC患者的临床特征,包括年龄、体重指数(body mass index,BMI)、绝经状态、国际妇产科学联合会(International Federation of Gynecology and Obstetrics,FIGO)分期、组织学分级、组织学分型、残余肿瘤、化疗周期。
1.2 EOC治疗及效果评估
EOC患者根据FIGO分期系统[16]进行分期,并根据世界卫生组织(World Health Organization,WHO)分级系统进行分级。患者在术前3 d采集血清样本,将术中新鲜的手术组织样本保存在液氮中,随后制作石蜡包埋(formalin-fixed and parrffin-embedded,FFPE)组织块,连续切片后进行免疫组化分析。手术结果定义为完全细胞减灭(无肉眼可见肿瘤)、最优细胞减灭(肿瘤<1 cm)或次优细胞减灭(肿瘤>1 cm)。118例EOC患者术后根据美国国家综合癌症网络(national committee on computer network,NCCN)卵巢癌临床实践指南[17],完成了至少6个标准疗程的卡铂5.0~7.5曲线下面积(area under curve,AUC)和紫杉醇175 mg·m-2的化疗方案,且具有可分析的化疗结果数据。当化疗完成后>6个月无复发时,视为铂敏感肿瘤。耐药患者被定义为原发性化疗难治性患者(尽管接受了一线化疗,但仍有进展)或化疗完成后≤6个月复发。无进展生存(progression-free survival,PFS)期被定义为从初次手术到疾病进展或复发、死亡或仍活着患者的最后随访日期的时间。总生存(overall survival,OS)期计算为从手术日期到任何原因死亡的时间,或到2023年1月17日的时间,以先到者为准。
1.3 血清外泌体提取及特征鉴定
通过血清总外泌体分离试剂(美国Thermo Fisher Scientific公司)分离总外泌体。2 000 r·min-1离心30 min,以去除细胞和细胞碎片,取上清液与总外泌体分离试剂在4 ℃孵育30 min,10 000 r·min-1离心10 min,弃上清,将外泌体颗粒重悬于磷酸盐缓冲液(phosphate buffer saline,PBS)中。通过透射电子显微镜(日本JEOL JEM-2100Plus)观察分离的外泌体形态,粒径分布使用纳米颗粒跟踪分析仪(英国马尔文NanoSight LM10)检测。提取的外泌体质量通过蛋白免疫印迹法验证,使用外泌体标志物CD63作为阳性指标,Calnexin蛋白作为阴性对照,抗体均购自英国Abcam公司。
1.4 血清外泌体miR-200c水平检测
使用TRIzol试剂(美国Invitrogen公司)从外泌体颗粒中提取总RNA。分离RNA的纯度由Nanodrop ND-1000分光光度计测定(美国Thermo Fisher Scientific公司)。使用TaqMan microRNA逆转录试剂盒(美国Applied Biosystems公司)对提取的RNA进行逆转录得到互补DNA。在美国Bio-Rad C1000 Touch实时PCR系统上进行实时荧光定量PCR(qPCR)扩增:95 ℃下进行10 min,95 ℃下进行10 s,60 ℃下进行60 s,共进行40个循环。以U6为内参,采用2-ΔΔCt法计算miR-200c相对表达水平。引物序列:miR-220c正向引物序列5′-CTCGTCTTACCCAGCAGTGTT-3′,反向引物序列5′-CTCCATCATTACCCGGCAGT-3′;U6正向引物序列5′-AGAAGATTAGCATGGCCCCT-3′,反向引物序列5′-ATTTGCGTGTCATCCTTGCG-3′。
1.5 组织NRP1表达检测
手术时收集所有组织样本,进行免疫组织化学(immunohistochemistry,IHC)染色分析。将FFPE组织切片(约4 μm厚)用二甲苯脱蜡,在分级乙醇中再水化。将切片置于pH 9.0的乙二胺四乙酸溶液内,在95 ℃水浴进行30 min抗原修复。用3%过氧化氢溶液去除内源性过氧化物酶。将组织用5%山羊血清(美国Dako公司)封闭,依次用一抗(NRP1抗体,ab81321,英国Abcam公司)在4 ℃孵育过夜,二抗在室温下孵育1 h,二氨基联苯胺显色溶液孵育10 min。切片用苏木精溶液复染,DPX封片,用日本Nikon H600L显微镜观察。由两名病理学专家对染色图像进行独立评估,并根据染色强度和染色细胞的比例使用半定量综合评分法进行量化:免疫反应性评分(immune reactivity score,IRS)取决于染色强度(stain index,SI)和阳性细胞的百分比(positive cell percentage,PP),IRS=SI×PP。SI:无色为0分,浅黄色为1分,棕黄色为2分,棕褐色为3分。PP:阴性细胞为0分,阳性细胞≤10%为1分,阳性细胞11%~50%为2分,阳性细胞51%~100%为3分。IRS:≤1分为阴性表达,>1分为阳性表达。
1.6 统计学处理
使用SPSS26.0软件处理数据。采用Kolmogorov-Smirnov检验进行正态性检验,偏态分布数据以中位数(M)和四分位数间距(IQR)表示,并进行Mann-WhitneyU分析。二分类变量以率或构成比表示,并进行卡方检验。使用受试者共作特征(receiver operating characteristic curve,ROC)曲线分析血清外泌体miR-200c对EOC患者鉴别诊断以及化疗反应的预测价值。使用Cox风险比例回归模型和Kaplan-Meier法生存曲线分析血清外泌体miR-200c与预后的关系,并进行Log-rank检验。双侧P<0.05为差异具有统计学意义。
2 结 果
2.1 血清外泌体获取及鉴定
血清中分离出的囊泡大小约为100 nm(图1),通过透射电子显微镜观察显示单层膜囊泡,呈典型的圆盘状;纳米跟踪分析仪显示囊泡直径平均为100 nm。为了确认提取的外泌体质量,对外泌体特征蛋白CD63和Calnexin的表达进行了蛋白免疫印迹分析,结果显示外泌体标记CD63呈阳性表达,Calnexin呈阴性,表明外泌体确实已充分纯化。

A.透射电镜观察;B.纳米粒径追踪分析外泌体粒径分布;C.外泌体标志膜蛋白CD63和Calnexin表达
2.2 组织中NRP1表达
经IHC分析,NRP1主要表达于EOC肿瘤细胞的胞核和胞质中,偶见于癌旁正常卵巢组织和良性肿瘤组织微血管内皮细胞的胞浆中,见图2。与良性肿瘤组织(n=30)相比,EOC组织(n=135)中NRP1蛋白阳性表达率更高[42.22%(57/135)vs. 6.67%(2/30),χ2=13.509,P=0.000 2];EOC组织中NRP1蛋白阳性表达率高于癌旁正常卵巢组织[60.42%(29/48vs. 10.42%(5/48),χ2=26.231,P<0.001)]。
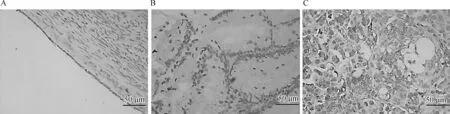
A.癌旁正常卵巢组织;B.良性肿瘤组织;C.EOC组织
2.3 两组血清外泌体miR-200c表达差异
与良性肿瘤组患者相比,EOC组患者血清外泌体miR-200c表达水平显著降低[0.42(0.35,0.60)vs.0.97(0.85,1.08),Z=-8.255,P<0.001],见图3A。ROC曲线(图3B)显示,血清外泌体miR-200c水平可良好地区分EOC组和良性肿瘤组,曲线下面积(AUC)为0.955(95%CI0.921~0.989),在最佳临界值(0.78)时,其灵敏度和特异度分别达到0.867(95%CI0.831~0.897)和0.933(95%CI0.917~0.947)。

A.箱式图;B.ROC曲线
2.4 EOC患者血清外泌体miR-200c表达与组织NRP1表达的关系
NRP1阳性患者血清外泌体miR-200c表达水平显著低于阴性患者[0.36(0.26,0.43)vs.0.50(0.40,0.72),Z=-5.591,P<0.001]。血清外泌体miR-200c水平与组织NRP1表达呈负相关(Spearman’sr=-0.483,P<0.001)。
2.5 EOC患者血清外泌体miR-200c水平与其他临床病理特征关系
根据血清外泌体miR-200c表达中位值,将所有EOC患者分为miR-200c低表达组(<0.42)和高表达组(≥0.42)。EOC患者血清外泌体miR-200c低表达与FIGO分期更高、NRP1阳性表达有关(P<0.05),与其他临床特征和手术结局无关(P>0.05),见表1。
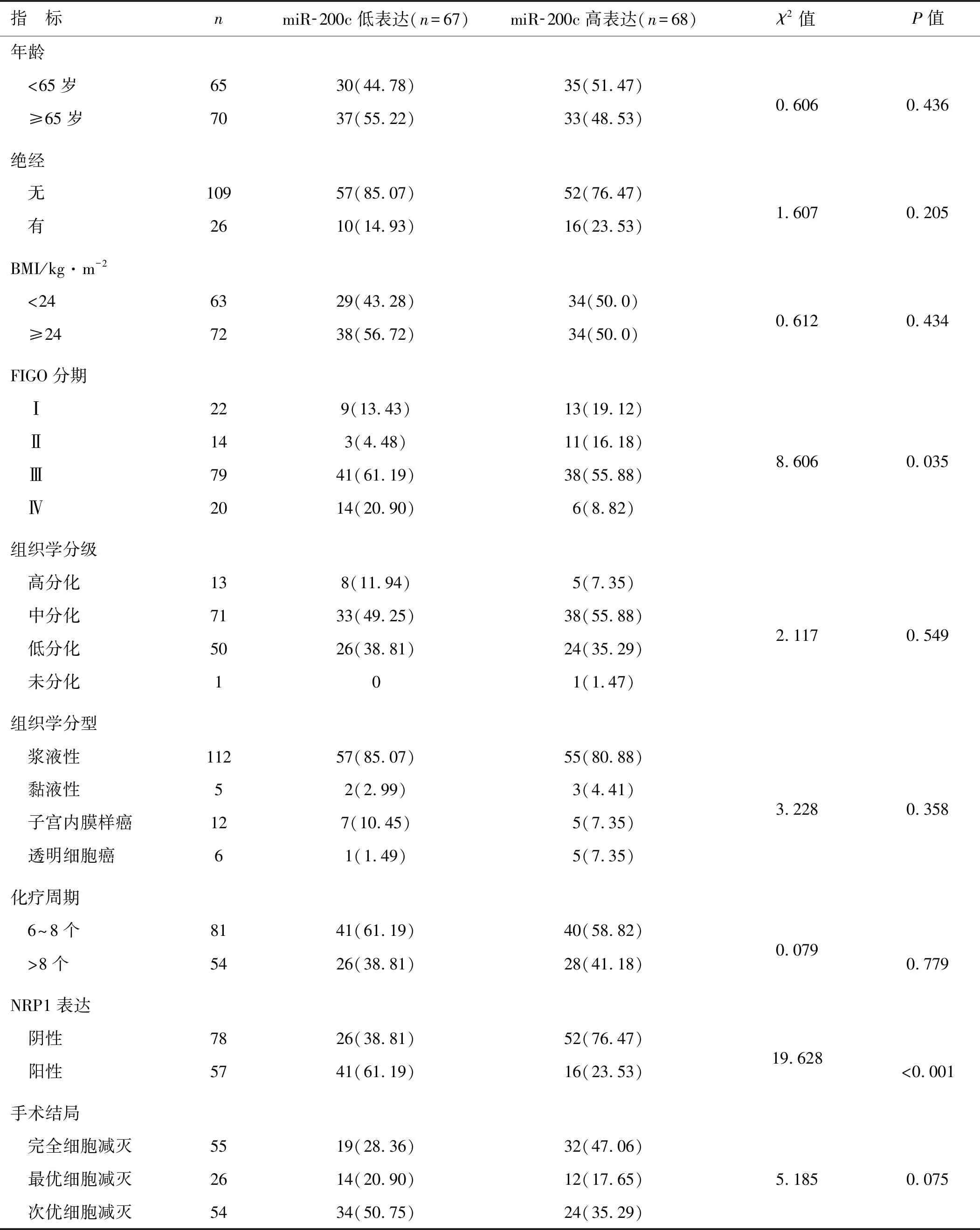
表1 血清外泌体miR-200c水平与EOC患者临床病理特征的关系 例
2.6 血清外泌体miR-200c水平与化疗反应的关系
118例患者完成术后辅助标准化疗后,83例化疗敏感,35例化疗耐药(31例化疗完成后≤6个月复发,4例为原发性化疗难治)。化疗耐药组患者血清外泌体miR-200c表达水平显著低于化疗敏感组[0.35(0.24,0.40)vs. 0.52(0.42,0.67),Z=-5.930,P<0.001],见图4A。血清外泌体miR-200c水平预测EOC患者化疗反应的AUC为0.846(95%CI0.769~0.924),对应临界值为0.41,最佳灵敏度和特异度分别为0.795(95%CI0.769~0.824)和0.829(95%CI0.804~0.840),见图4B。

A.箱式图;B.ROC曲线
2.7 预后分析
将单因素分析中P<0.05的变量作为自变量进一步纳入多因素Cox回归分析,预后作为因变量(生存/无进展赋值为0,死亡/疾病进展赋值为1)。多因素Cox回归分析结果显示,血清外泌体miR-200c低表达是EOC患者OS和PFS预后的独立影响因素(P<0.05),见表2。
2.8 Kaplan-Meier生存曲线
血清外泌体miR-200c低表达组和高表达组患者5年OS率分别为49.3%(33/67)和70.6%(48/68),中位OS期分别为21.90、27.13个月(Log-rankχ2=10.192,P=0.001),见图5A。血清外泌体miR-200c低表达组和高表达组患者5年PFS率分别为16.4%(11/67)和33.8%(23/68),中位PFS期分别为14.90、19.23个月(Log-rankχ2=7.987,P=0.005),见图5B。血清外泌体miR-200c高表达组OS和PFS预后明显优于低表达组(P<0.05)。

A.血清外泌体miR-200c表达与OS的关系;B.血清外泌体miR-200c表达与PFS的关系
3 讨 论
在过去几十年中,手术和化疗方案的进步使OC的死亡率呈下降趋势,但它仍然是全球所有妇科恶性肿瘤中死亡率最高的癌症[1-2]。化疗耐药已成为EOC有效治疗的阻碍[5]。因此,需要寻找有助于监测化疗反应和预测患者生存率的新型可靠生物标志物。许多证据表明血清外泌体miRNA在各种癌症(包括EOC)中作为生物标志物的潜力[7-8]。在本研究中,我们评估了EOC患者血清外泌体miR-200c水平的临床意义,并证明血清外泌体miR-200c与组织NRP1呈负相关,可以作为预测EOC化疗反应和预后的有希望的生物标志物。
越来越多的证据表明,miR-200c的异常表达参与EOC的发生以及化疗耐药性[10-11]。miR-200c是miR-200家族的成员,可参与多种生物过程如细胞周期、血管生成和上皮间质转化[18]。据报道,它在EOC中高表达,可能有助于上皮间质转化、侵袭性、肿瘤生长和转移[11]。另外,miR-200c的丢失与不同类型癌症(包括EOC)对各种化疗药物的获得耐药性有关,是各种癌症化疗耐药性的重要且有前途的调节剂[10,12]。例如,Vescarelli等[11]报道miR-200c的过表达通过调节NRP1表达逆转了OC细胞对奥拉帕尼的耐药性。NRP1是一种跨膜糖蛋白,已被证明通过激活血管内皮生长因子、磷脂酰肌醇3激酶和蛋白激酶 B通路在肿瘤发生、癌症侵袭和血管生成中发挥关键作用[13-14]。据报道,NRP1在EOC中表达上调,可通过逃避接触抑制促进EOC无限生长,并且其高表达与EOC较短的生存期相关[11]。一项全面的生物信息学网络分析表明,NRP1参与OC的多药耐药性[15]。miR-200家族的一些miRNA已被证明与NRP1 3′非翻译区相互作用,并负调节NRP1信号传导[11]。此外,Huang等[10]发现miR-200c可通过调节寿命蛋白水平增加EOC细胞对顺铂治疗的敏感性。其他研究也报告了EOC中miR-200c表达与紫杉醇和卡铂耐药性之间的相关性[12],上述研究证实了miR-200c是EOC化疗耐药性的重要影响因素。此外,许多研究提示miR-200c表达失调与EOC侵袭性和预后不良有关[19-20]。总之,这些研究结果提示miR-200c参与调节EOC化疗耐药,并且与EOC进展和预后密切相关。
最近的研究表明,血清外泌体miRNA在EOC中异常表达,有希望作为EOC的发生和进展的生物标志物[6-7]。而在本研究中,我们发现化疗耐药患者血清外泌体miR-200c水平低于化疗敏感患者,提示术前血清外泌体miR-200c低表达与化疗耐药有关,也证明了miR-200c是EOC化疗耐药的相关因素。而且血清外泌体miR-200c水平在区分化疗耐药患者和化疗敏感性患者方面具有显著的预测价值。此外,本研究还发现 NRP1阳性患者血清外泌体miR-200c表达水平显著低于阴性患者,血清外泌体miR-200c表达与组织NRP1表达之间呈负相关。因此,我们推测血清外泌体miR-200c可能通过靶向NRP1影响EOC化疗耐药,miR-200c/NRP1轴可能是该肿瘤潜在有价值的治疗靶点。此外,Cox回归分析显示,血清外泌体miR-200c低表达是EOC患者OS和PFS预后不良的独立危险因素,且血清外泌体miR-200c低表达的患者比高表达的患者具有更短的PFS期和OS期,这提示了血清外泌体miR-200c低表达在评估EOC患者预后不良中的潜在作用。总之,本研究结果提示血清外泌体miR-200c有希望用于筛查化疗耐药高危风险患者和预测EOC患者的预后,以及用于靶向治疗。
综上,本研究表明血清外泌体miR-200c低表达与组织NRP1高表达、化疗耐药及预后不良有关。血清外泌体miR-200c可用作预测EOC化疗反应和预后的有希望的生物标志物。但本研究有几个局限性,例如本单中心研究中应用的样本量是有限的,而且缺乏机制研究。因此,有必要研究miR-200c在EOC细胞系中的调节机制,并在更大的患者队列中扩大和证实上述观察结果。

