MYBL2在淋巴结阳性前列腺癌组织中的表达及其对雄激素剥夺治疗结局的预测作用
付国,程继,高丹
(陕西省人民医院 泌尿外科,陕西 西安 710068)
前列腺癌(PCa)是一种高度异质性肿瘤,尽管在诊断和治疗策略方面取得了巨大进步,但它仍是男性癌症相关死亡的主要原因[1]。根治性前列腺切除术(RP)是局部晚期PCa的一线治疗选择之一[2]。在接受RP和盆腔淋巴结清除术(PLND)的所有PCa患者中,部分患有病理性淋巴结阳性(LNP)疾病,LNP与预后不良密切相关[3]。对于LNP-PCa患者,指南建议辅助雄激素剥夺治疗(ADT)[4]。然而,ADT的耐药性仍然是一个临床挑战。因此,有必要更好地了解耐药性的驱动因素,以制定为LNP-PCa患者提供长期临床益处的治疗策略。能及早预测LNP并识别对ADT反应的预测性生物标志物具有重要的临床意义。骨髓母细胞增生症病毒癌基因同源样蛋白2(MYBL2)是MYB转录因子家族成员之一,在细胞周期进展、细胞生存和恶性转化中起重要调节作用。事实上,MYBL2基因在许多癌症中过度表达,并与患者预后不良相关[5]。MYBL2可以通过调节雄激素依赖性PCa细胞中Rho-GTPasesRhoA和LATS1激酶的活性来促进YAP1转录活性,进而促进去势耐药性生长和转移能力[6]。因此测定MYBL2表达水平可能会影响LNP-PCa的治疗选择。本研究旨在检测MYBL2在PCa组织中的表达水平,并调查其与LNP-PCa患者临床病理特征和ADT辅助治疗预后的关系,最后进行生存分析以评估该生物标志物的预后预测潜力。
1 对象与方法
1.1 研究对象
经我院机构审查委员会批准,共使用80份PCa标本和36份良性前列腺增生(BPH)标本进行回顾性分析。两个队列的研究参与者均签署知情同意书。PCa标本是于2017年2月至2022年6月期间在我院接受RP的PCa患者中采集的,患者年龄48~82岁,平均(66.09±6.45)岁,术前血清前列腺特异性抗原(PSA)水平为23.85 ng·ml-1[四分位间距(IQR)13.74~47.89 ng·ml-1]。纳入标准:(1) 经病理活检证实为PCa,病理学样本由泌尿生殖病理学专家审查;(2) 部分LNP-PCa患者在术后接受了辅助性ADT,最多曾接受过1次细胞毒性化疗、放疗或免疫治疗,前提是这些治疗在ADT开始前4周停止;(3) 东部肿瘤协作组(ECOG)表现状态≤2分,符合血液学和实验室标准,包括血清钾≥3.5 mmol·L-1,天冬氨酸转氨酶(AST)和丙氨酸转氨酶(ALT)<1.5倍正常上限(ULN),血清总胆红素≤1.5倍ULN,左心室射血分数≥50%;(4) 有至少6个月的随访数据。排除标准:患者可能曾接受过任何数量的激素治疗(包括抗雄激素、类固醇、雌激素、非那雄胺、度他雄胺和酮康唑);合并无法控制的并发症、肝病、垂体或肾上腺功能障碍;入组前6个月内出现过临床显著的心血管事件或血栓栓塞以及可能干扰药物吸收的胃肠道疾病;治疗开始后1个月内进行手术或局部前列腺介入治疗;治疗后随访失败。作为良性对照,从因症状性BPH而接受经尿道前列腺电切术(TURP)的患者中采集了36份冷冻的良性前列腺标本,患者年龄43~81岁,平均(65.53±10.34)岁,血清PSA水平为4.56 ng·ml-1(IQR 1.89~8.36 ng·ml-1)。
1.2 治疗及随访
所有PCa患者均接受RP作为初始治疗。64例患者(80.0%)接受了机器人辅助腹腔镜前列腺切除术,16例患者(20.0%)接受了经耻骨后RP。27例经病理证实LNP的患者接受了局限性或扩大PLND,术后进行辅助性ADT,接受阿比特龙(1 000 mg·d-1)和泼尼松(5 mg·d-1)治疗2个4周疗程后,加入高剂量度他雄胺(3.5 mg·d-1),直到研究退出或疾病进展。根据医生的判断,患者接受定期PSA监测和诊断成像[腹部和骨盆的计算机断层扫描和(或)骨盆的磁共振成像,以及骨骼扫描]。
1.3 回顾性资料收集
回顾性收集临床和病理数据,包括患者年龄、首次诊断日期、诊断时的基线Gleason评分(GS)和PSA、进展和死亡日期(如有)。生化复发(BCR)定义为手术后两次连续测量的PSA值大于0.2 ng·ml-1。临床进展(CP)定义为随访期间X线检查证实的疾病(局部复发或远处转移)。无进展生存(PFS)时间定义为从ADT治疗开始到BCR、CP或死亡的时间,或报告患者存活且无疾病进展的最后随访日期。
1.4 免疫组化检测
用二甲苯和分级醇对5 μm厚的福尔马林固定石蜡包埋组织切片进行脱蜡,并用3%H2O2淬灭内源性过氧化物酶活性。将载玻片与MYBL2一级抗体(美国Thermo Fisher Scientific公司)以1∶500的比例孵育。二级抗体以1∶300的比例稀释后额外避光孵育1 h。用奥林巴斯CX41RF显微镜拍摄抗体标记照片。在细胞核和细胞质中观察MYBL2的阳性染色。每次评估随机选择5个视野,并以400倍放大率观察(每个视野至少有200个细胞)。根据阳性细胞的百分比(阴性为0分,<10%为1分,10%~50%为2分,51%~80%为3分,>80%为4分)和染色强度(阴性为0分,弱为1分,中等为2分,强烈为3分)的乘积表示免疫反应性评分(IRS),最终IRS 0~1分被视为阴性,IRS≥2分被认为阳性。
1.5 TCGA前列腺癌数据挖掘
泛癌和基因型-组织表达(GTEx)数据库的MYBL2基因表达数据来自TIMER2.0(http:∥timer.comp-genomics.org/)。PCa数据集(551个样本,转录组RNA-seq数据)的mRNA表达数据和临床信息来自癌症基因组图谱(TCGA)数据库。利用DESeq2包探索mRNA的差异表达。调整后的P<0.05和|log2(倍数变化)|>1作为筛选差异表达基因(DEG)的阈值,用于纠正假阳性结果。应用“pROC”和“timeROC”软件包评估MYBL2的诊断价值,并通过受试者工作特征(ROC)曲线下面积(AUC)分析和比较MYBL2的诊断性能。在TCGA数据库中,根据MYBL2 mRNA表达的中位值将PCa患者分为两组,利用R包“生存”分析两组的生存数据,并通过R包“surviminer”描绘生存曲线(选择“Kaplan-Meier”)。
1.6 统计学处理
所有统计分析均采用R(3.5.2版)和GraphPad Prism(8.00版)软件。连续变量描述为均数±标准差,并行独立t检验比较2组间数据差异。通过卡方检验或Fisher精确检验分析非连续变量。通过生存曲线和对数秩检验分析MYBL2在预测接受ADT的LNP-PCa患者PFS中的风险比(HRs)。进行多变量Cox比例风险回归模型分析,包括GS、RP切缘和MYBL2蛋白表达作为协变量。P<0.05为差异具有统计学意义。
2 结 果
2.1 组织MYBL2蛋白表达
MYBL2蛋白阳性染色呈黄棕色或棕色颗粒,位于细胞膜和细胞质中。PCa组织中阳性表达36例(45.0%),阴性表达44例(55.0%);BPH组织中阳性表达4例(11.11%),阴性表达32例(88.89%),两组之间差异具有统计学意义(χ2=11.171,P<0.001,图1)。
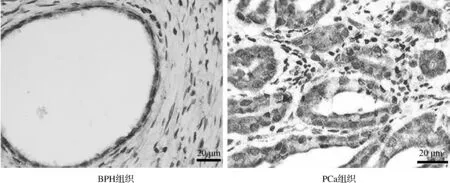
图1 免疫组化分析MYBL2蛋白在BPH组织和高分化PCa组织中的表达情况(×400)
2.2 PCa组织MYBL2蛋白表达与患者临床病理特征的关系
在PCa组患者中,组织MYBL2蛋白表达只与淋巴结转移有关,LNP-PCa患者中组织MYBL2蛋白阳性表达率(63.64%,21/33)高于非LNP-PCa患者(31.91%,15/47,P=0.005)。未观察到PCa组织MYBL2蛋白表达与年龄、体重指数、PCa家族病史、肿瘤GS分级、组织学分级、pT分期RP切缘及基线血清PSA水平之间的关系(P>0.05)。见表1。
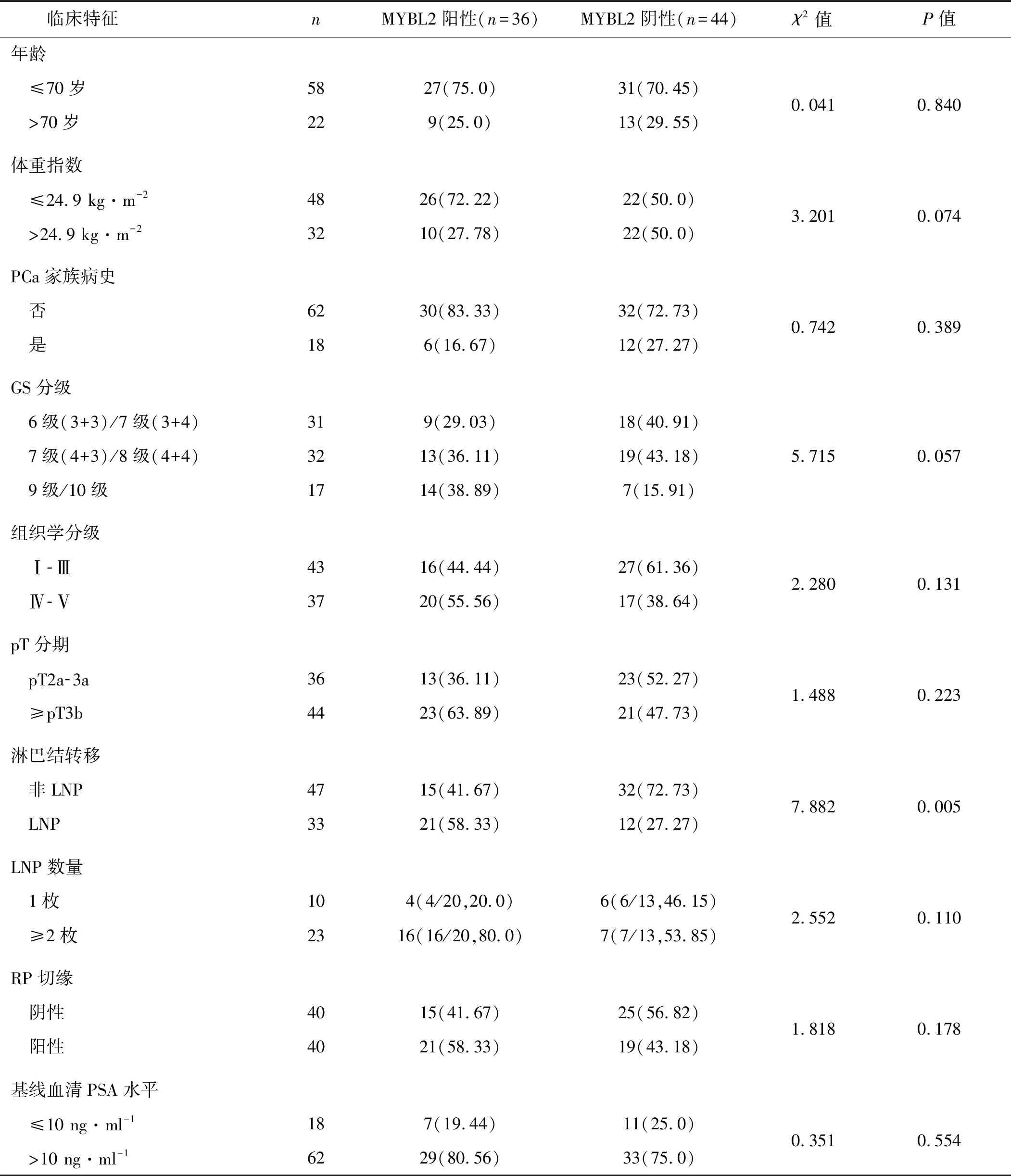
表1 PCa患者组织MYBL2蛋白表达与临床特征的关系 例
2.3 组织MYBL2蛋白表达与LNP-PCa患者ADT治疗结局的关系
27例接受ADT的LNP-PCa患者,RP术后血清PSA水平最低值均≤0.05 ng·ml-1。术后辅助ADT中位持续时间为17.6个月(IQR 11~26个月),中位随访时间为33.0个月(IQR 28~40个月)。随访期间17例患者发生BCF,其中9例发生CP(包括1例局部复发和8例远处转移)。绘制Kaplan-Meier生存曲线,MYBL2阳性表达者中位PFS时间短于MYBL2阴性表达者(30.0个月vs. 64.0个月,Log-rankχ2=19.135,P<0.001),见图2。
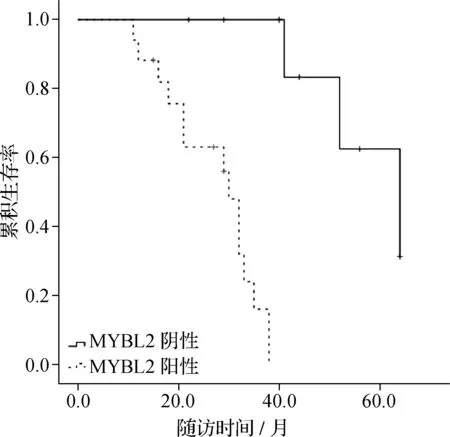
图2 Kaplan-Meier生存曲线分析接受ADT治疗LNP-PCa患者的PFS
2.4 Cox比例风险回归分析
经单因素分析,肿瘤GS分级、组织MYBL2蛋白表达与LNP-PCa患者ADT治疗后PFS有关(P<0.05),见表2。将单因素分析中P<0.01的变量包括肿瘤GS分级、RP切缘、组织MYBL2蛋白表达纳入多因素分析模型,结果显示,组织MYBL2蛋白表达仍然是影响PFS的独立预测因素(P=0.002),见表3。

表2 单因素Cox比例风险回归分析影响LNP-PCa患者PFS的临床因素
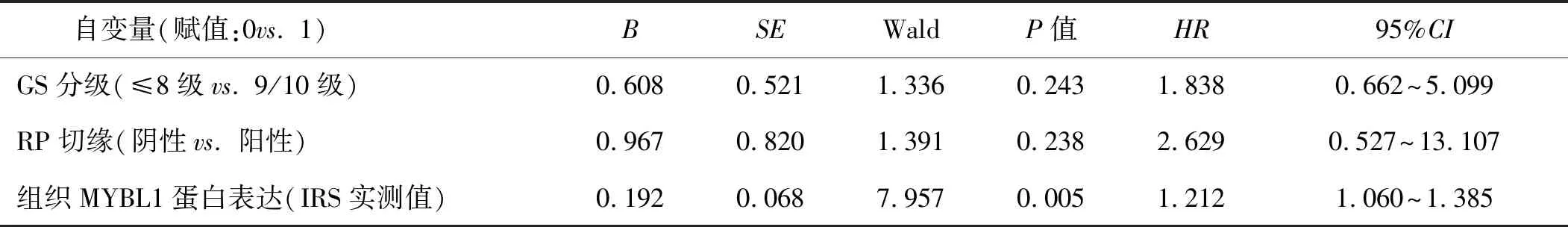
表3 多因素Cox比例风险回归分析影响LNP-PCa患者PFS的临床因素
2.5 生物信息学分析
分析GTEx和TCGA数据库的RNA-seq数据,结果表明,与正常样本相比,19例PCa组织样本(n=499)中MYBL2 mRNA水平较高(P<0.001,图3A)。未配对表达数据分析表明,PCa组织中MYBL2mRNA表达水平显著高于正常组织(P<0.001,图3B);配对表达数据结果显示,在52例PCa组织中MYBL2水平亦显著高于相匹配的癌旁组织(P<0.001,图3C)。此外MYBL2 mRNA高表达与更短的PFS显著相关(P<0.001,图3D)。
3 讨 论
近年来,PCa已成为我国男性第六常见的恶性肿瘤,死亡率也高居前四位[7]。PCa在临床上具有异质性,大多数疾病进展缓慢,但仍有部分患者可迅速发展为骨和LNP,并对ADT产生耐药性,缺乏有效治疗。LNP是局部晚期患者死亡的主要原因[8-9]。PCa的分子异质性是临床异质性的根本原因之一[10],迄今为止的研究尚未系统地解决这一问题。在本研究中,我们将MYBL2假定为PCa的潜在生物标志物,并研究了他与PCa患者临床病理特征以及预后之间的相关性。
MYBL2,也称为B-myb,是骨髓母细胞增生症家族的一种转录因子。它最初被鉴定为v-myb癌基因的细胞同源物,该癌基因已知会导致鸡白血病[11]。MYBL2蛋白是由704个氨基酸组成的,它们形成“SWI3、ADA2、N-CoR和TFIIIB”(SANT)DNA结合域、反式激活域(TA)、保守区(CR)和调节域(RD)。DNA结合结构域和CR几乎与A-MYB和C-MYB相同,并且在不同物种(包括人、动物、线虫等)之间具有高度保守性[12-13]。与A-MYB(主要在B细胞、发育中的中枢神经系统细胞、胚胎中的有丝分裂活性细胞和生殖组织中表达)和C-MYB(在造血前体细胞中表达)不同,MYBL2在所有增殖细胞中都有表达[14]。从功能上讲,MYBL2在调节细胞增殖、增殖细胞分化和细胞周期进展中发挥着关键作用[15]。据报道[6,16],miR-30a可以通过靶向MYBL2抑制PCa的雄激素非依赖性生长;并通过调节Hippo-YAP信号通路控制PCa去势抵抗和转移复发的发展。此外,其他一些与癌症相关的结果[17-20]表明,MYBL2在乳腺癌、肝癌、卵巢癌和皮肤T淋巴瘤中明显扩增,其表达水平与患者预后相关。基于这些数据,我们有理由相信MYBL2可能在PCa的发生和发展中发挥关键作用。在本研究中,我们首先通过IHC检测证实MYBL2蛋白在PCa组织中阳性表达率为45.0%,显著高于BPH组织,且PCa组织MYBL2蛋白表达与淋巴结转移有关,LNP-PCa患者中组织MYBL2蛋白阳性表达率高于非LNP-PCa患者(58.33%vs. 27.27%,P=0.005)。
之前的几项研究[2-4,9]表明,接受RP作为初始治疗的PCa患者中,LNP与预后不良相关。然而目前对于LNP-PCa患者的最佳管理仍不清楚。国家综合癌症网络(NCCN)指南描述了LNP患者辅助治疗的几种选择,即ADT、临床观察或在ADT基础上增加盆腔外照射治疗(RT)。而且与LNP疾病的延迟ADT相比,建议立即给予ADT作为辅助治疗[21]。然而分子异质性导致LNP-PCa患者接受ADT的治疗结局不尽相同。
识别有BCR风险的患者对于指导辅助治疗,从而改善预后至关重要。目前临床上主要依靠医生的判断,以及肿瘤本身的风险分层来观察结果,缺乏有效的预后标志物。在本研究中,根据Kaplan-Meier曲线和多变量Cox回归分析,我们发现组织MYBL2蛋白表达是影响LNP-PCa患者接受ADT后BCR风险的独立预测因素,组织MYBL2阳性表达与更短的PFS相关;这一事实证明了PCa组织中MYBL2表达升高的临床相关性,因此我们有理由认为MYBL2是LNP-PCa的预后标志物之一,但作为治疗选择的预测生物标志物尚不成熟。本研究在患者中的观察数据与既往的体外细胞系研究基本一致,例如,在AR阳性LNCaP细胞系中,沉默MYBL2表达可增强细胞对雄激素剥夺和紫杉醇的敏感性。此外,MYBL2的过度表达可以通过调节Rho-GTPasesRhoA和LATS1激酶的活性来促进YAP1转录活性,从而促进雄激素依赖性PCa细胞的去势耐药性生长和转移能力;重要的是,靶向MYBL2可逆转PCa细胞对ADT的抵抗,并阻断了PCa细胞在体内的骨转移[6,22]。总之,MYBL2是一种PCa细胞系ADT耐药的候选分子机制。
研究癌症基因的分子机制是一项长期的探索。不同肿瘤中基因的分子机制受到复杂网络的影响。公共数据库TCGA和GTEx的使用让应用生物信息学工具进行癌症分析成为可能。我们认为MYBL2可能是LNP-PCa诊断和预后的有效生物标志分子之一。因此最后我们使用了大规模的数据库资源和统计分析,进一步系统地证明MYBL2是PCa恶性进展中的不良预后因素。我们分析了GTEx和TCGA数据库中MYBL2mRNA表达,发现MYBL2在包括PCa在内的许多肿瘤组织中表达上调;且MYBL2 mRNA表达上调与较差的PFS呈正相关,本研究结果与之基本一致。
本研究的结果表明,PCa组织MYBL2蛋白阳性表达率显著高于良性BPH组织,且在LNP-PCa患者的肿瘤组织中MYBL2阳性表达率更高。此外,MYBL2也是接受RP和ADT治疗的LNP-PCa患者中生化复发的独立预测因子。总之,MYBL2可能是PCa中一种新的肿瘤生物标志物,与淋巴结转移以及LNP-PCa患者的预后相关,这为临床靶向治疗策略的发展提供了新的机会。MYBL2在促进PCa进展中的作用及其相关分子机制需要后续实验的补充。

