胃黏膜癌变过程中LncRNAs的表达变化及其与幽门螺杆菌感染的关系
张玉南,陈科,蔡晓刚,陈嘉伟,纪璘,王云飞,张小雪,董盛蓉,占强,安方梅
[南京医科大学附属无锡人民医院 消化内科,南京医科大学无锡医学中心,国家消化系统疾病临床医学研究中心(西安)江苏分中心,江苏 无锡 214023]
国际癌症研究机构2018年发布的全球癌症新发病例统计显示,在全球范围内胃癌仍然是最重要的癌症之一,位居全球第五大最常见癌症和第三大癌症死亡原因[1]。我国的胃癌发病率和死亡率长期位居世界前列,2015年我国新增胃癌患者67.91万例,死亡49.8万例[2]。根据Lauren病理分型肠型胃癌的发生经历慢性非萎缩性胃炎-慢性萎缩性胃炎-肠上皮化生-异型增生-胃腺癌过程,是一个多阶段、多步骤的过程,假如在疾病早期阶段就能及时发现、干预,对于改善患者预后有着重要的作用。国际癌症研究机构和WHO就将幽门螺杆菌(Hp)定义为I类致癌原[3]。肠上皮化生发生于胃黏膜萎缩基础上,为重要的胃癌前病变,但发病机制不清楚。长链非编码RNA(long non-coding RNAs,LncRNAs)是一类转录本长度超过200 nt的RNA分子,通常认为它们并不编码蛋白,而是以RNA的形式在多种层面上(表观遗传调控、转录调控及转录后调控等)参与蛋白编码基因调控[4]。研究发现LncRNAs在胃癌发病中起到关键的调控作用[5],Hp感染后引起LncRNAs的表达异常,胃癌组织中鉴定到的差异表达的LncRNA可能与Hp相关的胃病的发展有关[6]。然而,胃黏膜癌变过程中LncRNAs的表达谱以及与Hp感染的关系目前尚无研究报道。因此,本研究利用高通量测序对慢性浅表性胃炎(chronic superficial gastritis, CSG)、慢性萎缩性胃炎(chronic atrophic gastritis,CAG)、肠上皮化生(intestinal metaplasia, IM)、异型增生(dysplasia, Dys)及胃癌(gastric cancer, GC)中LncRNAs的表达谱进行分析。生物信息学方法基因本体(gene ontology,GO)及京都基因和基因组百科全书(kyoto encyclopedia of genes and genomes,KEGG)信号通路分析对差异表达LncRNAs所调控的功能及信号通路分别进行了分析。进一步利用较大样本量对芯片数据进行qRT-PCR验证,并探讨了差异表达LncRNAs与Hp感染的关系。本研究结果为Hp感染相关胃癌前病变甚至GC发病机制的研究提供新思路,为GC的早期干预研究提供理论支持及可能的靶点分子。
1 资料与方法
1.1 一般资料
收集2020年1月至2020年12月在南京医科大学附属无锡市人民医院行胃镜检查胃黏膜活检组织标本,其中CSG、CAG、IM、Dys及GC组织标本各3例,-80 ℃液氮保存,用于高通量测序检测。为了验证测序结果的可靠性,我们又收集2020年1月至2020年12月在南京医科大学附属无锡市人民医院行胃镜检查胃黏膜活检组织标本共143例,将样品迅速在液氮中冷冻,-80 ℃保存用于qRT-PCR验证。143例病人的临床标本包括85例CSG、26例CAG、15例IM、28例Dys和4例GC。临床标本的病理结果均由我院两位具有副主任医师职称的病理科医生共同诊断。本研究通过南京医科大学附属无锡市人民医院伦理委员会审核批准。所有受试者均签署知情同意书。
1.2 胃黏膜组织总RNA的提取
取胃黏膜组织约50 g,加入1 000 μl Trizol后匀浆。匀浆液转移至新的EP管,室温静置5 min。12 000 r·min-14 ℃离心5 min,取上清,移入新的EP管。加入三氯甲烷200 μl,混匀后常温放置5 min,12 000 r·min-14 ℃离心10 min,弃上清,留沉淀。加入异丙醇750 μl,混匀后常温放置10 min,12 000 r·min-14 ℃离心10 min,弃上清,留沉淀。加入1 ml 75%乙醇清洗沉淀,7 500 r·min-14 ℃离心5 min后尽量吸尽酒精,沉淀室温干燥,最后用10~20 μl RNase Free dH2O溶解。用酶标仪测定提取的RNA样品的浓度及OD值(A260/280)。
1.3 高通量测序
抽提样品的总RNA 后,利用去核糖体试剂盒将rRNA去除,并将RNA片段化(平均片段长度为200 nt左右),逆转录合成单链cDNA,再合成双链cDNA 并纯化,末端修复并加接头引物,PCR 扩增并纯化,然后对文库进行质检,最后上机测序。获得原始测序数据(Raw Data)后,首先需要对数据进行过滤、去接头序列以及对低质量reads进行处理,再对测序质量进行评估,去除核糖体RNA,获得高质量数据(Clean Data)。
1.4 GO和KEGG富集分析
GO是一种在线分析工具,可以对每一个基因进行功能注释,并通过超几何分布方法计算出特定一系列基因中最为显著的功能。基因功能富集分析主要分为两步:基因功能注释、富集分析。将表达差异显著的基因(|log2(差异倍数)|>1 且Q值<0.05)分为上调和下调,分别进行GO 分析,得到分析结果。
生物通路(Biological Pathway)分析基于KEGG生物学通路数据库(http:∥www.genome.jp/)。基因功能富集分析主要分为两步:基因KEGG 生物通路注释、富集分析。P<0.05具有统计学意义。将表达差异显著的基因(|log2(差异倍数)|>1且Q值<0.05)分为上调和下调,分别进行KEGG分析,得到分析结果。
1.5 qRT-PCR
利用抽提得到的总RNA,反转录cDNA为模板。内参 GAPDH 引物序列为:上游5′-TTGGTATCGTGGAAGGACTC-3′,下游5′-TGTCATCATATTTGGCAGGTT-3′;XR_940570引物序列为:上游5′-GGTAAATGGAAAGAAATCACAGCC-3′,下游5′-TGACACAACACCCAACGAGAA-3′;XR_001746081引物序列为:上游5′-ATCACAACTTGCTGGAGCAGA-3′,下游5′-TCTGACTTGTTGACACTGAGCCT-3′。qRT-PCR反应条件为:95 ℃预变性 45 s,75 ℃ 15 s,60 ℃ 30 s,35个循环,以2-ΔΔCt表示待检测的基因的表达。
1.6 Hp感染检测
所有患者在接受胃镜检查前均接受Carbon-13(13C)尿素呼气试验检测,并且排除在呼气试验前1个月内有抗生素服用史、半个月内有质子泵抑制剂及H2受体阻断剂服用史者,13C尿素呼气试验阳性被认定为Hp感染阳性。
1.7 统计学处理
应用SPSS 24.0统计软件进行统计学分析。数据资料以表示,两组间比较采用非配对t检验。Fold change及P值用于评估不同胃黏膜病变中差异表达的LncRNAs。P<0.05表示差异有统计学意义。
2 结 果
2.1 不同胃黏膜病变中LncRNAs的表达谱
为了了解胃黏膜癌变过程中LncRNAs差异表达情况,利用Illumina HiSeqTM 2500对在CSG、CAG、IM、Dys及GC中表达的LncRNAs谱进行测序分析,火山图显示了所有差异具有统计学意义的LncRNAs个数。与CSG组相比,CAG组中异常表达的LncRNAs共有104个,其中表达上调的LncRNAs有79个,表达下调的LncRNAs有25个(图1A),热图显示了胃黏膜从炎症向萎缩变化过程中上调或下调大于20倍的LncRNAs(图1B)。IM组中异常表达的LncRNAs共有686个,其中表达上调的LncRNAs有403个,表达下调的LncRNAs有283个(图1C),热图显示了胃黏膜从炎症向肠上皮化生过程中上调或下调大于20倍的LncRNAs(图1D)。Dys组中异常表达的LncRNAs共有378个,其中表达上调的LncRNAs有219个,表达下调的LncRNAs有159个(图1E),热图显示了胃黏膜从炎症向肠异型增生过程中上调或下调大于20倍的LncRNAs(图1F)。GC组中异常表达的LncRNAs共有2 180个,其中表达上调的LncRNAs有1 276个,表达下调的LncRNAs有904个(图1G),热图显示了胃黏膜癌变后上调或下调大于20倍的LncRNAs(图1H)。

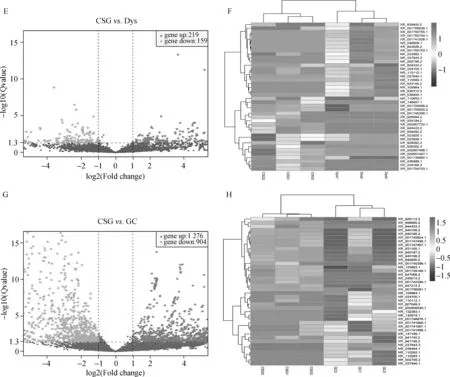
A.CSG与CAG中表达差异LncRNAs的火山图;B.CSG与CAG中差异表达LncRNAs的热图;C.CSG与IM中表达差异LncRNAs的火山图;D.CSG与IM中差异表达LncRNAs的热图;E.CSG与Dys中表达差异LncRNAs的火山图;F.CSG与Dys中差异表达LncRNAs的热图;G.CSG与GC中表达差异LncRNAs的火山图;H.CSG与GC中差异表达LncRNAs的热图
根据以上测序结果,进一步筛选得到CAG、IM、Dys及GC 4组中表达均有变化的LncRNAs(图2A)。为了进一步了解在癌前病变中起关键作用的LncRNAs,我们将感兴趣的两个LncRNAs XR_001746081和XR_940570在CSG、CAG及Dys中进行扩大样本量qRT-PCR验证。结果发现,与CSG相比,XR_001746081和XR_940570在CAG中表达均明显上调(P<0.001),而在Dys中表达均较CAG中明显下调至CSG同等水平(P<0.001)(图2B、C)。推测这两个LncRNAs可能在胃黏膜由炎症变为萎缩过程中起重要作用。
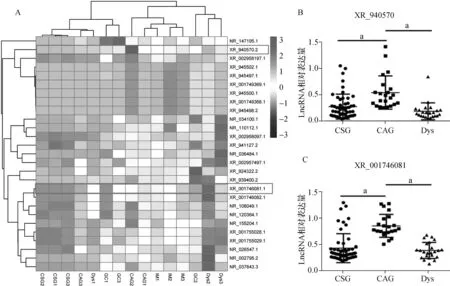
A.4组中表达均有差异的LncRNAs的热图,热图右侧代表差异标的LncRNAs的名称,右侧指示条代表表达量的高低(3至-3),红色代表高表达,蓝色代表低表达;B.qRT-PCR检测XR_940570在CSG、CAG、Dys中的表达,a P<0.001;C.qRT-PCR检测XR_001746081在CSG、CAG、Dys中的表达,a P<0.001
2.2 差异表达LncRNAs的GO和KEGG信号通路分析
我们对上面筛选得到的在4个组中表达均有变化的27个LncRNAs进行了GO分析,发现上调的LncRNAs主要调控细胞成分(细胞外基质、细胞内、膜结合细胞器、细胞器、胞质部分、细胞质、膜)、分子功能(底物特异性跨膜转运活性、跨膜转运活性、离子结合、水解酶活性、转运活性、蛋白结合、催化活性)、生物学过程(初级代谢过程、细胞代谢过程、小分子代谢过程、刺激反应、有机物代谢过程、单个有机体代谢过程、细胞形成过程)(图3A)。下调的LncRNAs主要调控生物学功能(细胞过程、生物过程、生物调节)、细胞成分(细胞、质膜、细胞内)、分子功能(蛋白结合、催化活性)(图3B)。

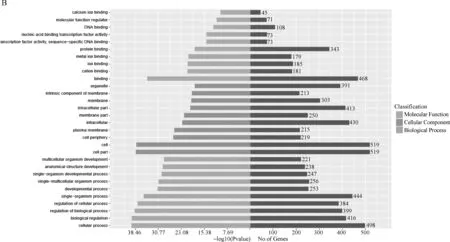

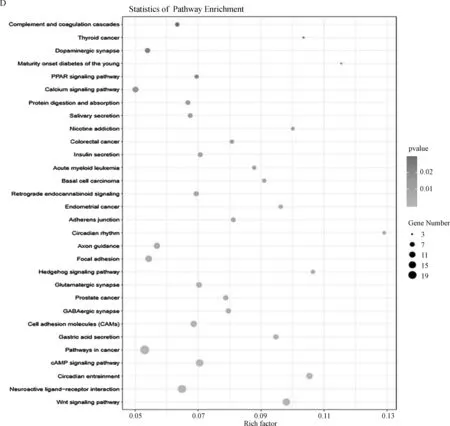
A.上调LncRNAs的GO分析;B.下调LncRNAs的GO分析;C.上调LncRNAs的KEGG分析;D.下调LncRNAs的KEGG分析
对上述27个差异表达LncRNAs进行KEGG通路分析,发现上调的LncRNAs主要富集在代谢通路、脂肪消化吸收、脂肪酸代谢、三羧酸循环、淀粉蔗糖代谢、维生素消化吸收等(图3C)。下调的LncRNAs主要富集在肿瘤、胃酸分泌、cAMP信号通路、Wnt信号通路、神经活性配体-受体相互作用等(图3D)。
2.3 XR_940570和XR_001746081表达与Hp感染的关系
CSG组中Hp感染阳性率为41%(35/85), CAG组中Hp感染阳性率为65%(17/26),Dys组中Hp感染阳性率为35.7%(10/28)。CSG与CAG组中Hp感染阳性率差异有统计学意义(P<0.05,表1)。Dys与CSG组中Hp感染阳性率差异无统计学意义(P>0.05,表1)。
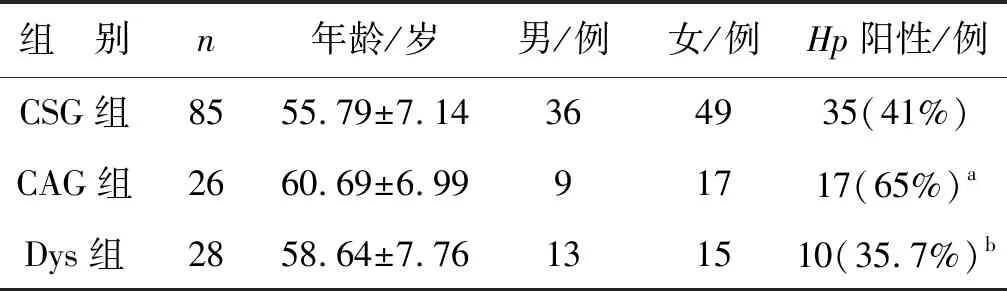
表1 患者的一般资料
进一步对不同Hp感染状态下 XR_940570和XR_001746081的表达分析发现,与CSG相比,XR_940570在CAG中表达上调,且在伴有Hp感染的CAG中的上调更为显著,但在Dys组中,无论Hp感染与否,XR_940570的表达均无显著差异,见图4。与CSG相比,XR_001746081在CAG中表达上调,且在Hp感染的CAG中的上调更为显著,但在Dys组中,无论Hp感染与否,XR_001746081的表达均无显著差异,见图5。
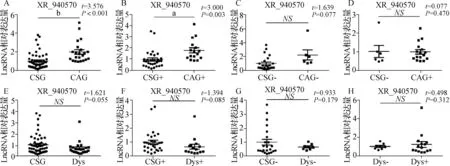
NS P>0.05;a P<0.01;b P<0.001

NS P>0.05;a P<0.05;b P<0.01;c P<0.000 1
3 讨 论
越来越多的研究发现,LncRNAs可调节胃癌细胞的增殖、细胞周期、细胞凋亡、侵袭转移[7-9],研究发现,高侵袭转移胃癌细胞系SGC7901M中MALAT1的水平明显高于低侵袭转移胃癌细胞系SGC7901NM,并验证了MALAT1可以通过促进上皮间质转化促进胃癌细胞的侵袭和转移[10]。LncRNA HOXA11-AS仅在胃癌中高表达,在其他肿瘤中不高表达,且LncRNA HOXA11-AS的高表达与胃癌的不良预后相关,沉默LncRNA HOXA11-AS后发现胃癌细胞增殖受到抑制,促进肿瘤细胞的凋亡[11]。因此可见,LncRNAs在胃癌的发展中起到关键的调控作用,但目前有关LncRNAs在胃黏膜癌前病变中表达的研究罕见。我们利用高通量测序对CSG、CAG、Dys及GC中LncRNAs表达谱进行了分析,发现在胃黏膜从炎症至癌变过程中LncRNAs的表达发生了显著变化,并验证了XR_001746081和XR_940570在慢性萎缩性胃炎中高表达,推测这两个LncRNAs可能在胃黏膜从炎症到萎缩进展中起到关键调控作用。
GO和KEGG分析是基因表达所调控的功能和信号通路常用的预测方法,对于LncRNAs所调控的网络有着很好的预测价值[12]。本研究将高通量测序得到的异常表达LncRNAs进行了生物信息学分析,发现异常表达的LncRNAs主要与代谢、消化、肿瘤、胃酸分泌、cAMP信号通路、Wnt信号通路等相关。由此推测LncRNAs可能通过调控这些信号通路从而参与胃黏膜从炎症-萎缩-异型增生-GC过程的进展,这为今后癌前病变发病机制的研究提供了新思路及研究方向。
Hp感染与胃黏膜萎缩、肠化生、上皮内瘤变及GC有关,是GC发生的独立危险因素[13]。有研究报道,Hp阳性的萎缩性胃炎患者发生GC的风险是非Hp感染患者的6.4~11.8倍[14],Hp感染可引起LncRNAs的变化从而调控GC的进展[6]。有研究在Hp感染相关的萎缩性胃炎(Hp-GA)和Hp感染相关的胃癌(Hp-GC)中构建了LncRNA-转录因子-mRNA网络。在Hp-GA网络中,CDX2是核心转录因子,在肠化生和胃癌中起着关键作用。在Hp-GA和Hp-GC中,FPR1、TFF2、GAST、SST、FUT9、SHH和GATA5被认为是重要的差异表达的基因[12]。但有关LncRNAs在不同Hp感染状态癌前病变中的表达尚无研究报道。我们的研究对筛选得到的两个LncRNAs XR_940570和XR_001746081在不同Hp感染状态的CAG及Dys中的表达进行了分析,结果显示,在Hp阳性感染的背景下,XR_940570和XR_001746081的表达在CAG中均较CSG中显著上调,在Dys中的表达与CSG差异不显著,而在Dys中的表达又较CAG下调,由此推测XR_940570和XR_001746081可能在Hp感染背景下胃黏膜从CSG(炎症)至CAG(萎缩)变化中起到关键调控作用,而随着胃黏膜进一步病变至异型增生,XR_940570和XR_001746081的表达下调至炎症相当水平,所发挥的作用也可能逐渐减弱。
研究认为,Hp主要在胃黏膜萎缩前发挥作用,所以即便根除Hp治疗也不能阻断胃黏膜由萎缩向异型增生甚至癌的进展[14]。因此在Hp感染且已发生萎缩的胃黏膜中阻断XR_940570和XR_001746081的表达可能会干预胃黏膜向异型增生甚至癌的进展,这需要更进一步的实验研究来证实。
本研究尚存在一定的不足,首先研究样本量有限,尤其是萎缩性胃炎及异型增生的例数偏少,我们将继续收集不同胃黏膜病变的标本,在今后的研究中用更大样本量来证实我们的结果。本研究虽然筛选得到了在胃黏膜从炎症至癌变过程中表达差异的LncRNAs,并且推测到在Hp感染后XR_940570和XR_001746081可能在胃黏膜从炎症向萎缩转变中起关键的调控作用,但目前尚无可靠的体内外萎缩肠化模型对LncRNAs的功能进行进一步研究,我们正在构建患者来源胃萎缩肠化、异型增生等类器官模型以及比格犬GC模型,待模型稳定后将会进一步研究相关lncRNAs的功能。
综上所述,本研究发现XR_940570和XR_001746081在Hp感染后胃黏膜由浅表性胃炎发展为萎缩性胃炎中可能起到关键调控作用,可为Hp感染后胃黏膜癌变的发病机制的研究提供了新的研究思路。

