洛神花花青素提取工艺及抗氧化活性研究
冯 敏,幸宏伟,尤琳烽,刘小娟
1.重庆工商大学 环境与资源学院,重庆 400067 2.重庆市特色农产品加工储运工程技术研究中心,重庆 400067
1 引 言
洛神花(Roselle),学名玫瑰茄(HibiscussabdariffaLinn.),又名芙蓉茄、山茄等,是锦葵科一年生的草本植物[1],其花萼有丰富的碳水化合物、维生素、蛋白质、矿物质等,还含有还原糖、花青素,是天然的抗氧化剂[2]。
洛神花及提取物有很多功能作用,如洛神花多糖提取物对急性肝损伤大鼠具有良好的干预治疗作用[3],洛神花有利尿、清除氧自由基、加快脂肪代谢[4]、降血脂以及抗肿瘤[5]等作用。也有将洛神花开发成具有保健功能的食品,如王建化等[6]将菊花、洛神花复合研制果酱,何菁等[7]用玫瑰花和洛神花制作复合保健饮料等。对洛神花花青素提取及抗氧化活性也有少量报道,如张辉青花等[8]采用果胶酶协助微波提取,提高了花青素的得率;廖禹东等[9]对不同产地的洛神花花青素进行了体外抗氧化研究,但未见有体内抗氧化活性的研究报道,而本文是采用超声波辅助的方法优化提取洛神花花青素的工艺,并进行体内、体外抗氧化活性研究,为其进一步开发利用提供理论支持。
2 材料与方法
2.1 实验材料
洛神花干花萼(云南大理,购于重庆南坪);斑马鱼(重庆江北三禾水族馆);无水乙醇、氯化钾、冰乙酸、醋酸钠、盐酸(分析纯,国药集团化学试剂有限公司); 维生素C(北京鼎国昌盛生物技术有限公司);DPPH自由基清除能力试剂盒、总抗氧化能力试剂盒、羟自由基测定试剂盒(南京建成生物工程研究所);DPPP(梯希爱上海化成工业发展有限公司)、AAPH(山东西亚化工有限公司)、AO(Gen-View科学公司)、鱼饲料(泰港科技有限公司);DCFH-DA(Sigma 公司);三卡因(合肥博美生物科技有限责任公司)。
2.2 仪器与设备
SQP电子天平(赛多利科学仪器(北京)有限公司)、双频数控超声波清洗仪(KQ-500VDE,昆山市超声仪器有限公司)、pH计(梅特勒—托利多国际有限公司)、小钢磨(永康市铂欧五金制品有限公司)、高速离心机(TD-420,四川蜀科仪器有限公司)、RE-52AA旋转蒸发仪(上海亚荣生化仪器厂)、酶标仪(infiniteM200瑞士Tecan)、电热恒温干燥箱(GZX-DH 500-S-Ⅱ,上海跃进医疗器械厂);尼康ECLIPSE Ci-L正置荧光显微镜(NIKON仪器(上海)有限公司)。
2.3 洛神花花青素的提取
将洛神花花萼于60 ℃烘干后粉碎成粉末,过80目筛,避光密封保存备用。称取1 g洛神花干花萼粉,加蒸馏水后进行超声处理,离心取上清液为提取液。提取液通过真空浓缩得浓缩液,4 ℃保存备用。通过pH示差法[10]算得洛神花花青素的含量和得率。简述为将2份1 mL的洛神花提取液,分别用pH 1.0和pH 4.5缓冲溶液定容至50 mL,室温下平衡40 min,在520 nm和700 nm波长下测定提取液的吸光度,根据公式可以计算出洛神花花青素的含量:
其中:C为花青素含量(g/mL),MW为矢车菊素-3-葡萄糖苷(449.2 g/mol)的分子量;DF为稀释因子;ε为摩尔吸光系数26 900(L/mol·cm),L为光长度(1 cm)。
2.4 单因素实验
分别称取1 g洛神花干花萼粉5份置于三角瓶中,加入蒸馏水40 mL,此时料液比为1∶40,将工艺参数设置为超声时间为30 min、提取温度为20 ℃、超声功率分别为200、250、300、350、400 W,在此条件下提取,并按照2.3的方法计算洛神花花青素得率。在最佳超声功率条件下,检测超声时间、提取温度、料液比对洛神花花青素得率对影响。超声时间分别为 20、30、40、50、60 min 五个水平;提取温度分别为20、30、40、50、60 ℃ 五个水平;液料比蒸馏水用量(mL)∶洛神花质量(g)分别为10∶1、20∶1、40∶1、80∶1、160∶1 五个水平。各个水平分别做三组平行实验。
2.5 正交实验
根据单因素的实验结果,运用正交表L9(34)进行正交实验,优化洛神花花青素的最佳工艺条件。
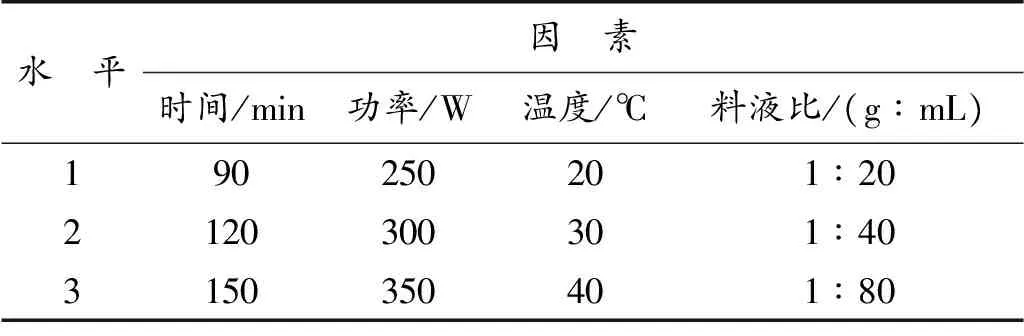
表1 正交实验因素与水平Table 1 Orthogonal experiment factors and levels
2.6 洛神花花青素体外抗氧化性的研究
体外抗氧化实验参考王胜男[11]的方法,并结合试剂盒的使用说明配置各工作液,分别作DPPH自由基(DPPH·),ABTS自由基(ABTS+·)标准曲线,并根据各个指标的公式计算。
具体如下:将0.5 mg/mL Trolox(维生素E类似物)标准应用液用甲醇分别稀释成质量浓度5、10、15、20、25 μg/mL标准溶液各400 μL,依次加入600 μL工作液,混合均匀,在25 ℃的条件下,避光静置三十钟,在517 nm波长处,用酶标仪测定各管吸光度值,绘制DPPH自由基标准曲线。根据公式计算:
取10 mM Trolox标准液用蒸馏水稀释成:0.1 mM、0.2 mM、0.4 mM、0.8 mM、1.0 mM,按照比例加入蒸馏水、待测样本、ABTS工作液、显色剂,室温反应6 min,在405 nm的波长条件下,用酶标仪测定各管吸光度值,以不同的Trolox浓度为横坐标,吸光值为纵坐标,来绘制ABTS自由基标准曲线。按照公式计算:
按照比例加入蒸馏水、0.03% H2O2标准品底物应用液、样本混合后,在37 ℃水浴条件下,准确反应1 min,立即加入2mL显色剂,混合均匀之后,室温下放置20 min,在550 nm波长处用酶标仪测定各管的吸光度值。按照公式计算:
2.7 斑马鱼ROS的测定
实验过程参考Kim E A 等[12]所报道的方法并加以调整。简述为购买处于繁殖期的成年斑马鱼,适应性喂养后进行亲代的繁殖,温度控制在28.5±1 ℃,并收集斑马鱼胚胎,挑选状态良好的胚胎进行试验。胚胎(n=8)放入含1 mL胚胎介质(充氧过夜的浓度为0.25 mg/mL的海水晶溶液)的24孔板的孔中,分为正常组(NC),模型组(Model),维生素C组(VC),洛神花花青素低剂量组(Anth.L)、中剂量组(Anth.M)、高剂量组(Anth.H)。胚胎受精后的6-7小时,除正常组和模型组外,其他组分别加入相应的维生素C或花青素,使维生素C的浓度为2.9 μg/mL,低、中、高剂量组洛神花花青素浓度为2.9 μg/mL、5.8 μg/mL和11.6 μg/mL。孵育到胚胎受精后12 h,所有组都加入12 mM 2,2-偶氮二(2-甲基丙基咪)二盐酸盐(AAPH)进行共处理,直到胚胎受精后24 h。最后,停止使用AAPH诱导胚胎氧化损伤,正常组和模型组放入正常胚胎介质中,其余各组则放入含有相应组别维生素C或洛神花提取液的介质中。2 d后,所有组别全部更换为正常胚胎介质,并对各组进行所有指标的测试。
斑马鱼胚胎中的ROS产物参考Bass D A等[13]方法检测;脂质过氧化物参考Okimoto Y[14]的方法测定。细胞死亡程度参考Kang M C等[15]的方法测定。简述为在2 dpf时,测ROS用DCFH-DA 溶液(20 μg/mL)处理斑马鱼胚胎, 并于黑暗中孵育1h;测DPPH用DPPP 溶液(25 μg/mL)处理斑马鱼胚胎, 并于黑暗中孵育1 h;测细胞死亡程度用吖啶橙溶液(AO)(7 μg/mL)处理斑马鱼胚胎, 并于黑暗中孵育30 min。荧光染料孵育后,用新鲜的培养介质清洗斑马鱼胚胎数次,并在观察前用三卡因(0.2 mg/mL)对其进行麻醉。在荧光显微镜下拍摄斑马鱼胚胎的荧光图片,根据荧光强度相对比值计算抗氧化活性。
2.8 数据处理
3 结果与讨论
3.1 洛神花花青素提取单因素实验结果
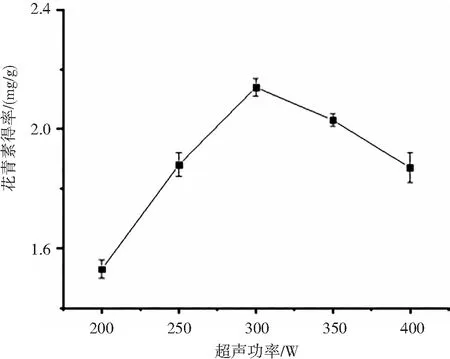
通过单因素的变化,考察超声功率、超声时间、提取温度和提取时间对洛神花花青素得率的影响,结果如图1所示。在超声时间30 min、料液比1∶40、提取温度20 ℃的条件下,超声功率对洛神花花青素得率的影响见图1(a),花青素得率随着超声功率呈现出先升高后降低,在300 W时得率达到最高,为2.14 mg/g;超声功率在300 W之后,超声波功率逐渐增大,提取效果反而不断下降。
(a) 超声功率对花青素得率的影响
(b) 超声时间对花青素得率的影响

(c) 提取温度对花青素得率的影响
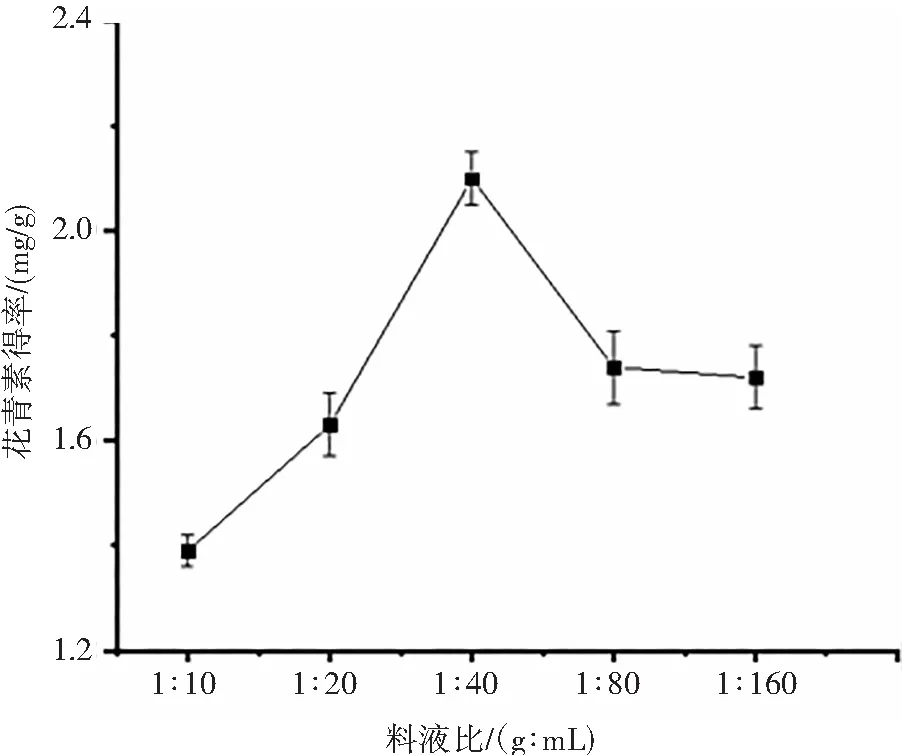
(d) 料液比对花青素得率的影响
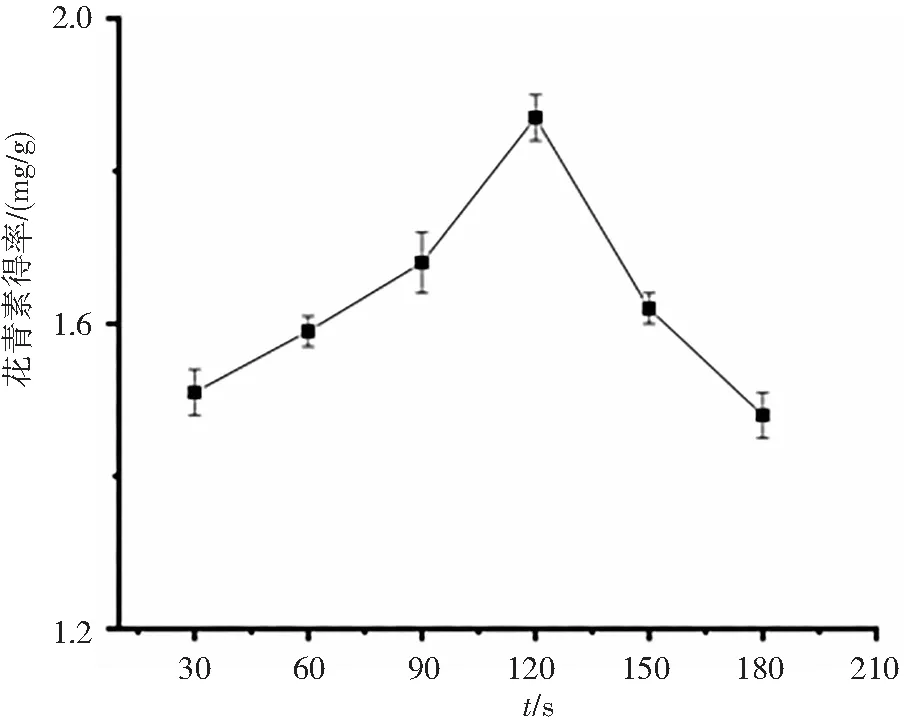
在提取温度20 ℃、料液比1∶40、超声波功率200 W的条件下,超声提取时间对洛神花花青素得率的影响见图1(b),超声时间在30—120 min时,得率随着超声时间的增加而不断升高,120 min之后花青素得率下降明显,可能由于长时间暴露于超声波振荡的环境中,使提取出的花青素容易分解,分解的速率在120 min分钟后高于从洛神花中提取的速率。因而超声时间过长,反而不利于对色素的提取,使花青素得率下降。
超声时间30 min、料液比1∶40、超声功率250 W的条件下,提取温度对洛神花花青素得率的影响见图1(c),提取温度对洛神花花青素得率有一定的影响。随着提取温度的升高,花青素得率呈现出先增大后减小的趋势,在30 ℃时花青素得率最大,为1.93 mg/g,温度继续升高,提取率降低,这可能是由于在温度较高的情况下,洛神花花青素素的结构由于超声波的剪切作用的增强而被破坏,最终导致花青素提取效果不佳[16]。
在超声时间30 min、超声功率250 W、提取温度20 ℃的条件下,料液比对洛神花花青素得率的影响见图1D。料液比的不断增加,得率先增大后减小。料液比在1∶10—1∶40时,洛神花花青素得率与料液比成正比,当料液比为1∶40时,达到最大得率,为2.10 mg/g,在1∶40之后,料液比的大小与花青素得率成反比。
综上所述,确定最佳的超声功率为300 W,超声提取时间为120 min,提取温度为30 ℃,料液比为1∶40,进一步展开正交优化实验。
3.2 洛神花花青素提取正交优化结果
超声波辅助提取洛神花花青素正交实验结果如表2所示,通过正交优化后,花青素提取最佳条件为:超声时间90 min、提取温度30 ℃、超声功率300 W、料液比1∶40;花青素得率最高,达2.94 mg/g,比单因素实验时最高得率2.14 mg/g提高了37%。四个因素对洛神花花青素得率的影响从大到小依次为超声功率、超声时间、提取温度和料液比,且超声功率对花青素得率的影响有显著性差异(P<0.05)。
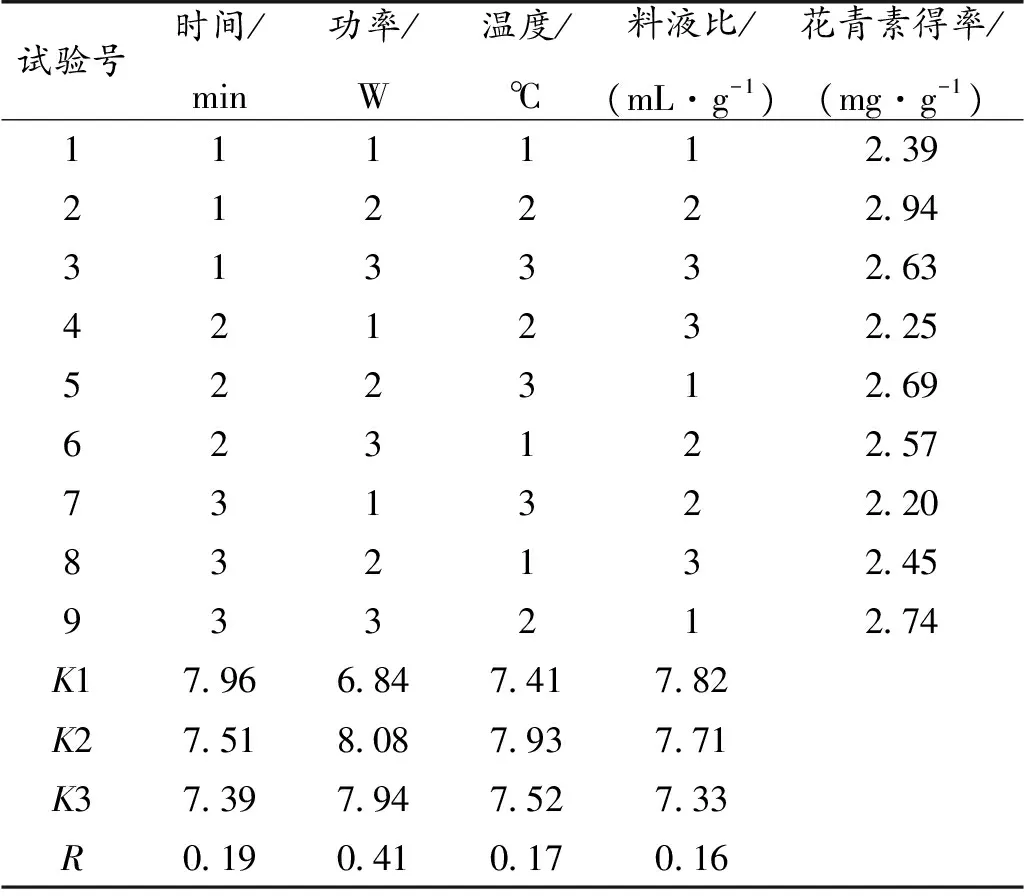
表2 正交试验结果Table 2 Orthogonal test results
3.3 洛神花花青素体外抗氧化活性
由图2 可知,在实验浓度范围内,洛神花花青素抗氧化能力和浓度呈现一定的量效关系,即随着花青素浓度的增大,其抗氧化效果也而逐步增强。当洛神花花青素浓度达5.8 mg/mL 时(图2(a)),对DPPH 自由基清除率达到 83.15%,但低于 1 mg/mL 的 VC 清除率(87.9 %);当洛神花花青素浓度从0.37 mg/mL等倍增加到 5.8 mg/m L时,对羟自由基清除率从32.5 % 增加到74.4 %(图2(b)),但也低于 1 mg/mL 的 VC 清除率(78.1 %);洛神花花青素对于 ABTS 自由基的清除能力较弱,当花青素浓度达5.8 mg/m L 时,其ABTS 自由基的清除率为 63.32 %(图2(c)),远低于 1 mg/mL的 VC 抗氧化能力(91.6 %)。总体来说,洛神花花青素具有抗氧化能力,但同浓度的抗氧化能力低于VC。

(a) 洛神花花青素对DPPH自由基的影响
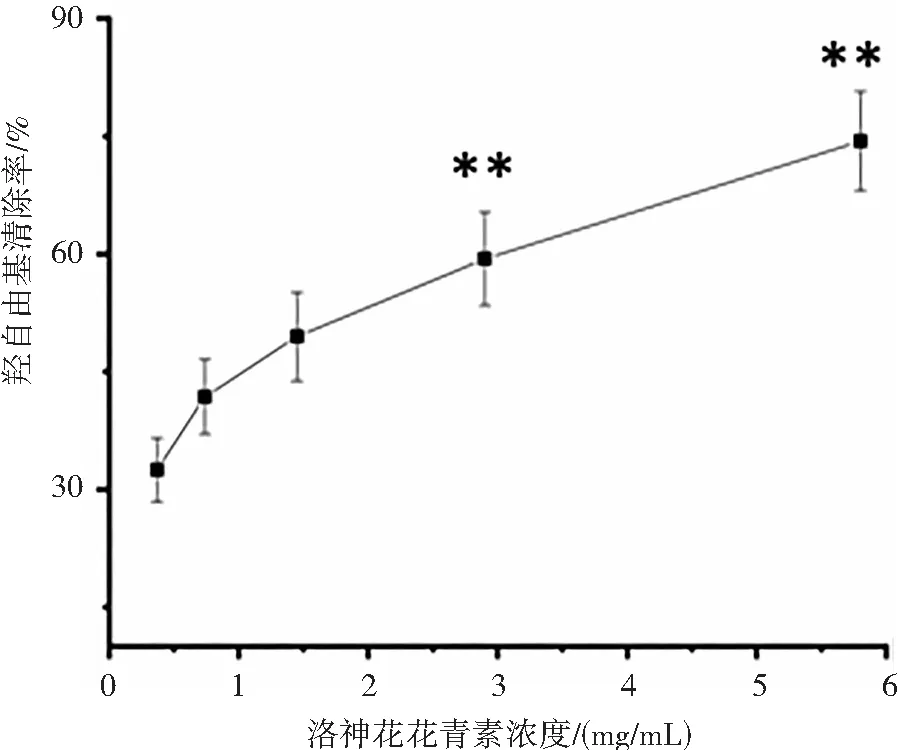
(b) 洛神花花青素对羟自由基的影响
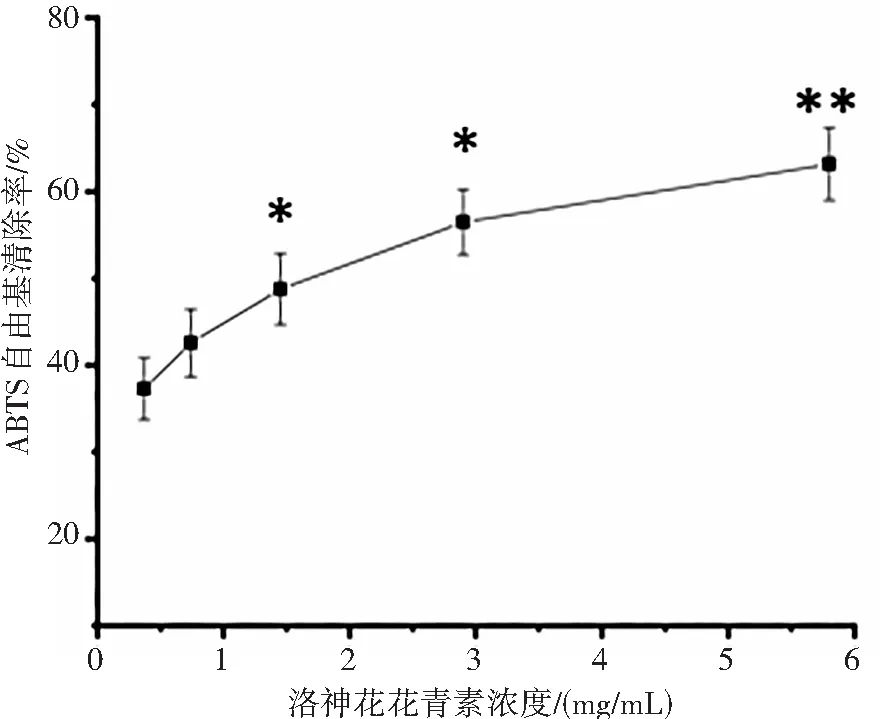
(c) 洛神花花青素对ABTS自由基的影响图2 洛神花花青素体外抗氧化活性Fig.2 Antioxidant capacity of anthocyanin from Roselle注:与洛神花花青素低浓度0.37 mg/mL 组对比时, *p <0.05, **p <0.01.
3.4 洛神花花青素对斑马鱼胚胎氧化应激的影响
AAPH可诱导斑马鱼胚胎产生氧化损伤,生成过量ROS,造成大量细胞死亡[11],通过检测斑马鱼体内ROS 生成水平、脂质过氧化物产生率和细胞死亡率进行评价,结果如下:
从图3斑马鱼胚胎的荧光图可见,正常组荧光强度弱而模型组荧光强度强,在诱导剂AAPH 刺激下,ROS在斑马鱼中大量积累,模型组的ROS产物量是正常组的197%,获得氧化应激模型,VC和洛神花花青素的干预使ROS不同程度地降低。洛神花花青素低剂量组显著降低ROS(164.8 ± 8.3%、170.1 ± 9.2%)产生,VC组和中、高剂量洛神花花青素组显著地降低了ROS(121.7 ± 10.4%、153.2 ± 9.1%、128.1±6.8%)的产生。洛神花花青素高剂量组(11.6 μg/ mL)对抑制ROS的产生能力和2.9 μg/mL的VC组接近。
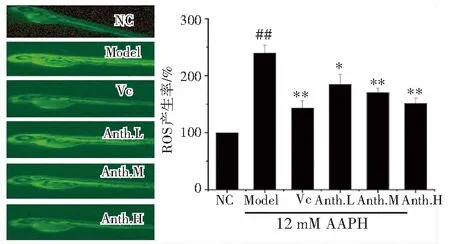
图3 洛神花花青素对斑马鱼胚胎的ROS清除活性Fig.3 Intracellular ROS scavenging activity of anthocyanin from Roselle in zebrafish embryos注:##p <0.01 vs. NC; *p< 0.05 and ** p<0.01 vs. Model
活细胞膜中的氢过氧化物的含量与荧光强度相关[17],通过其荧光强度检测胚胎活细胞的过氧化物的产生情况。由图4可见,脂质过氧化物在AAPH诱导的斑马鱼中大量产生,与正常组相比,模型组的脂质过氧化显著升高,约为正常组的1.87倍,而洛神花花青素低剂量和中剂量组与模型组对比均呈现显著的降低,降低水平分别为15.7 %和19.3%;VC组和洛神花花青素高剂量组与模型组对比均呈现极显著降低,降低水平分别为36.7 %和34.5%。洛神花花青素干预能降低氧化应激状态的斑马鱼胚胎脂质过氧化物的产生,并具有剂量依赖性。
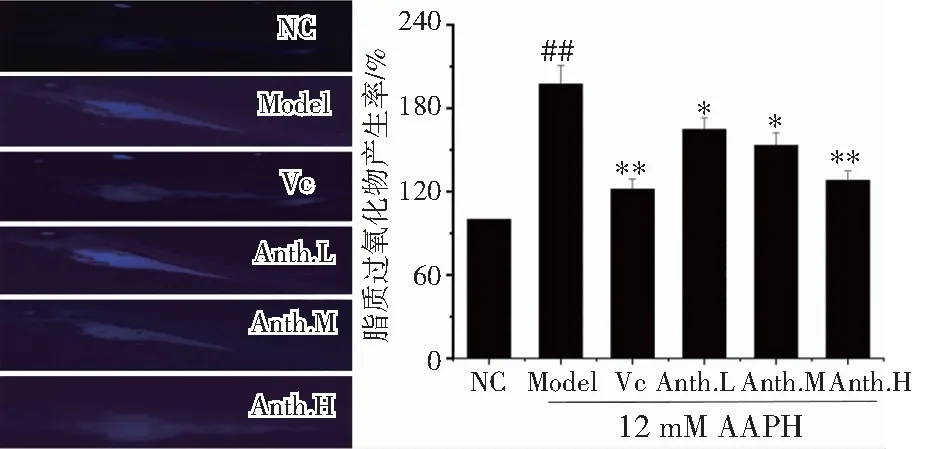
图4 洛神花花青素对斑马鱼胚胎脂质过氧化抑制 活性Fig.4 Lipid peroxidation inhibitory activity of anthocyanin from Roselle in zebrafish embryos注:##p <0.01 vs. NC; *p< 0.05 and **p<0.01 vs. Model
通过测试由AAPH诱导的斑马鱼胚胎活体的细胞死亡情况进一步评估了洛神花花青素对氧化损伤的保护作用,由图5所示,机体的持续性氧化应激损伤将导致细胞死亡,产生较高的荧光强度,模型组细胞死亡率是正常组的2.1倍,而VC组、洛神花花青素低、中、高剂量组均不同程度地抑制细胞死亡(117.1 ± 0.9 %、154.4 ± 4.2 %、145.6 ± 4.3 %、121.2 ± 5.8 %),高剂量组(11.6 μg/ mL)的洛神花花青素抵抗细胞死亡水平与VC组(2.9 μg/ mL)相近。
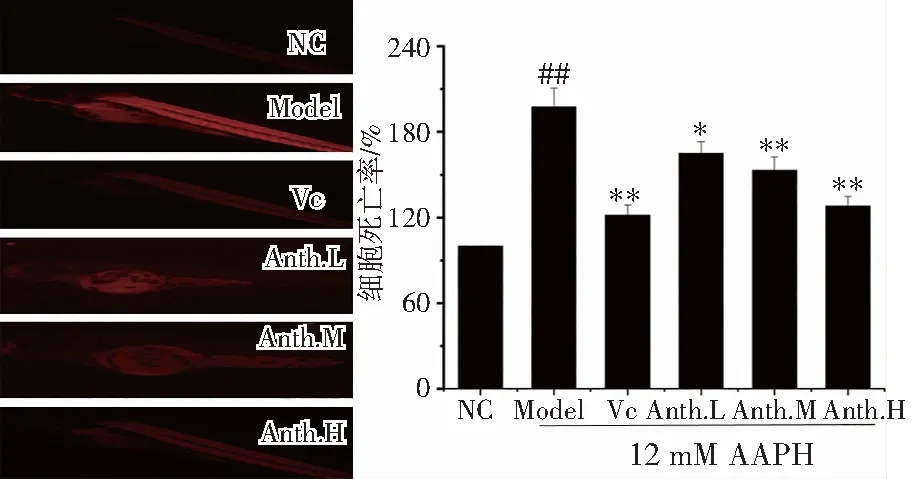
图5 洛神花花青素保护斑马鱼胚胎抵抗细胞死亡Fig.5 Protective effect of anthocyanin from Roselle against cell death in zebrafish embryos注:##p <0.01 vs. NC; *p< 0.05 and ** p<0.01 vs. Model
4 结 论
将超声波辅助应用到洛神花花青素的提取中,利用正交优化实验得出其最佳提取工艺条件:提取温度为30 ℃、超声功率300 W、料液比1∶40(g/mL)、超声时间90 min,能有效提高洛神花花青素得率,此时得率为2.94 mg/g。体外抗氧化活性表明,5.8 mg/mL洛神花花青素对DPPH 自由基清除率、ABTS 自由基清除率和羟自由基清除率分别为 83.15 %、 63.32 %和74.4 %。通过洛神花花青素对斑马鱼胚胎氧化应激的干预,洛神花花青素能够有效保护由AAPH诱导的氧化损伤,11.6 μg/ mL剂量组的洛神花花青素极显著降低ROS的产生,抑制脂质过氧化物的生成和降低胚胎细胞死亡率(P<0.01)。该研究结果可为进一步开发利用洛神花提供理论依据。

