血清HBsAg阳性者接受肾移植术120周预后随访报告*
张 玥,宁 玲,李文渊,郑晓玮,刘洪涛,张振华,李 磊
据世界卫生组织(World Health Organization,WHO)报告,全球大约有 2.57 亿人存在乙型肝炎病毒(hepatitis B virus,HBV)慢性感染,发展为肝硬化和肝细胞癌 (hepatocellular carcinoma,HCC) 的风险增加,每年有超过70万人死于HBV感染相关性疾病。既往认为HBV感染是肾移植的禁忌证[1]。在拉米夫定(lamivudine,LAM)等有效抗病毒治疗药物出现之前,约有80%血清HBsAg阳性的肾移植受体术后病情进展为慢性肝病,并由此导致近60%患者最终死亡[2-4]。肾移植术后应用免疫抑制剂也会影响HBV 感染状态和病毒复制水平。接受血清HBsAg阳性者供肾的受者死亡和移植物失功能的风险更高[5]。本文对血清HBsAg阳性肾移植受者进行了随访,以分析肾移植后移植物功能延迟恢复(delayed graft function,DGF)的发生及其对患者生存的影响,现将结果报道如下。
1 资料与方法
1.1 一般资料 2018年1月~2021年9月中国科学技术大学附属第一医院因慢性肾功能衰竭接受肾移植患者69例,男性52例,女性17例;中位年龄为39岁(21~56岁)。纳入患者肾移植前,血清HBsAg阳性。术前肾脏替代治疗包括血液透析46例,腹膜透析15例,未透析8例;透析时间为74(20~394)周。术前血清肌酐清除率为7.6±3.5 ml/(min·1.73 m2)。DGF被定义为术后7天血肌酐(sCr)水平仍大于400μmol/L并再次接受透析治疗。本研究经我院医学研究伦理委员会审核通过(伦理编号:2022-RE-196)。
1.2 治疗方法与随访 所有患者在肾移植围手术期均加用或换用恩替卡韦(entecavir,ETV)抗病毒治疗。其中26例接受血清HBsAg阳性供体者肝脏,围手术期予以乙型肝炎免疫球蛋白预处理。肾移植术后免疫抑制维持方案为环孢素(cyclosporine A,CsA)/他克莫司(tacrolimus,FK506)、吗替麦考酚酯(mycophenolate mofetil,MMF)/麦考酚钠联合甲泼尼龙8 mg.d-1口服。在术后3个月,将CsA血药浓度控制在100~450 ng/mL,将FK506血药浓度控制在5~20 ng/mL。根据肝肾功能情况,及时给予对症处理,包括护肝、调整免疫抑制剂方案,对未实现病毒学应答的患者等调整抗病毒治疗方案。术后第一年每3个月随访1次,之后每6个月随访1次,截止至目前最长随访时间为196周,中位随访时间为120周。随访终点为死亡或因终末期肾病再次行透析治疗。
1.3 指标检测 使用美国贝克曼库尔特公司生产的AU680全自动生化分析仪检测血生化指标(武汉益普生物科技有限公司);使用德国BIOMETRA Tgradient96 PCR分析仪检测血清HBV DNA定量(中山大学达安基因股份有限公司,检测下限为1000 copies/mL);采用ELISA法检测血清HBsAg标志物(上海科华生物工程股份有限公司)。
1.4 统计学处理 应用SPSS 26.0软件进行统计学分析,计量资料以M(P25,P75)表示,采用秩和检验,P<0.05表示差异具有统计学意义。
2 结果
2.1 DGF发生和生存情况 截至2022年10月,发生DGF 3例(4.4%),亲属供肾和非亲属供肾者DGF发生率分别为3.9%(2/51)和5.6%(1/18),1例在术后第6天开始再次进行血液透析(3次/周)治疗,后续肾功能仍未恢复,目前持续行血液透析治疗,1例在肾移植术后1周sCr为524μmol/L,多次行血液透析治疗后DGF恢复,sCr逐渐降至正常,另1例供肾来源于非亲属患者,在术后1周sCr达到1021μmol/L,未透析,至术后第12周sCr逐渐降至179μmol/L。截止到随访结束,3例发生DGF患者均生存,本组69例患者生存67例(97.1%),1例于术后52周发生肺孢子菌肺炎和多器官功能衰竭死亡,另1例在术后64周因肺部重症感染死亡。
2.2 两组肝肾功能比较 接受血清HBsAg阳性与阴性供肾患者肾功能无统计学差异(P>0.05,表1)。
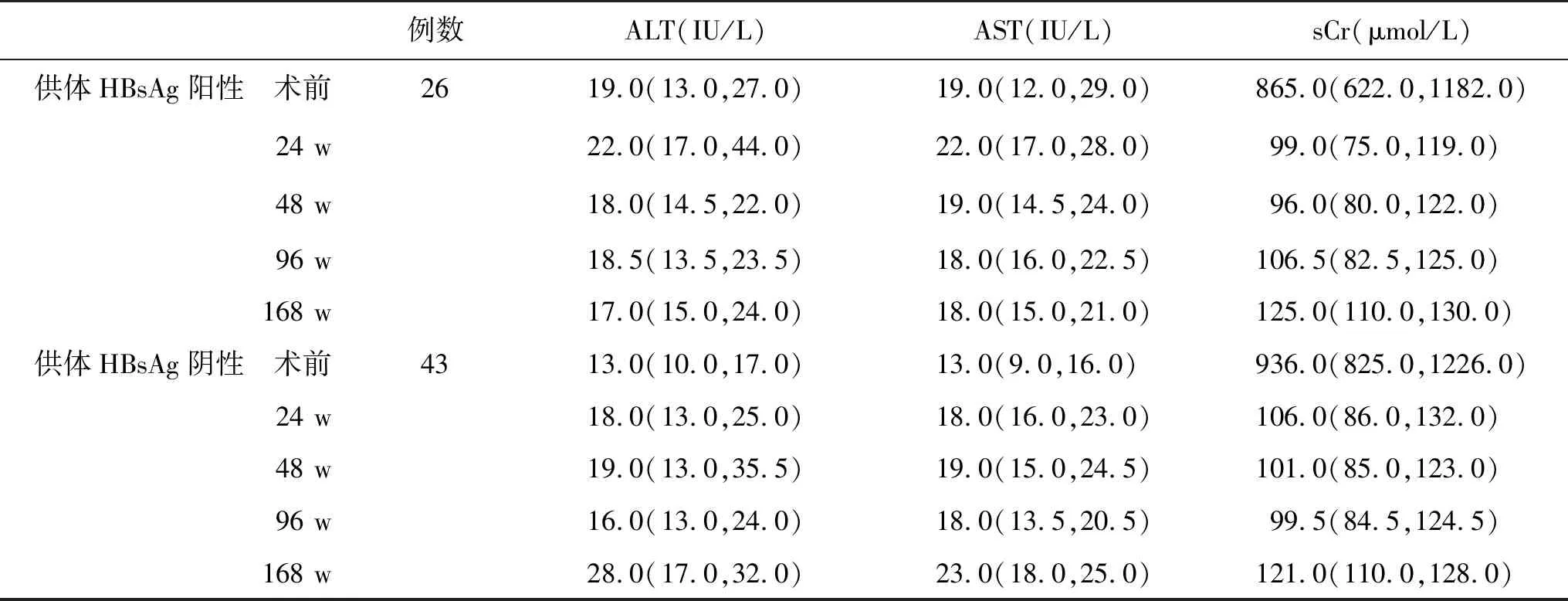
表1 两组肝肾功能[M(P25,P75)]比较
2.3 血清HBV DNA阳性与阴性组肝肾功能指标比较 两组差异均无统计学意义(P>0.05,表2)。

表2 两组肝肾功能[M(P25,P75)]比较
3 讨论
随着LAM和ETV等口服抗病毒药物的问世,大部分肾移植受体的HBV感染可以被有效控制。有研究指出,与血清HBsAg阴性患者相比,HBV感染的肾移植受体在正规接受抗病毒治疗后并未表现出更高的病死率[6, 7]。本研究也发现,2例死亡患者肝功能指标均正常,死亡原因与HBV再激活无关,可能是术后长期应用免疫抑制剂导致机体免疫力下降,从而发生重症感染引起多器官脏器功能衰竭而死亡。DGF是肾移植术后最常见的早期并发症,主要原因包括急性肾小管坏死、排斥反应、药物毒性和手术并发症等[8]。DGF患者远期预后也差。本组发生DGF患者均及时得到处理并密切随访,截至到随访结束未发生死亡等不良事件。一般认为,选择非亲属肾移植患者术后DGF发生率可能更高。
对于血清HBsAg阳性的肾移植受体,初治即应采用高耐药屏障、对肾功能损害小的抗HBV治疗药物,如ETV或替诺福韦酯(TAF)等,有效的核苷(酸)类似物(nucleoside/nucleotide analogues,NAs)药物可通过抑制病毒复制,延缓肝病进展和降低HCC的发生率,显着提高肾移植患者10 a生存率(约为81%~89%) 和移植物存活率 (约为86%)[9-11]。根据国内外指南的推荐意见,即对于肾功能恶化或估算的肾小球滤过率(eGFR)降低的CHB患者(包括进行透析、肾移植患者),特别是在老年患者,建议抗HBV治疗首选ETV和TAF[1, 12]。对肾移植患者而言,抗HBV治疗的目标是维持血清HBV DNA阴性,防止肾移植术后肝功能受损[13]。本组所有血清HBsAg阳性的肾移植受者术前即接受了ETV抗病毒治疗,术前所有受者血清HBsAg阳性,术后虽无患者实现HBsAg阴转,但术前血清HBV DNA阴性患者术后未出现病毒学反弹。术前HBV DNA阳性的患者接受抗HBV治疗52周左右,12/17例(70.6%)实现病毒学应答。相较于普通人群抗HBV治疗1 a病毒学应答率,两者之间无显著性差异,表明对此类特殊人群应用ETV抗病毒治疗疗效稳定[1]。1例更换药物后经高灵敏PCR检测血清HBV DNA仍维持低水平,考虑该患者发生了低病毒血症。长期的低病毒血症可能会进一步促进耐药演变,与肝纤维化进展甚至肝癌的发生有关[14]。截至到随访结束,所有患者未发生肝硬化或肝癌等不良事件,表明在肾移植受体尤其是基线病毒载量阴性的患者应用ETV抗病毒治疗安全有效。
我国每年需要接受肾移植的患者远远大于实际接受肾移植的患者,供需失衡、器官资源的短缺在过去严重限制了我国器官移植事业的发展[15]。HBV感染会对移植后的移植物或受体的生命产生直接的影响,HBV感染的供肾被认为是高风险供肾来源[16]。国内有研究证明 ETV联合乙型肝炎免疫球蛋白可有效减少接受血清HBsAg阳性供肾的肾移植受体术后乙型肝炎短期发作[17]。在本研究,对接受血清HBsAg阳性供肾的受体应用乙型肝炎免疫球蛋白联合抗病毒治疗,术后肝肾功能并未出现异常,表明在有效的预处理和抗病毒治疗下,供肾血清HBsAg阳性与否并不会对术后肝肾功能造成影响。多项研究也证实,血清HBsAg阳性的供肾对血清HBsAg阳性的受体是安全的[18-20]。
既往研究表明,术前受体基线血清HBV DNA阳性与否、肾移植术后免疫抑制剂选择、ABO血型是否相符可能会影响肾移植受者预后[16, 21, 22]。本研究结果表明,术前受体基线HBV DNA阳性与阴性组术后肝肾功能无明显差异,与既往研究有所不同。随着NAs药物的更新换代,与耐药发生率较高的LAM和对肾脏损害较大的替诺福韦(TDF)等药物相比,ETV在初治的肾移植受者有着更好的长期疗效和抗耐药性[23, 24]。国内外多项研究指出,血清HBsAg阳性的患者术后应用FK506者生存率和肝功能异常发生率等方面均优于CsA[22, 25, 26]。有研究指出,在合理地应用免疫抑制剂的情况下,与ABO血型相容的患者相比,ABO血型不相容的患者术后移植物存活率和肝肾功能异常发生率并无显著性差异[21]。本研究结果也支持这一观点。
综上所述,应用ETV治疗血清HBsAg阳性的肾移植患者,其抗HBV疗效肯定。ETV具有良好的肾脏安全性。抗病毒治疗能够降低血清HBV DNA水平,保护接受免疫抑制剂治疗的受者肝肾功能免受损害,使移植物存活和患者生存。

