产酸菌的分离鉴定及在含氟土壤修复中的应用
张宝华,金 璐,沈晓莉*
(1.中国冶金地质总局浙江地质勘查院,浙江衢州 324000;2.衢州学院化学与材料工程学院,浙江衢州 324000)
氟是人和动物必需的微量元素,在自然界中广泛分布,氟化工、电解铝、钢铁、磷肥等工农业生产及人类活动造成含氟化合物进入环境[1],在土壤和沉积物中积累,影响作物生长[2],并通过食物链对动物或人体产生危害[2-4]。调查数据显示,我国绝大多数地区存在着不同程度的地方性氟病。土壤氟污染治理及修复是值得关注的问题,目前氟污染土壤的修复除采用传统的客土法、深埋法以外,还有化学钝化、淋洗、电动修复、植物修复等技术[5-6]。
植物修复因具有高效、方便、成本低等优势,是当前土壤修复的热点。国内外研究者以土壤-植物系统为对象,对植物中有效态氟含量、富集能力、修复条件、影响因素等问题进行了广泛研究[7-9]。研究发现,茶树(Camelliasinensis)、国槐(Sophorajaponica)、刺槐(Robiniapseudoacacia)、合欢(Albiziajulibrissin)等植物对土壤氟具有较强的富集能力[7-8]。学者们普遍认为,植物组合技术可弥补植物单一修复技术的不足,其中利用植物-微生物联合修复是一种环境友好、前景广阔的绿色治理技术。1986年,Siegel等[10]首次报道真菌代谢作用产物能溶解重金属及其矿物,促进植物对养分及污染元素的吸收。关于产酸菌在重金属污染土壤修复中浸出、吸附等方面的应用研究有较多报道[11-13],而其在氟污染土壤修复中的应用研究很少。2003年,徐仁扣等[14]提出低分子有机酸可通过竞争吸附作用改变土壤氟含量,从而影响土壤氟的生物有效性,这为产酸菌去除重金属以外的氟、磷等元素污染土壤的修复应用奠定了基础。该试验从厌氧污泥中筛选分离出一株产酸菌,采用16S rRNA序列分析技术对菌株进行分子生物学鉴定,并优化其产酸条件。以茶梅苗为研究对象,通过盆栽试验,考察茶梅苗对土壤氟的吸收累积特征;同时将产酸菌应用于茶梅苗对氟污染土壤的修复中,比较修复效果,以探明产酸菌是否能有效促进植物对土壤氟的吸收,为氟污染土壤的绿色生态修复提供理论基础。
1 材料与方法
1.1 样品来源菌株分离样品来源于工业污水处理厂厌氧池。供试植物为1年生茶梅苗(Camelliasasanqua),购自衢州市三山花卉有限公司。
盆栽试验供试土壤采集于衢州学院校园周边农田表层(0~20 cm),除杂、风干、研磨后过20 目标准筛后密封保存备用。土壤基本理化性质:土壤 pH 6.1,有机质含量14.43 g/kg,铵态氮含量86 mg/kg,有效磷含量26.36 mg/kg,速效钾含量213 mg/kg,全氟含量48.89 mg/kg。
1.2 培养基LB培养基:牛肉膏3.00 g,蛋白胨10.00 g,NaCl 5.00 g,琼脂15.00~25.00 g,水1 L,pH 7.4~7.6。产酸菌培养基:葡萄糖20.00 g,蛋白胨5.00 g,牛肉膏3.00 g,酵母浸粉0.50 g,L-半胱氨酸0.50 g,NaCl 5.00 g,K2HPO40.50 g,FeSO4·7H2O 0.01 g,MgSO4·7H2O 0.50 g,水1 L,pH 6.5,固体培养基加1.5%的琼脂。
1.3 产酸菌的筛选分离移取污泥悬液1 mL加至含50 mL LB培养基的150 mL锥形瓶中,于30 ℃恒温培养箱富集培养48 h,取1 mL富集培养液,用灭菌水依次稀释成10-1、10-2、10-3、10-4、10-5和10-6。从10-4、10-5、10-6稀释液中分别移取0.1 mL接种至产酸菌固体培养基上涂布分离,再挑取单菌落进行划线分离直至得到单菌落,滴加酚红溶液观察菌落周边颜色变化,将产生变色圈的菌株接种至产酸菌液体培养基,培养24 h后测定培养液pH,根据pH判定菌株产酸能力,复筛获得产酸能力最佳菌株,甘油密封后保存于-80 ℃冰箱备用。
1.4 菌株的生长特征及产酸能力采用LB培养基活化优势产酸菌株,按1%接种量接种菌悬液至产酸菌液体培养基,在30 ℃、120 r/min 条件下振荡培养24 h,每隔1 h测定培养液OD600,以不接种菌悬液的产酸菌培养基为空白对照。
1.5 菌株形态学及理化鉴定菌落的大小、颜色、形状等形态特征通过肉眼观察;菌体微观形态特征通过革兰氏法染色在光学显微镜下观察。菌株常规生理生化反应(VP试验、甲基红试验、淀粉水解试验、过氧化氢酶试验、糖发酵试验)参照伯杰氏细菌鉴定手册的常规方法进行。
1.6 16S rDNA 序列测定和同源性比较以细菌基因组DNA为模板扩增16S rDNA,扩增采用一对通用引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R(5′-TACGGCTACCTTGTTACGACTT-3′);PCR扩增条件:95 ℃ 4 min;95 ℃ 30 s,55 ℃ 30 s,35个循环;72 ℃ 1.5 min,72 ℃ 5 min。PCR 产物送上海生物工程有限公司完成测序,测序结果通过GenBank Blast 进行相似性分析,用Glustal W 1.8软件包中的邻接法(neighbour-joining)构建系统发育进化树。
1.7 氟污染土壤修复试验采用盆栽试验,选用塑料小盆,每盆装土500 g,按照表1方案分别加入氟化钠溶液,加水保持60%田间持水量,平衡30 d后种植1年生茶梅苗,每盆种3株;微生物修复是在植物种植前喷洒优势产酸菌培养液,每组设3次重复。修复30 d后取土壤和植物样品测全氟含量。
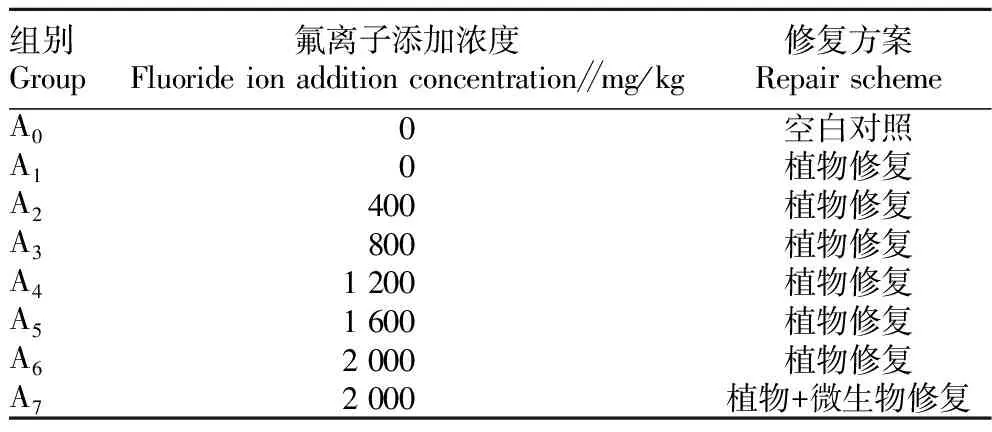
表1 试验设计方案Table 1 Test design scheme
1.8 样品测定植物样品清洗后置于100 ℃恒温烘箱干燥至恒重,用粉碎机粉碎、过40目标准筛,装入密封袋中并贴上标签,置于冰箱保存备用。土壤样品除杂后置于室外阴凉通风口,经自然风干后,研磨过60目标准筛,装入密封袋中并贴上标签,置于冰箱保存备用。应用氟离子选择电极法测定土壤、植物样品全氟含量[15-16]。
1.9 数据分析利用统计分析软件Origin 8.0 对试验数据进行分析和处理。
2 结果与分析
2.1 优势产酸菌的分离与鉴定
2.1.1菌株筛选。经富集、划线分离、滴加酚红变色等途径筛选分离纯化得到13株产酸细菌,按序号从Cs-1依次命名至Cs-13。将13株菌株接种至产酸菌液体培养基培养24 h后测定培养液pH,其中菌株Cs-3培养液pH最低,由初始值6.5下降至3.88,选择作为下阶段试验用菌株。
2.1.2菌株形态与生化鉴定。 菌株Cs-3 在产酸菌固体培养基上培养24 h后,菌落呈白色圆形,不透明,表面凸起光滑,边缘整齐;经革兰氏染色后在显微镜下观察其细胞呈球形状,无芽孢,革兰氏阴性;甲基红、淀粉水解、过氧化氢酶、糖发酵试验呈阳性;荚膜、VP、明胶液化试验呈阴性。
2.1.3菌株的16S rDNA测序结果。菌株Cs-3提交GenBank获得的登录号为MG755257,其16S rDNA序列经Blast比对分析,与GenBank中葡萄球菌属(Staphylococcussp.)的16S rDNA序列具有99%同源性,构建的系统发育进化树如图1所示。结合菌株的形态和理化特征,初步鉴定Cs-3菌株为沃式葡萄球菌(Staphylococcuswarneri),命名为StaphylococcuswarneriCs-3。
2.2 Cs-3菌的生长特征及产酸性能Cs-3菌的生长曲线如图2所示,在24 h内,菌株的生长经历了3个时期:在0~4 h为生长延滞期,该阶段菌株生长缓慢;>4~14 h为对数生长期,菌株生长迅速;>14~24 h菌株生长处于稳定平衡期,这一阶段菌株繁殖速度下降,菌量趋于稳定。菌株培养液的pH随生长周期的变化而变化,在12 h内,菌株培养液pH从5.68下降至3.62;在>12~24 h,菌株培养液pH维持在3.60左右,未发生明显变化。经接种量、温度、转速等条件优化后,Cs-3菌株培养液pH最低可降至3.51。
2.3 氟污染土壤修复结果
2.3.1茶梅苗对氟的吸收累积特征。盆栽条件下种植茶梅苗30 d后,其根、茎、叶等部位的氟含量如图3所示。从图3可以看出,随着土壤外加氟离子浓度的增大,茶梅苗根、茎、叶的氟含量增加。在试验浓度范围内,植物体内氟含量从大到小依次为叶、茎、根,在不添加Cs-3培养液的前提下,A6组茶梅苗叶片部位的氟含量最高,为811.97 mg/kg;添加Cs-3培养液后(A7组),茶梅苗叶片氟含量增加至989.68 mg/kg,两组茶梅苗叶片的氟含量分别是对照组的17.6和20.8倍;茶梅苗根部从土壤中吸收氟离子通过茎部向叶片转移并富集。
为进一步说明茶梅苗对土壤氟的富集能力和吸收特征,分别计算茶梅苗根、茎、叶部位对氟的生物富集系数(BCF)以及茎叶对氟的转运系数(TF),计算结果见图4~5。以富集量最高的茶梅苗幼苗叶片为例,其对土壤中不同浓度氟的富集能力存在差异,在不添加产酸菌仅种植茶梅苗进行修复的情况下,低浓度氟污染组(A1、A2、A3)茶梅苗叶片对氟的生物富集系数为1.298~1.301,高浓度氟污染组(A4、A5、A6)生物富集系数仅为0.582~0.709,明显低于低浓度组。茶梅苗茎叶对氟的转运系数为3.68~7.87,其变化规律与生物富集系数基本一致,即低浓度组转运能力相对较强,高浓度组转运能力减弱。研究表明,茶树类植物对氟的吸收存在低浓度主动、高浓度被动的情况,在高浓度污染下,氟会破坏茶树的细胞结构从而影响其正常生长,茶树根系对氟的吸收转运受包含离子交换态氟含量在内的多种因素影响[17]。
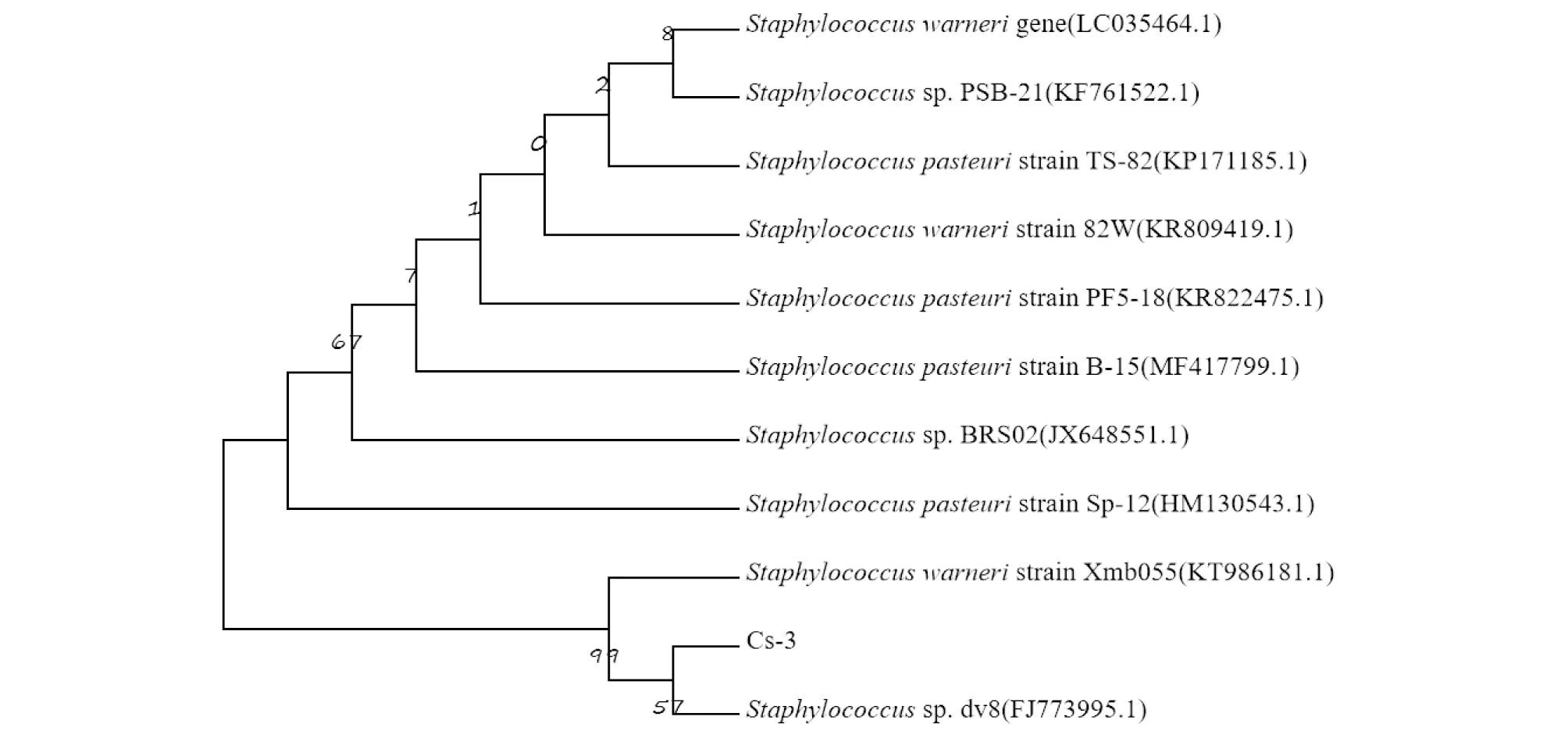
图1 基于16S rDNA序列构建的菌株Cs-3以及相关种、属的系统发育进化树Fig.1 Phylogenetic evolution tree of strain Cs-3 and related species and genera constructed based on 16S rDNA sequence

图2 Cs-3菌的生长曲线及其产酸效果Fig.2 Growth curve of Cs-3 bacteria and its acid producing effect

图3 茶梅苗根、茎、叶中水溶态氟含量Fig.3 Water soluble fluoride content of roots,stems and leaves of Camellia sasanqua seedlings

图4 茶梅苗对氟的生物富集系数Fig.4 Biological concentration factor of fluoride in Camellia sasanqua seedlings

图5 茶梅苗茎叶对氟的转运系数Fig.5 Translocation factor of fluoride in stems and leaves of Camellia sasanqua seedlings
2.3.2修复前后土壤氟含量特征。采用修复前后土壤全氟去除量与初始量的比值计算土壤氟脱除率,结果见图6。从图6可以看出,低浓度污染组(A1、A2、A3)土壤氟脱除率为44.83%~59.09%;高浓度污染组(A4、A5、A6)土壤氟脱除率明显降低,最高仅为37.24%。表现出茶梅苗受高浓度氟污染毒害,吸收累积能力下降,修复效率变差。
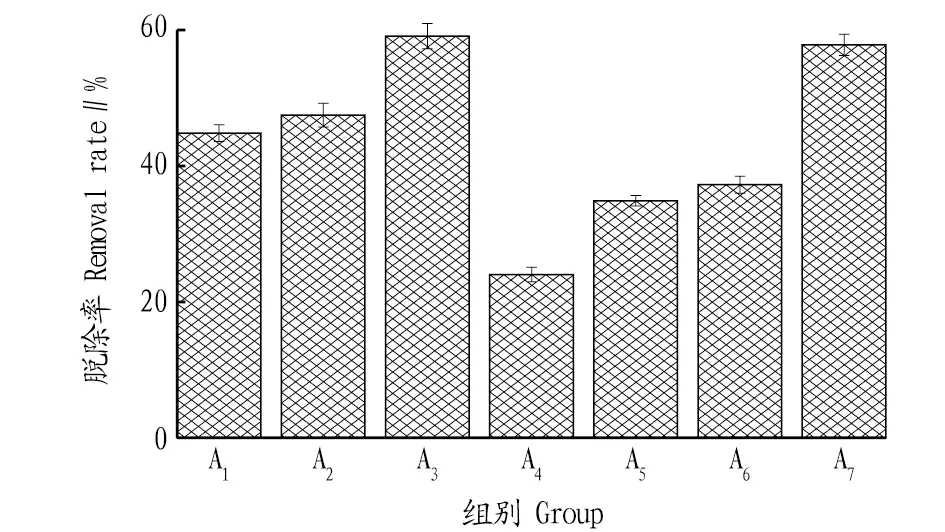
图6 土壤氟脱除率Fig.6 Fluorine removal rate of soil
2.3.3产酸菌对修复效果的影响。以外加2 000 mg/kg氟污染土壤为研究对象,同等条件下种植茶梅苗,比较Cs-3培养液添加的作用效果,结果如图7所示。从图7可以看出,添加了Cs-3培养液的A7组茶梅苗叶片中的氟浓度为989.68 mg/kg,较未添加Cs-3培养液的A6组茶梅苗叶片中的氟浓度(811.97 mg/kg)增加了21.89%;根部和茎部的氟浓度也分别增加了18.18%和29.35%。从土壤氟含量来看,在30 d修复期内,A6组土壤氟含量下降至1 395.76 mg/kg,脱除率为37.24%,而添加了Cs-3培养液的A7组土壤氟含量下降至897.50 mg/kg,脱除率增加至57.81%,土壤氟下降程度较茶梅苗单独修复组更高。可见Cs-3培养液的添加有效促进了茶梅苗对氟的吸收,从而导致土壤氟含量下降,起到促进修复的作用。

图7 产酸菌对氟污染土壤修复的影响Fig.7 Effect of acid-producing bacteria on fluorine contaminated soil remediation
3 讨论
土壤氟的存在形态决定其对环境的危害程度,其中水溶态氟含量是影响植物吸收累积效果的重要因素。另外,不同植物对氟的吸收累积能力差别很大,该试验选用的茶梅苗属山茶科,文献报道山茶科作物可暴露于高浓度的氟环境下正常生长代谢,并在叶片中高度富集氟[18],不同观赏性茶树树叶中的氟含量在790~3 060 mg/kg[7],茶树类植物不同组织对氟的吸收累积能力也不同。该试验中,茶梅苗根、茎、叶中的氟含量随着土壤氟离子浓度的增加而增加,在茶梅苗单独修复30 d的前提下,叶片最高累积量为811.97 mg/kg,高于茎部和根部的累积量,不同部位的累积规律与文献报道的分布规律(叶片>吸收根>主根>茎)[19]略有不同,这可能是在不同氟离子浓度及其他环境条件下,植物体内可能存在不同的适应和转运机制。在该试验研究条件下,茶梅苗茎叶的氟转运系数为3.68~7.87,氟离子易从根部吸收,然后转运到茎部,再到叶片富集积累,但是随着土壤氟浓度的增加,茶梅苗对氟的富集和转运能力下降。
在添加Cs-3培养液作用下,茶梅苗各部位对土壤氟的累积量和土壤氟脱除率均表现为最高,可能存在以下两方面原因:一是Cs-3培养液的pH为3.51,添加到土壤中可增强土壤酸性,而易被植物吸收的水溶态氟含量又与土壤pH呈显著正相关[20],植物在酸性条件下具有更强的富集转移氟的能力[21];另一方面,Cs-3菌株在发酵过程中产生大量低分子有机酸,它们可通过与氟的竞争吸附[22]或络合作用改变土壤氟的存在形态,进而改变土壤氟的生物有效性[23],更利于被植物吸收利用,这一点在重金属污染土壤修复中应用较多。
4 结论
(1)实验室分离得到一株具有产酸能力的Cs-3菌株,最佳产酸条件下,培养液最低pH为3.51。经过对Cs-3菌的形态特征、生理生化特性以及16S rDNA序列分析,初步鉴定为沃式葡萄球菌(Staphylococcuswarneri)。
(2)茶梅苗对氟污染土壤具有良好的修复作用,土壤氟脱除率最高为59.09%。茶梅苗不同部位对氟的吸收累积能力表现为叶>茎>根,在土壤氟添加量为0~2 000 mg/kg,茶梅苗单独修复30 d时,叶片最高氟含量为811.97 mg/kg;且随着土壤氟含量的增加,茶梅苗各部位的氟累积量升高。
(3)添加Cs-3培养液能有效促进茶梅苗对土壤氟的富集吸收,在外加2 000 mg/kg氟污染水平下,Cs-3与茶梅苗联合修复效果最好,叶片氟累积量从811.97 mg/kg增加至989.68 mg/kg;修复30 d后,土壤氟浓度下降至897.50 mg/kg,下降程度较茶梅苗单独修复组更高。

