木薯花性别分化关键时期的转录组分析及雌花分化相关候选基因的筛选
陈会鲜 梁振华 黄珍玲 韦婉羚 张秀芬 杨海霞 李恒锐 何 文 李天元 兰 秀 阮丽霞 蔡兆琴 农君鑫
木薯花性别分化关键时期的转录组分析及雌花分化相关候选基因的筛选
陈会鲜 梁振华 黄珍玲 韦婉羚 张秀芬 杨海霞 李恒锐*何 文*李天元 兰 秀 阮丽霞 蔡兆琴 农君鑫
广西南亚热带农业科学研究所, 广西龙州 532415
针对木薯雌花数量严重缺乏的育种难题, 本试验以木薯品种‘新选048’为试材, 测定木薯花性别分化关键时期雌花和雄花的转录组数据, 分析差异表达基因的功能及其可能参与的调控通路, 揭示木薯雌花分化的分子机制, 挖掘木薯雌花分化的相关候选基因, 并采用qRT-PCR方法对测序结果进行验证。结果表明: 在木薯花性别分化关键时期, 雌花和雄花共有545个差异基因, 其中48.63%的差异基因富集到花器官的形态建成及发育的GO途径, 且富集到植物苯丙素生物合成、植物激素信号传导2个代谢通路的基因最多, 4个花性别分化基因、、、在雌花中显著上调表达, 4个细胞分裂素信号通路基因、、、在雌花中显著上调表达, 生长素的早期响应基因、、、在雌花中显著下调表达。因此, 木薯花性别分化主要涉及花粉、配子体、花器官的形态建成及发育的生物途径和植物苯丙素生物合成、植物激素信号传导2个代谢通路, 细胞分裂素和生长素可能参与了木薯雌花分化过程,、、、、、、、可能是木薯雌花分化的正调控基因。
木薯; 分化关键时期; 转录组; 雌花; 基因
花性别分化是植物成花生理的一个重要环节, 受到广泛关注。1991年, Coen和Meyerowitz首先提出花发育的“ABC模型”, 经过不断的补充修正, 科学家逐渐建立了更为完善的“ABC(DE)”模型, 该模型指出植物的花萼、花瓣、雄蕊、心皮等4个花器官的发育分别由A、B、C、D、E类基因共同控制, 其中B类基因调控雄蕊和花瓣的发育; C类基因调控心皮和雌蕊的发育。随着研究的不断深入, 研究者相继从玉米[1]、黄瓜[2]、油桐[3]、豆柿[4]等多种植物中挖掘出性别决定基因, 发现植物花性别分化相关基因大多属于MADS-box基因[5], 且在激素合成、信号转导、雌雄蕊败育等方面具有重要的调控作用。因此, 植物花性别分化可能与B类、C类的MADS- box基因有着密切的联系。
木薯(Crantz)属于雌雄同株异花植物, 其雄花比例约为87%~94%之间, 而雌花比例却仅有6%~13%[6-7]。木薯雌花数量严重缺乏降低了木薯自交和杂交的结实率, 从而降低了木薯的育种效率[8-10]。因此, 如何调控出更多的木薯雌花, 是木薯育种亟需解决的问题, 但木薯雌花分化的机制还未完全明确。早在20世纪60年代, 研究者就开始了木薯雌花分化机制的探索, 发现水分、营养、植物激素是木薯雌花分化的调控因子[11-15]; 近年来, 研究者开始运用转录组技术探索木薯雌花分化的分子机制。丛汉卿等[16]利用RNA-seq技术对木薯花序与叶片sRNA进行测序, 筛选出调控花器官的形成和胚珠及花药发育的基因miR172和miR167; 韦丽君等[17]对即将开放的木薯雌雄花进行转录组分析, 筛选出雌雄花分化相关基因87个, 分为MYB、WRKY、bHLH和ERF四大类转录因子。虽然, 丛汉卿等[16]、韦丽君等[17]已开展了木薯雌花分化机制的相关研究, 但是两者研究采用的试材分别是木薯花性别未分化的花芽和花性别分化完成的雌雄花, 而转录组具有时间和组织的特异性, 使得前人的研究结果可能存在一定的局限性。
为了深入探讨木薯雌花分化的机制, 本研究团队在前期工作中, 利用石蜡切片和电镜扫描技术, 观察木薯雌雄花分化发育过程, 确定了木薯花性别分化的关键时期为现蕾期后3~7 d[18]。在确定木薯花性别分化关键时期的基础上, 本试验有针对性地分析木薯花性别分化关键时期的雌雄花转录组数据, 探索木薯花性别分化过程中差异表达的基因功能及可能参与的调控通路, 挖掘木薯雌花分化的相关候选基因, 为木薯的分子育种提供重要的基因资源, 也为木薯雌花的人工调控提供理论基础, 具有重要意义。
1 材料与方法
1.1 试验材料
本试验的供试品种为‘新选048’, 该品种来源于广西大学, 具有开花早、花量多、雌花占比高的开花特性, 以该品种为供试材料可有效提高样品采集的效率。在木薯现蕾后4~5 d, 雌雄花分化活跃, 是木薯雌花和雄花分化的关键时期, 此时的雌花、雄花在花性别分化上更具特异性和代表性, 因而采集木薯现蕾后4~5 d的雌花、雄花进行转录组测序。
试验设置3个试验小区, 每个小区种植100株木薯植株。采集每个小区现蕾后4~5 d的木薯花序, 用液氮速冻后带回实验室, 在低温的环境下用镊子迅速剥离同一花序上的雌花、雄花, 然后同一个小区的雌花或雄花分别合在一起, 3个小区的雌花样品分别记为A1-1、A1-2、A1-3, 雄花样品分别记为A2-1、A2-2、A2-3, 样品放置在-80℃冰箱保存备用。
1.2 木薯花性别分化关键时期雌花、雄花的转录组测序方法
采用DP424试剂盒(天根生化科技(北京)有限公司), 从6个样品中提取总RNA。采用琼脂糖凝胶电泳分析RNA的完整性及是否存在DNA污染。总RNA为建库起始RNA, 总量大于等于1 µg。使用Oligo-dT引物进行扩增, AMPureXP beads分选250~300 bp cDNA, 获得纯化后文库。文库完成构建后, 稀释文库至1.5 ng μL-1, 使用Qubit2.0 Fluorometer进行初步定量, 再使用Agilent 2200 Bioanalyzer检测文库片段, 当片段长度符合预期后上机测序。将质检合格的文库根据有效浓度和目标数据量进行Illumina Novaseq 6000双端测序, 得到读长为150 bp的配对序列。
1.3 转录组测序数据分析及差异基因功能富集
使用fastp过滤下机数据(PFdata), 去除低质量数据和接头。使用HISAT2 (v2.1.0)将cleanreads映射到木薯参考基因组(https://www.ncbi.nlm.nih.gov/ genome/?term=%20Manihot%20esculenta), 用Samtools软件对比对结果进行格式转换、排序; 使用Htseq软件对cleanreads进行计数; 用StringTIE组装转录本, 并统计基因丰度表达; 使用R语言(版本: 3.6.3)进行转录组下游数据分析; 用DESeq2软件包分析基因表达量差异。对于生物学重复, 将差异基因筛选的条件设置为|log2FC|≥1,-adjust≤0.05, 获得差异表达的基因。使用bioDBnet网站进行基因ID的转换。利用R包ClusterProfiler (v4.2.2)对差异基因进行KEGG和GO富集分析, 筛选-value≤0.05为显著通路。
1.4 木薯雌花分化相关候选基因的筛选
前人的研究表明植物花性别分化与植物激素、性别决定基因有着密切的联系。因此, 木薯雌花分化相关候选基因的筛选主要从性别分化相关GO途径、激素信号转导的pathway途径筛选, 获得非冗余基因。
1.5 木薯雌花分化相关候选基因的qRT-PCR验证
使用Primer Premier引物设软件设计qRT-PCR引物, 引物序列详见表1, 由生工生物工程(上海)股份有限公司合成, 所有引物均用PCR扩增、电泳和溶解曲线进行测试, 以保证引物具有特异性。每个样本设置3个技术性重复。按照ChamQUniversal SYBR qPCR Master Mix试剂盒说明书对目的基因进行qRT-PCR检测。用Bio-Rad CFX Manager 3.1软件收集处理数据, 以β-actin (Manes.13G084300)为内参基因, 用2-ΔΔCt对mRNA进行定量数据分析, 并用检验进行统计分析。

表1 荧光定量PCR引物设计
2 结果与分析
2.1 木薯花性别分化关键时期雌花和雄花转录组测序质量分析
对6个样品进行转录组测序, 将数据上传于服务器中进行质控、比对、计数, 分析碱基的组成及质量分布。通过对6个cDNA文库进行测序, 雌花得到5098.2~3542.1万个读数, 7.25~4.83 G碱基数; 雄花得到4220.5~3198.1万个读数, 5.79~4.38 G碱基数。按照二代测序的要求, Q20 (碱基正确识别率99%)的碱基比例必须大于95%且不能低于90%; Q30 (碱基正确识别率99.9%)的碱基比例必须大于85%且不能低于80% (表2)。本试验中, 6个cDNA文库的Q20值均在95%以上, Q30值均在87%以上, 这说明本试验的测序数据质量很高, 可用于后续的木薯雌花分化相关候选基因的挖掘工作。
2.2 木薯花性别分化关键时期的雌花、雄花差异基因表达分析
利用R软件包DESeq2进行差异分析, 结果如图1和图2所示, 雌花VS雄花共获得545个差异基因, 其中已知基因为480个, 未知基因为65个; 共有459个基因在雌花中上调, 共有86个基因在雌花中下调; 共有33个基因单独在雌花中表达, 共有143个基因在雄花中单独表达。从差异基因的火山图(图3)来看, 差异较大的基因有:、、、、、、。
2.3 差异表达基因的GO富集分析
对545个差异基因进行GO富集分析, 一共显著富集到29个GO条目(二级分类), 包括14个生物过程(biological process)、8个细胞组分(cellular component), 7个分子功能(molecular function)。前20条显著富集到的GO条目(三级分类)如图4, 其中涉及到生物过程类别的GO条目18条, 涉及到分子功能类别的只有2条。在生物过程中, 60.79%的GO条目是关于花粉、配子体、花器官的形态建成及发育, 涉及的基因总数为265个, 占总差异基因数的48.63% (图5)。这说明木薯花性别分化关键时期的配子体及花器官的发育或败育最为活跃。
2.4 差异表达基因的KEGG功能富集分析
差异表达基因的KEGG功能富集分析结果如图6所示, 排在前20的代谢通路中苯丙素的生物合成、植物激素信号传导、丙酮酸代谢、类黄酮生物合成、甘油脂类新陈代谢、玉米素生物合成、泛酸和辅酶A的生物合成、柠檬烯和蒎烯的降解、二苯乙烯类二芳基庚烷类和姜辣素的生物合成等10个通路的值小于0.02, 说明木薯雌雄花分化涉及到苯丙素、丙酮酸、类黄酮、甘油脂类、二苯乙烯类、二芳基庚烷类、玉米素、泛酸、姜辣素、柠檬烯、蒎烯等物质的代谢通路, 其中苯丙素生物合成、激素信号传导2个代谢通路涉及的基因最多。这说明苯丙素生物合成、激素信号传导2条代谢通路可能参与了木薯雌雄花的分化过程。
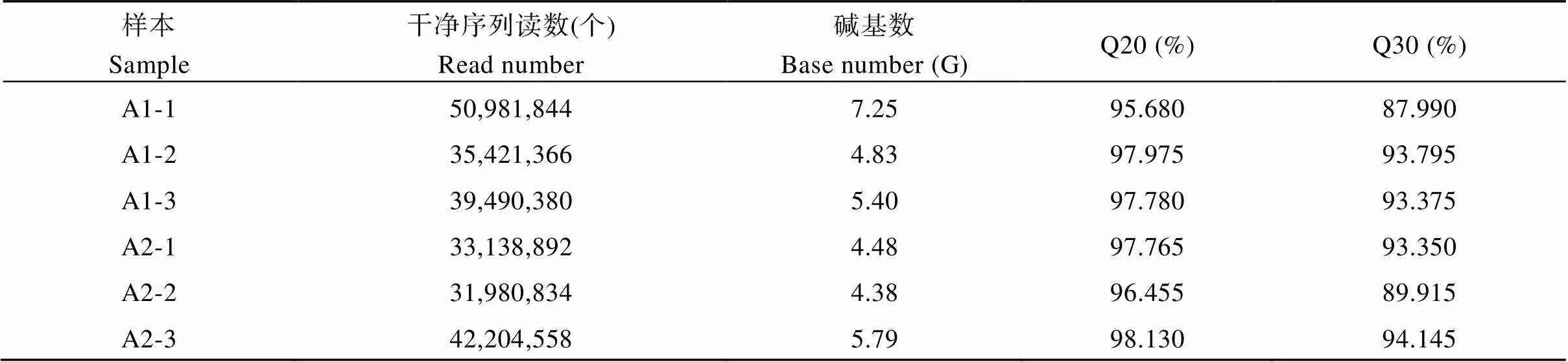
表2 碱基信息统计表

图1 差异基因的统计图(雌花)

图2 差异基因的维恩图图
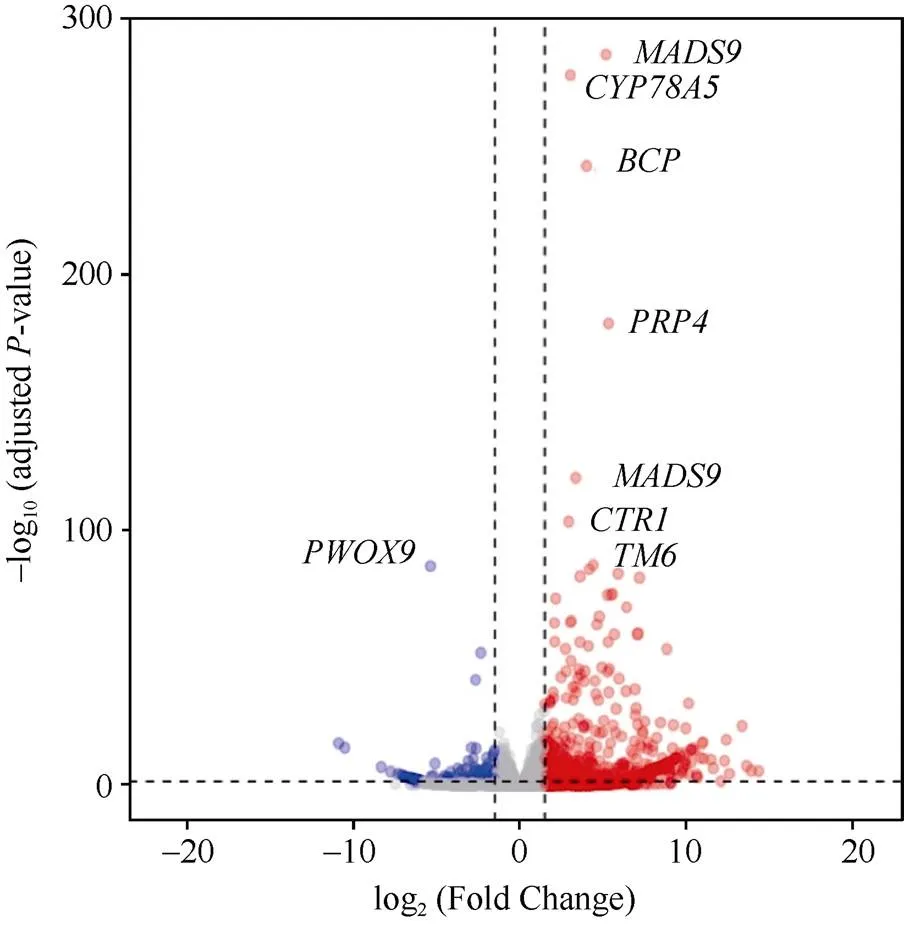
图3 雄花 vs 雌花的火山图
红色区域表示雄花上调, 蓝色区域表示雄花下调基因。
Red areas represent up-regulated genes in male flowers, and blue areas represent down-regulated genes in male flowers.
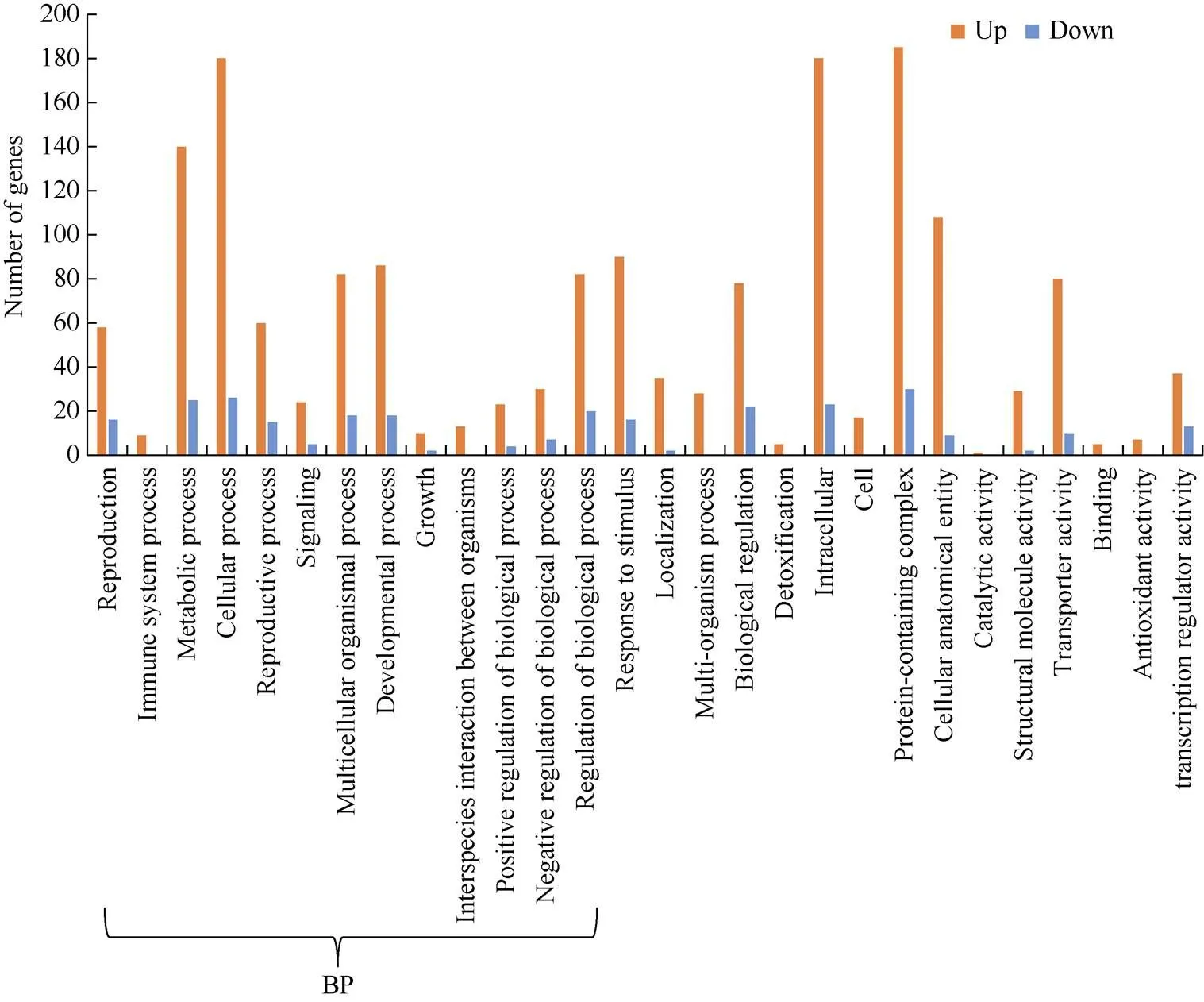
图4 前30条显著富集到的GO条目
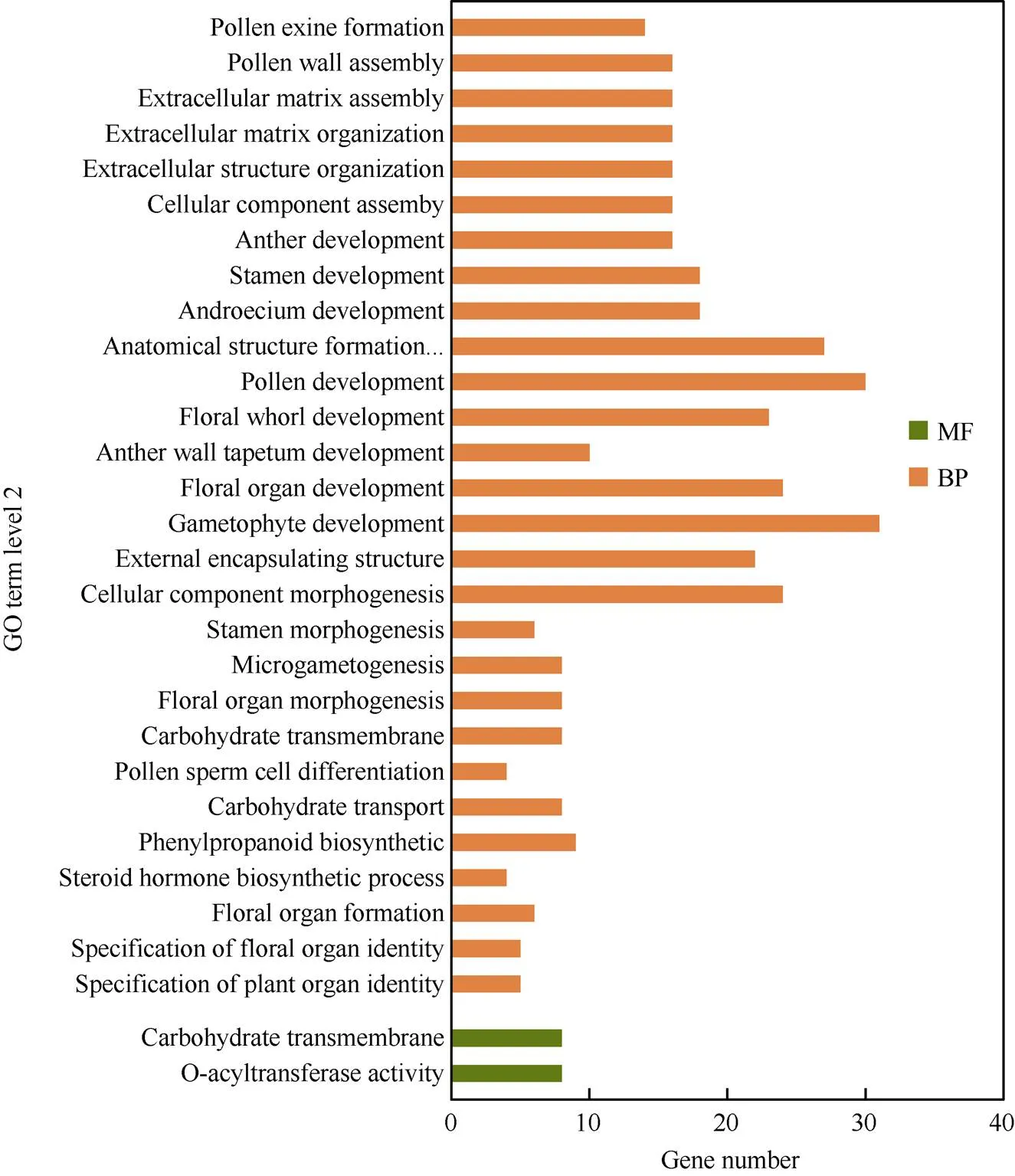
图5 差异基因显著富集的GO条目
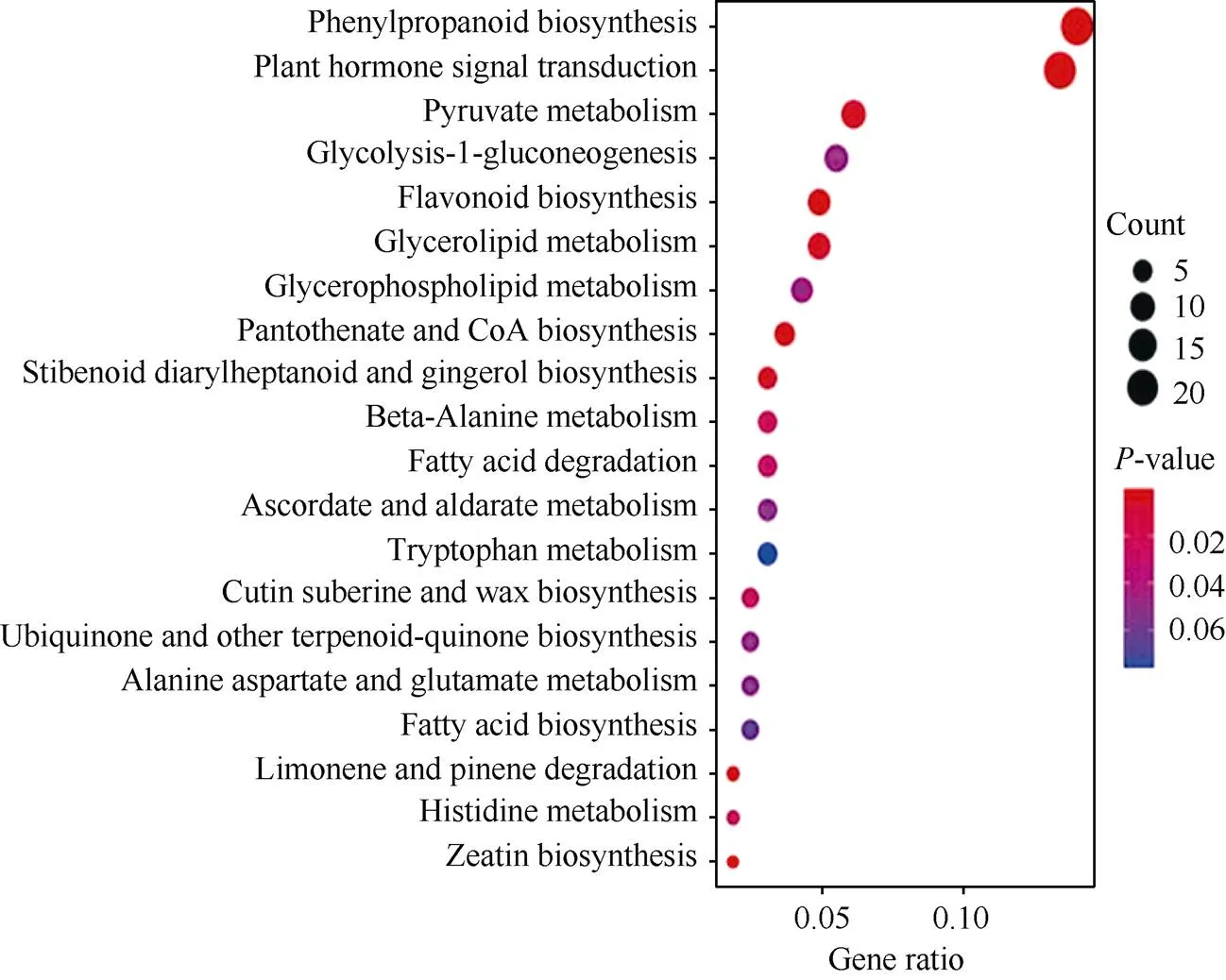
图6 前20条显著富集到的KEEG通路
2.5 木薯雌花分化相关候选基因筛选
2.5.1 木薯花性别分化相关基因的表达分析 通过对差异基因进行GO数据库的功能注释分析, 获得生物过程类别中花发育途径的21个差异基因, 除去功能冗余基因, 共注释到17个基因, 其中有2个基因被注释为, 2个基因被注释为, 2个基因被注释为, 2个基因被注释为, 其余差异基因分别被注释为、、、、、、、、、、、、通过绘制热图进一步分析差异基因在雌雄花中的表达水平(图7)发现,、、、在雌花上显著上调;、、、、、、、、、、、、在雌花中显著下调。这21个基因的上下调控表达可能参与到木薯的雌花分化过程。
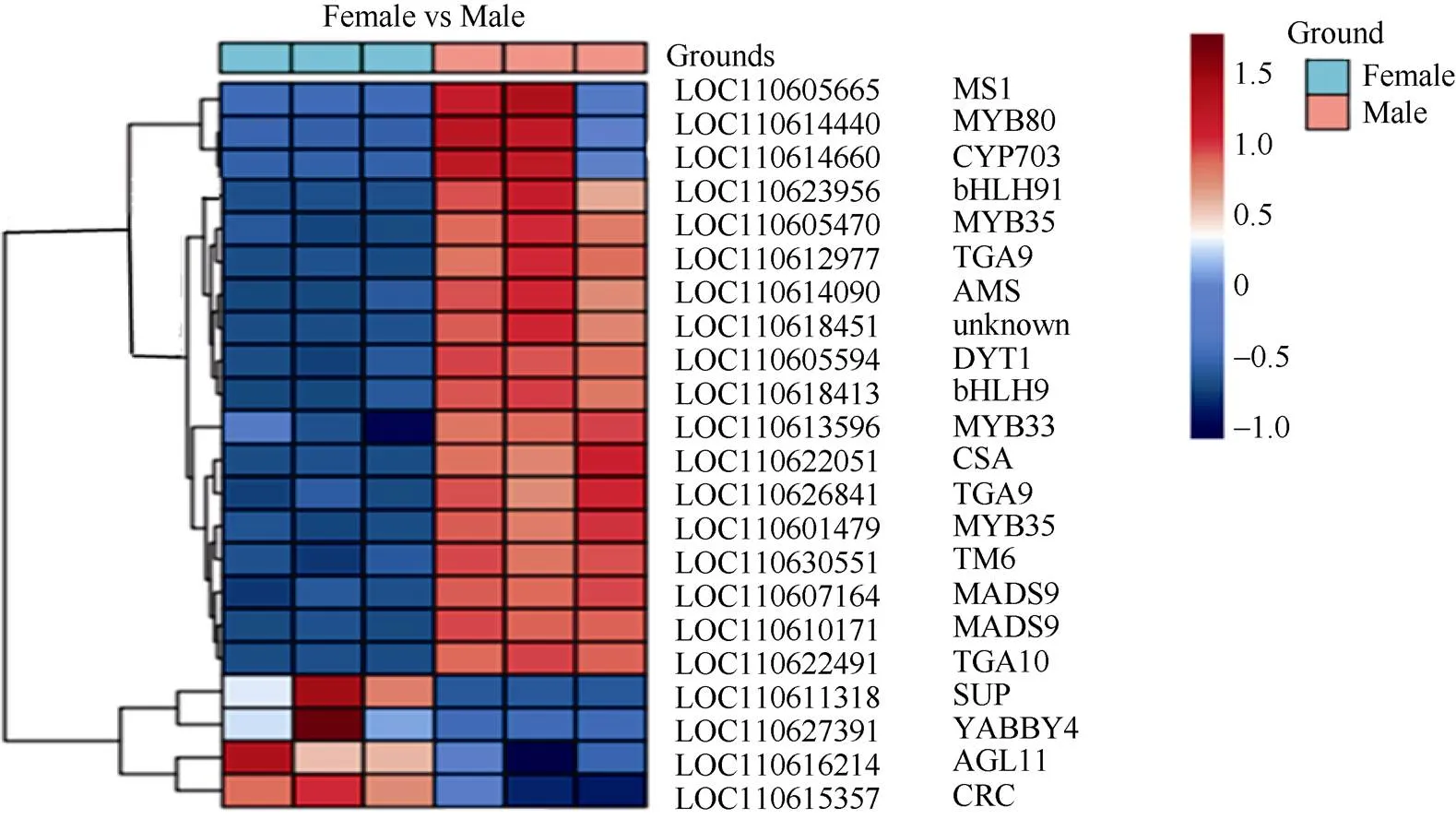
图7 花性别分化相关候选基因热图
颜色代表响应的的FPKM值, 数值越大, 颜色越红, 从左至右样本依次为雌花-1 (A1-1)、雌花-2 (A1-2)、雌花-3 (A1-3)、雄花-1 (A2-1)、雄花-2 (A2-2)、雄花-3 (A2-3)。
The color represents the FPKM value of the response. The larger the value, the redder the color. From left to right, the samples are female flower-1 (A1-1), female flower-2 (A1-2), female flower-3 (A1-3), male flower-1 (A2-1), male flower-2 (A2-2), and male flower-3 (A2-3).
2.5.2 激素信号传导相关基因的筛选 差异表达基因在KEGGpathway数据库中注释, 获得18个植物激素信号转导途径(KEGGID: mesc04075)的差异基因。其中2个基因被注释为丝氨酸/苏氨酸激酶(Serine/threonine-protein kinase,)、2个基因被注释为生长素蛋白基因()、3个基因被注释为吲哚-3-乙酸氨基合成酶(Indole-3-acetic acid-amido synthetase,)、4个基因被注释为TGA转录因子、2个基因被注释为双组分反应调节器ARR基因、2个基因被注释为生长素反应蛋白(Auxin-responsive protein,)、1个基因被注释为组氨酸激酶(Histidine kinase 4,)、1个基因注释为组氨酸磷酸转移蛋白(Histidine-containing phosphotransfer protein 4,)、1个基因注释为MYC转录因子。根据基因功能注释结果, 这19个差异基因中, 4个基因参与细胞分裂素信号通路, 且在雌花中显著上调(图8); 7个基因是生长素的早期响应基因, 除了以外其他6个基因均在雌花中显著下调(图9)。由此猜测, 细胞分裂素可能对木薯雌花分化具有促进作用, 生长素对木薯雌花分化可能具有抑制作用。
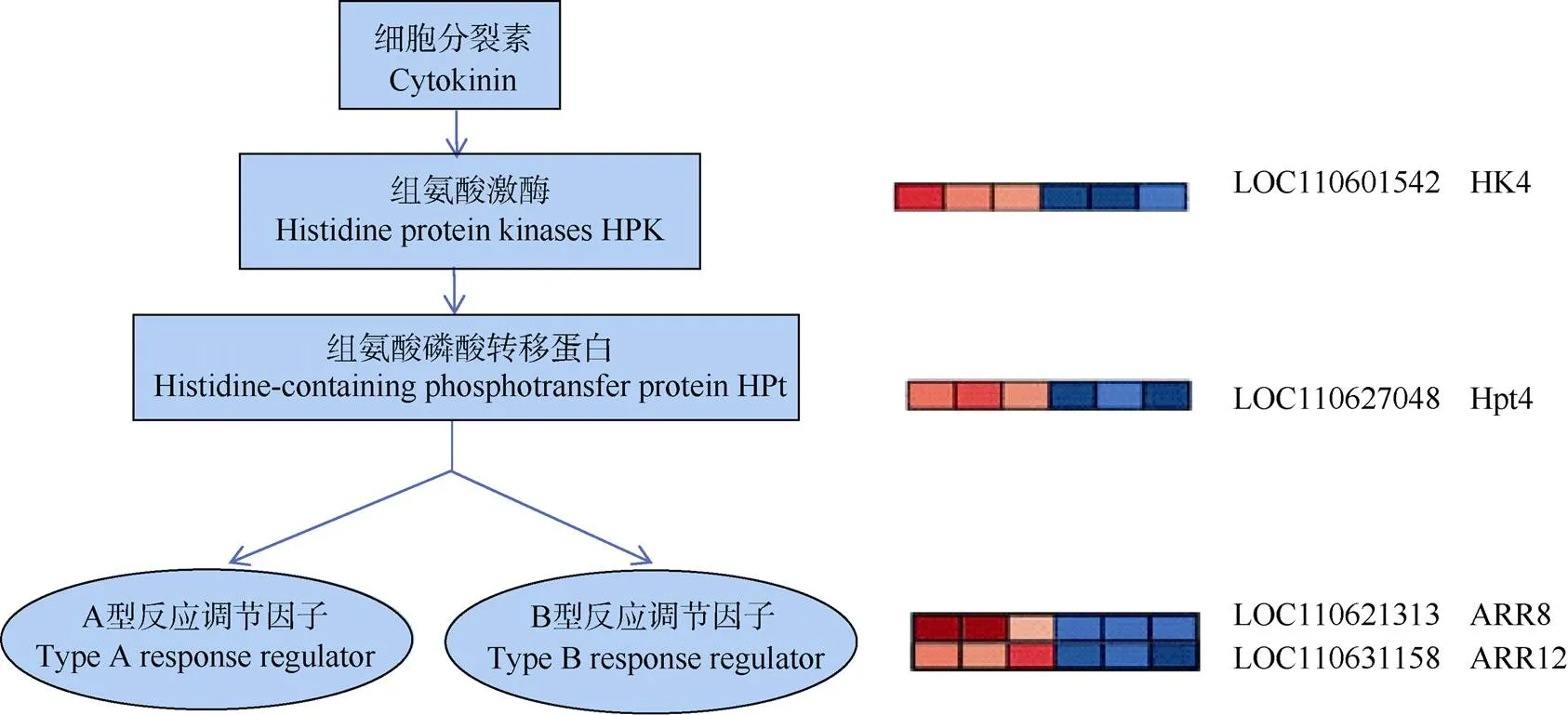
图8 细胞分裂素信号通路基因表达模式分析
颜色代表响应的的FPKM值, 从左至右样本标号参照图7。
The color represents the FPKM value of the response, and the sample labels from left to right refer to those given in Fig. 7.
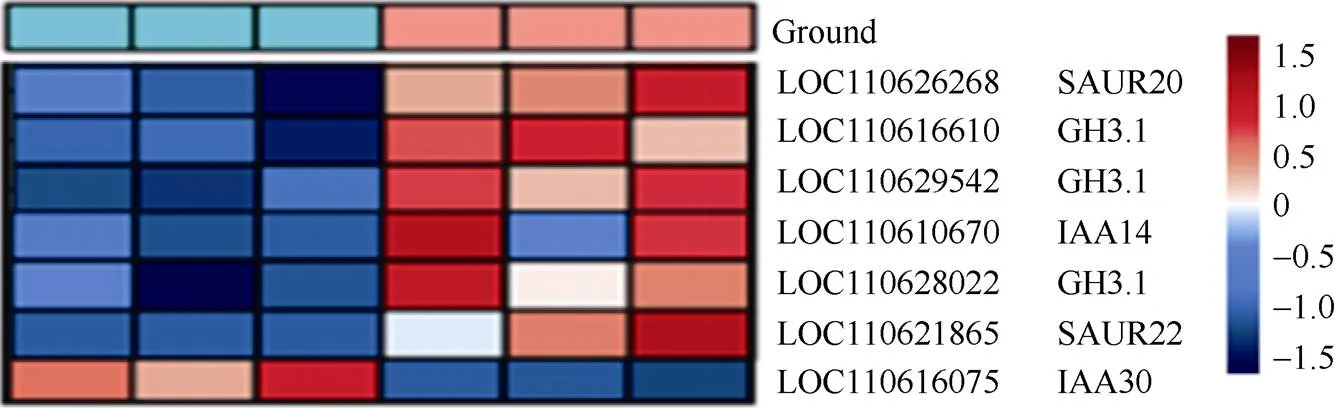
图9 生长素响应基因的表达模式分析
颜色代表响应的的FPKM值, 从左至右样本标号参照图7。
The color represents the FPKM value of the response, and the sample labels from left to right refer to those given in Fig. 7.
2.6 差异表达基因的qRT-PCR验证
在木薯雌花分化相关候选基因中, 选取3个上调基因(、、)、2个下调基因(、)、3个细胞分裂素代谢通路相关的基因(、、)、2个细胞分裂素代谢通路的基因(、), 进行qRT-PCR分析。由图10可知,、、CRC、、在雌花中的相对表达量显著上调, 表达差异倍数在3.50~8.29;、、、在雌花中的表达量显著下调, 表达差异倍数为3.60~6.14; 差异分析结果显示, 除外, 其他9个基因的表达量在雌花、雄花中的差异显著。虽然,在雌雄花中的表达量差异不显著, 但是10个差异基因在qRT-PCR验证中的表达量变化趋势与转录组分析中的表达量变化趋势相吻合, 说明转录组数据准确。

图10 差异表达基因qRT-PCR验证的相对表达量
柱状图上小写字母表示雌花、雄花之间10个候选基因的表达量差异达显著水平(< 0.05)。
Different lowercase letters on the histogram indicate that there are significantly different in the relative expression levels of 10 candidate genes between female and male flowers at< 0.05.
3 讨论
3.1 木薯花性别分化可能主要涉及花器官形态建成、发育的生物途径, 且苯丙素生物合成、植物激素信号传导是木薯花性别分化的重要代谢通路
本研究中木薯花性别分化关键时期, 雌花、雄花的差异表达基因主要参与花粉、配子体、花器官的形态建成及发育的生物学过程。植物花在发育早期均有一个“两性”阶段, 这个时期同时的花同时存在雌蕊和雄蕊, 但随着花发育的持续进行, 雄花中的雌蕊或雌花中的雄蕊会在花性别分化关键时期逐渐降解或败育, 从而形成单性花[19]。可见, 花性别分化关键时期是雌、雄配子体发育和败育的活跃时期, 故而这个时期的差异表达基因主要参与花粉、配子体、花器官的形态建成及发育的生物学过程, 这也侧面验证了本研究的采样具有代表性。此外, 雌花的上调表达的基因数量远远低于下调表达的基因(在雄花中上调表达的基因)数量, 造成这一现象的原因可能是雄花发育过程相较于雌花发育更为复杂,其调控和生理代谢可能更活跃, 这一点在其他研究中也得到了验证[20]。
在显著富集的Pathway中, 木薯花性别分化关键时期的雌雄花差异基因富集到植物苯丙素生物合成、植物激素信号传导2个代谢通路的DEG最多, 说明苯丙素生物合成、植物激素信号传导2个代谢通路可能是影响木薯花性别分化的重要代谢通路。平阿敏[21]在分析白菜花芽1级~5级分化过程的表达谱, 发现白菜花器官发育过程中苯丙素的生物合成显著性富集。虽然, 目前没有证据证明苯丙素生物合成与植物的花器官发育有直接关系, 但是合成苯丙素的相关酶基因参与合成黄酮类色素[22], 而黄酮类色素又被证实与植物花器官发育有直接的关系。这就间接说明苯丙素生物合成与花器官发育密切相关。植物激素在植物性别分化过程中起重要的调控作用, 是植物花性别分化的诱导信号之一[23]。因此, 木薯性别分化的差异基因显著富集到植物植物激素信号传导的代谢通路也在情理之内。
3.2 AGL11、YABBY4、CRC、SUP可能调控木薯雌花心皮和子房的发育,MYB33、MYB35、MYB80等13个基因可能负调控木薯雌花分化
类基因之间相互协调在植物雌蕊发育过程中起重要作用,类基因可分为分支和分支,单独形成一支, 属于ABCDE模型中的C类基因[24-25]。目前在在番茄、葡萄、水稻、石榴等物种上已被验证出对雌花的子房、胚珠发育有着重要调控作用[26-27]。基因家族是一类种子植物特有转录因子, 在拟南芥中含6个基因家族成员, 其中就包括本研究的上调基因(,)和(),基因在胚珠发育中发挥重要作用[28-32],在拟南芥中参与蜜腺、心皮远轴端的发育[33-34]。类基因主要参与雌蕊及胚珠的发育, 并调节花第3、4轮细胞的增殖平衡, 其突变体的雄蕊增多且心皮的发育受阻[35]。本研究中、、、等基因在木薯雌花中显著上调, 这说明木薯的、、、基因可能通过调控木薯雌花的心皮及子房的发育, 对木薯雌花分化起到正调控作用。
MYB转录因子在花药发育过程中发挥重要的调控作用,、、在拟南芥的花粉壁、绒毡层发育中起到重要作用, 其突变体会出现花粉败育或花粉壁发育畸变[36],与序列相似, 且在花粉发育方便具有相同的功能, 其突变体会出现花药发育缺陷的表型[37-38]。绒毡层参与花粉壁物质合成, 为小孢子发育提供营养并适时地分泌胼胝质酶以释放小孢子, 其在花药发育中发挥着重要的作用。遗传途径被证实参与调控拟南芥绒毡层发育, 其中和在绒毡层早期发育中起作用, MS1在绒毡层晚期发育中起重要作用[39-40]。此外,、、、等基因在其他作物上被证实参与植物花粉的发育[40-44]。因此,、、、、、、、、、、、等基因主要调控花粉的发育, 其下调表达则使得花粉壁或绒毡层的发育受阻, 从而出现雄蕊的退化或败育, 对木薯雌花分化起到负调控作用, 很好解释了、、、、、、、、、、、基因在木薯雌花中显著下调的现象。是导致水稻雄性不育的基因[45-46], 但是在木薯雌花中却呈现下调表达。造成这种差异的原因可能是物种不同导致功能上的差异, 但需要进一步验证, 以明确木薯的基因在雌花分化中的功能。
3.3 细胞分裂素可能对木薯雌花分化具有促进作用
本研究共获得19个植物激素信号转导途径的差异基因, 发现细胞分裂素信号通路中、、、在雌花中显著上调, 生长素的早期响应基因、、、在雌花中显著下调。前期工作中, 本团队发现在木薯雌雄花分化关键时期, 雌花的细胞分裂素含量显著高于雄花, 雌花的生长素含量显著低于雄花[19], 与本研究的结果相一致。Deborah等[7]发现增施细胞分裂素可以有效提高硫代硫酸银(STS)在促进木薯雌花分化上的作用; Fröschle等[14]和Luo等[15]认为在花发育早期用细胞分裂素处理木薯, 能有效地促进雌花的发育。这些研究结果表明细胞分裂素可促进木薯雌花分化。
4 结论
木薯花性别分化主要涉及花器官的形态建成、发育的生物途径和植物苯丙素生物合成、植物激素信号传导2个代谢通路、、、4个基因正调控木薯雌花分化, 细胞分裂素信号传导基因、、、也参与到促进木薯雌花分化的过程,、、、、、、、、、、、、在木薯雌花中显著下调, 对木薯雌花分化可能起负调控作用。
[1] Zhang J, Boualem A, Bendahmane A, Ming R. Genomics of sex determination., 2014, 18: 110–116.
[2] Adnane B, Christelle T, Céline C, Afef L, Halima M, Marie A S, RinaF Z , IrinaK, CatherineD, RafaelP T, AbdelhafidB. A cucurbit androecy gene reveals how unisexual flowers develop and dioecy emerges., 2015, 350: 688–691.
[3] Boualem A, Troadec C, Camps C, Lemhemdi A, Morin H, Sari M, Fraenkel Z R, Kovalski I, Dogimont C, Perl T R, Bendahmane A. A Ho H, Low J Z, Gudimella R, Tammi M T, Harikrishna J A. Expression patterns of inflorescence and sex-specific transcripts in male and female inflorescences of African oil palm ()., 2016, 168: 274–289.
[4] Akagi T, Henry I M, Tao R, Comai L. A Y-chromosome-encoded small RNA acts as a sex determinant in persimmons., 2014, 346: 646–650.
[5] Theissen G. Development of floral organ identity: stories from the MADS house., 2001, 4: 75–85.
[6] 王宗宜. 木薯塊根生长和开花结实习性的初步观察. 广西农业科学, 1964, (6): 18–20. Wang Z Y. Preliminary observation on growth, flowering and fruiting habit of cassava root., 1964, (6): 18–20 (in Chinese with English abstract).
[7] Deborah O, Olayemisi E, Peter T H, Peter K, Tim L S. Flower development in cassava is feminized by cytokinin, while proliferation is stimulated by anti-ethylene and pruning: transcriptome responses., 2021, 28: 543–548.
[8] Ceballos H, Iglesias C A, Perez J C, Dixon A G. Cassava breeding: opportunities and challenges., 2004, 56: 503–516.
[9] Ceballos H, Perez J C, Joaqui-barandica O, Lenis J I, Morante N, Calle F, Pino L, Hershey C H. Cassava breeding I: the value of breeding value., 2016, 29: 1227–1229.
[10] Hyde P T, Guan X, Abreu V, Settert L. The anti-ethylene growth regulator silver thiosulfate (STS) increases flower production and longevity in cassava (Crantz)., 2020, 90, 441–453.
[11] 韦本辉, 甘秀芹, 陆柳英, 何虎翼, 唐秀桦, 胡泊, 吴延勇, 宁秀呈, 韦广泼. 广西木薯诱导开花结实及发芽试验研究初报. 广西农业科学, 2009, 40: 982–986. Wei B H, Gan X Q, Lu L Y, He H Y, Tang X H, Hu P, Wu Y Y, Ning X C, Wei G P. Experiment on induction of seed germination, flowering and seed setting in cassava., 2009, 90: 441–453 (in Chinese with English abstract).
[12] 韦丽君, 俞奔驰, 卢赛清, 雷开文, 郑华, 文峰, 付海天, 罗燕春. 一种促进木薯雄花转性的调节剂及其制备方法. 中国专利: CN106614593A, 2017. Wei L J, Yu B C, Lu S Q, Lei K W, Zheng H, Wen F, Fu H T, Luo Y C. The Regulator and preparation method of promoting cassava male flower rotation. Chinese patent: CN106614593A, 2017 (in Chinese).
[13] 陆柳英, 曹升, 严华兵, 谢向誉, 曾文丹, 尚小红, 肖亮. 一种诱导木薯开花的方法. 中国专利: CN108464144A, 2018. Lu L Y, Cao S, Yan H B, Xie X Y, Zeng W D, Shang X H, Xiao L. The method to induce cassava flowering. Chinese patent: CN106614593A, 2018 (in Chinese).
[14] Froschle M, Horn H, Spring O. Effects of the cytokinins 6-benzyladenine and forchlorfenuron on fruit-, seed-and yield parameters according to developmental stages of flowers of the biofuel plantL. (Euphorbiaceae)., 2017, 81: 293–303.
[15] Luo Y, Pan B Z, Li L, Yang C X, Xu Z F. Developmental basis for flower sex determination and effects of cytokinin on sex determination in(Euphorbiaceae)., 2020, 33: 21–34.
[16] 丛汉卿, 龙娅丽, 王荣香, 孙化鹏, 乔飞. 木薯中开花相关miRNA对phasiRNA的调控. 分子植物育种, 2019, 17: 1438–1445. Cong H Q, Long Y L, Wang R X, Sun H P, Qiao F. Regulation of phasiRNA by flowering related miRNA inCrantz., 2019, 17: 1438–1445 (in Chinese with English abstract).
[17] 韦丽君, 俞奔驰, 宋恩亮, 郑华, 卢赛清, 付海天. 基于转录组测序的木薯性别决定相关基因挖掘. 南方农业学报, 2020, 51: 1785–1796. Wei L J, Yu B C, Song E L, Zheng H, Lu S Q, Fu H T. Gene mining for sex determination in cassava (Crantz) based on transcriptome sequencing., 2020, 51: 1785–1796 (in Chinese with English abstract).
[18] 李恒锐, 张秀芬, 陈会鲜, 杨海霞, 梁振华, 兰秀, 黄珍玲, 莫周美, 何文, 郭素云. 木薯雌雄花分化形态结构观察及生理调控研究. 植物遗传资源学报, 2022, 23: 255–262. Li H R, Zhang X F, Chen H X, Yang H X, Liang Z H, Lan X, Huang Z L, Mo Z M, He W, Guo S Y. Study on morphological structure and physiological regulation of female and male flowers differentiation in cassava., 2022, 23: 255–262 (in Chinese with English abstract).
[19] Tanurdzic M, Banks J A. Sex-determining mechanisms in land plants., 2004, 16: S61–S71.
[20] 杜改改. 柿花性别分化调控的关键基因筛选及表达模式分析. 中国林业科学研究院硕士学位论文, 北京, 2017. Du G G. Selection and Expression Pattern Analysis of Relative Genes Regulating Flower Sex Differentiation in Persimmon (Thunb). MS Thesis of Chinese Academy of Forestry, Beijing, China, 2017 (in Chinese with English abstract).
[21] 平阿敏. 普通白菜花器官发育相关基因筛选及BrcSOC1和BrcSPL8克隆与表达分析. 山西农业大学硕士学位论文, 山西太原, 2017. Ping A M. Identification of Genes Related to Floral Organ Development by Expression Profile and Cloning and Expression Analysis of BrcSOCl and BrcSPL8 in Pak Choi. MS Thesis of Shanxi Agricultural University, Taiyuan, Shanxi, China, 2017 (in Chinese with English abstract).
[22] Sablowski R W, Moyano E, Culianez-maci F A, Schuch W, Martin C, Bevan M. A flower-specific Myb protein activates transcription of phenylpropanoid biosynthetic genes., 1994, 13: 128–137.
[23] Airoldi C A. Determination of sexual organ development., 2010, 23: 53–62.
[24] Ma H. The unfolding drama of flower development: recent results from genetic and molecular analyses., 1994, 8: 745–756.
[25] Yanofsky M F, Ma H, Bowman J L, Drewa G N, Feldmann K A, Meyerowitz E M. The protein encoded by thehomeotic gene agamous resembles transcription factors., 1990, 346: 35–39.
[26] Busi M V, Bustamante C D, Angelo C, Hidalgo C M, Boggio S B, Valle E M, Zabalete E. MADS-box genes expressed during tomato seed and fruit development., 2003, 52: 801–815.
[27] Atikur R M, Subramani P B, Sheikh M B. Molecular characterization and phylogenetic analysis of MADS-Box gene VroAGL11 associated with stenospermocarpic seedlessness in muscadine grapes.(Basel), 2021, 12: 232.
[28] Nallatt O, Nilo M. Suppression of the D-class MADS-box AGL11 gene triggers seedlessness in fleshy fruits., 2016, 35: 239–254.
[29] Dreni L, Osnato M, Kater M M. The ins and outs of the rice AGAMOUS subfamily., 2013, 6: 650–664.
[30] 陈利娜, 张杰, 牛娟, 李好先, 薛辉, 刘贝贝, 夏小丛, 张富红,赵弟广, 曹尚银. 石榴花发育相关基因的克隆及功能验证. 园艺学报, 2017, 44: 2089–2098. Chen L N, Zhang J, Niu J, Li H X, Xue H, Liu B B, Xia X C, Zhang F H, Zhao D G, Cao S Y. Cloning and functional verification of geneassociated with the development of flower organs in pomegranate plant., 2017, 44: 2089–2098 (in Chinese with English abstract).
[31] Yang Z E, Gong Q, Wang L L, Jin Y Y, Xi J P, Li Z, Qin W Q, Yang Z R, Lu L L, Chen Q J, Li F G. Genome-wide study of YABBY genes in upland cotton and their expression patterns under different stresses., 2018, 9: 33.
[32] Zhang S L, Wang L, Sun X M, Li Y D, Yao J, Nocker V S, Wang X P. Genome-wide analysis of the YABBY gene family in grapevine and functional characterization of VvYABBY4., 2019, 10: 1207.
[33] Bowman J L, Smyth D R. CRABS CLAW, A gene that regulates carpel and nectary development in, encodes a novel protein with zinc finger and helix-loop-helix domains., 1999, 126: 2387–2396.
[34] Thoma G, Suvi B, Annette B. CRABS CLAW acts as a bifunctional transcription factor in flower development., 2018, 20: 835.
[35] 刁志娟. 水稻三个花器官发育关键基因和一个SUPERMAN- Like基因的功能和表达分析. 福建农林大学博士学位论文, 福建福州, 2011. Diao Z J. Functional and Expressional Analysis of Three Pivotal Genes for Floral Organ Development and a SUPERMAN-like Gene in Rice (L.). PhD Dissertation of Fujian Agriculture and Forestry University, Fuzhou, Fujian, China, 2011 (in Chinese with English abstract).
[36] 胡若琳, 袁超, 牛义, 汤青林, 魏大勇, 王志敏. 植物MYB转录因子在花药发育中的调控作用. 生物工程学报, 2020, 36: 2277–2286. Hu R L, Yuan C, Niu Y, Tang Q L, Wei D Y, Wang Z M. Regulation of plant MYB transcription factors in anther development., 2020, 36: 2277–2286 (in Chinese with English abstract).
[37] 田义, 张彩霞, 康国栋, 李武兴, 张利益, 丛佩华. 植物 TGA 转录因子研究进展. 中国农业科学, 2016, 49: 632–642. Tian Y, Zhang C X, Kang G D, Li W X, Zhang L Y, Cong P H. Progress on TGA transcription factors in plant., 2016, 49: 632–642 (in Chinese with English abstract).
[38] Murmu J, Bush M J, Delong C, Li S, Xu M, Khan M, Malcomson C, Fobert P R, Zachgo S, Hepworth S R.basic leucinezipper transcription factors TGA9 and TGA10 interact with floral glutaredoxins ROXY1 and ROXY2 and are redundantly required for anther development., 2010, 154: 1492–1504.
[39] Zhu J, Lou Y, Xu X F, Yang Z N. A genetic pathway for tapetum development and function in., 2011, 53: 892–900.
[40] Li D D, Xue J S, Zhu J, Yang Z N. Gene regulatory network for tapetum development in., 2017, 8: 1559.
[41] Zhu E G, You C J, Wang S S, Cui J, Niu B X, Wang Y X, Qi J, Ma H, Chang F. The DYT1 interacting proteins bHLH010, bHLH089 and bHLH091 are redundantly required foranther development and transcriptome., 2015, 83: 976–990.
[42] 张计育, 莫正海, 李永荣, 王刚, 宣继萍, 贾晓东, 郭忠仁. 薄壳山核桃MADS-box基因CiMADS9的克隆与功能分析. 园艺学报, 2015, 42: 1049–1056. Zhang J Y, Mo Z H, Li Y R, Wang G, Xuan J P, Jia X D, Guo Z Y. Cloning and functional analysis of MADS-box CiMADS9 gene from., 2015, 42: 1049–1056 (in Chinese with English abstract).
[43] Xiong S X, Lu J Y, Lou Y, Xiao D T, Jing N G, Cheng Z,Qiang S S, Zhong N Y,Yang J Z. The transcription factor MS188 and AMS form a complex to activate the expression of CYP703A2 for sporopollenin biosynthesis in., 2016, 88: 936–946.
[44] Ma H H, Wu Y L, Lv R L, Chi H B, Zhao Y L, Li Y L, Liu H B, Ma Y Z, Zhu L F, Guo X P, Kong J, Wu J Y, Xing C Z, Zhang X L, Min L. Cytochrome P450 mono-oxygenase CYP703A2 plays a central role in sporopollenin formation and ms5ms6 fertility in cotton., 2022, 64: 2009–2025.
[45] 陈磊, 翟笑雨, 徐启江. B类MADS-Box基因的系统发育与功能演化. 植物生理学报, 2015, 51: 1359–1372. Chen L, Zhai X Y, Xu Q J. The phylogeny and functional evolution of B-Class MADS-box genes., 2015, 51: 1359–1372 (in Chinese with English abstract).
[46] Zhang S Y, Wang J, Chen G H, Ye X Y, Zhang L, Zhu S D, Yuan L Y, Hou J F, Wang C G. Functional analysis of a MYB transcription factor BrTDF1 in the tapetum development of Wucai (ssp.)., 2019, 257: 108728.
Transcriptomic profile of key stages of sex differentiation in cassava flowers and discovery of candidate genes related to female flower differentiation
CHEN Hui-Xian, LIANG Zhen-Hua, HUANG Zhen-Ling, WEI Wan-Ling, ZHANG Xiu-Fen, YANG Hai-Xia, LI Heng-Rui*, HE Wen*, LI Tian-Yuan, LAN Xiu, RUAN Li-Xia, CAI Zhao-Qin, and NONG Jun-Xin
Guangxi Institute of Sub-tropical Agricultural Sciences, Longzhou 532415, Guangxi, China
To solve the breeding problem of the serious shortage of female cassava flowers, cassava variety ‘Xinxianxuan 048’ was used as the experimental material. Transcriptional sequencing technology was used to analyze the biological information of differentially expressed genes in female and male flowers during the critical period of cassava flower sex differentiation, explore the functions of differentially expressed genes and possible regulatory pathways involved, excavate candidate genes related to female differentiation, and verify the sequencing results by qRT-PCR method. The results showed that: There were 545 differentially expressed genes between male and female cassava flowers at the critical stage of gender differentiation. Among them, 48.63% of the differential genes were enriched in GO pathway of floral organ morphogenesis and development, and the genes enriched in plant phenylpropanol biosynthesis and plant hormone signal transduction were the most.,,,and other flower sex differentiation genes were significantly up-regulated in female flowers. Four genes of the cytokinin signaling pathway, including,,, and, were significantly up-regulated in female flowers, while,,, and, the early auxin response genes, were significantly down-regulated in female flowers. Therefore, the sexual differentiation of cassava flowers mainly involved the biological pathways of pollen, gametophyte, floral organ morphogenesis and development, and two metabolic pathways of plant phenylpropanoid biosynthesis and plant hormone signal transduction. Cytokinin and auxin might be the main hormones in cassava female flower differentiation.,,,,,,, andmay be positive regulators of cassava female flower differentiation.
cassava; key stages of sex differentiation; transcriptome; female flowers; gene
2023-05-24;
2023-06-06.
10.3724/SP.J.1006.2023.34002
通信作者(Corresponding author): 李恒锐, E-mail: lihengrui88@163.com; 何文, E-mail: 675559090@qq.com
E-mail: 798555436@qq.com
2023-01-05;
本研究由国家重点研发计划项目(2020YFD1000603-10), 广西青年科学基金项目(2023GXNSFBA026150), 广西农业科学院科技发展基金项目(桂农科2022JM96), 崇左市科技计划项目(崇科攻2021ZC18)和广西农业科学院基本科研业务专项(桂农科2023YM44)资助。
This study was supported by the National Key Research and Development Program of China (2020YFD1000603-10), the Guangxi Youth Science Foundation Project (2023GXNSFBA026150), the Guangxi Academy of Agricultural Sciences Development Fund Project (Guinongke 2022JM96), the Science and Technology Plan Project of Special Project for Basic Scientific Research of Chongzuo (Chongkegong 2021ZC18), and the Guangxi Academy of Agricultural Sciences (Guinongke 2023YM44).
URL: https://kns.cnki.net/kcms2/detail/11.1809.S.20230615.1818.008.html
This is an open access article under the CC BY-NC-ND license (http://creativecommons.org/licenses/by-nc-nd/4.0/).

