甘蓝型油菜种质资源田间耐渍性评价和耐渍种质资源筛选
李继军 陈雅慧,2 王艺瑾 周志华 郭子越 张 建 涂金星 姚 璇,* 郭 亮,*
甘蓝型油菜种质资源田间耐渍性评价和耐渍种质资源筛选
李继军1陈雅慧1,2王艺瑾1周志华1郭子越3张 建3涂金星1姚 璇1,*郭 亮1,*
1华中农业大学植物科学技术学院 / 作物遗传改良全国重点实验室, 湖北武汉 430070;2承德市农林科学院, 河北承德 067000;3华中农业大学资源与环境学院 / 宏观农业研究院, 湖北武汉 430070
甘蓝型油菜是我国最重要的油料作物之一, 其生产过程中具有较高的渍害发生风险。为了评价甘蓝型油菜田间耐渍性以及筛选稳定的耐渍种质资源, 本研究首先在盆栽条件下确定了苗期耐渍性鉴定的适宜渍水时间, 随后在大田试验中对505份种质资源进行了田间耐渍性的综合评价和比较, 并筛选了稳定的极端材料。盆栽试验结果表明, 甘蓝型油菜的生长在渍水超过4 d时开始受到影响, 在渍水约10 d时生长受到严重抑制。2年的田间试验中, 利用无人机表型采集平台提取到27个指标, 通过因子分析将其转化成了2个公因子, 公因子1代表了甘蓝型油菜渍水条件下的生长状态, 公因子2代表了生理状态。根据2个公因子的载荷与方差贡献率计算出的耐渍性综合评价值(值)将甘蓝型油菜种质资源的耐渍性划分为4个类型。其中, 极端耐渍型(I型)包含99份种质资源、耐渍型(II型) 200份种质资源、敏感型(III型) 187份种质资源、极端敏感型(IV型) 19份种质资源。通过2022年的大田试验对上述结果进行进一步验证和筛选, 共鉴定到9份稳定的渍水敏感材料和9份稳定的耐渍材料。而且, 2年的试验结果显示植被指数MTVI2D、MCARI2D与耐渍性综合评价值(值)相关性都高于0.76, 可用于对油菜耐渍性快速、高效的综合评价。总之, 本研究建立了甘蓝型油菜田间耐渍性评价体系以及耐渍性快速和综合评价方法, 解析了甘蓝型油菜种质资源的耐渍性类型, 鉴定到了稳定的耐渍和敏感材料, 为甘蓝型油菜耐渍性的研究和遗传改良提供了可靠的评价方法和重要的种质资源。
甘蓝型油菜; 种质资源; 苗期; 耐渍性; 综合评价
油菜是我国第一大油料作物, 主要利用冬闲田生产, 不与夏粮作物争地。近年来国家大力支持南方地区冬闲田开发, 努力扩大冬油菜种植面积, 以增强油料供给保障能力。在我国食用油自给率不足30%的背景下[1], 充分利用长江流域冬闲田是促进我国油料作物产业发展的有效途径。长江流域广泛使用“水稻-油菜”轮作的种植模式, 水稻收获后土壤质地黏重、透气性差、地下水位高, 加之该区域降水频繁, 导致后茬油菜在生产中有较高的渍害发生的风险[2]。近年来, 长江流域冬油菜全生育期总降水量呈现逐年增加的趋势, 而月平均降水量每增加10 mm会导致油菜减产1.64%~13.61%[3-4]。
水是植物生长所必需的, 但是环境中水分过多或者过少都会限制植物的正常生长发育。土壤中过量的水分限制气体交换, 这种的状态被定义为渍水[5-6]。渍水时, 土壤透水不畅和地面排水不畅使根系长期缺氧, 会导致植物生长发育受损甚至致死, 称之为渍害(waterlogging stress)。土壤渍水时, 土壤孔隙中的空气(尤其是O2)会被水取代, 同时气体在水中的扩散速度是空气中的10-4倍, 因此由于根系的有氧呼吸和渍水土壤中气体扩散减少, 加之土壤微生物会与作物竞争土壤中残留的O2, 会导致土壤中O2会迅速减少[7-8]。渍水条件下, 根际土壤pH值显著降低, 并大量生成Fe2+、Mn2+、H2S、乙醛等有毒物质[9-11]。根系能量供应、膜完整性和根部水和离子转运均受到影响, 并间接导致了地上部分功能的改变。而气孔关闭会导致叶片对CO2的吸收受到抑制, 并限制O2从植物体内向环境中释放, 而这将严重降低光合组织的碳同化效率[10,12-13]。光合组织中O2含量的增高和CO2含量的不足, 会导致光呼吸作用增强, 从而进一步抑制植物的净光合速率[13-14]。随着渍害发生时间的持续, 作物生长发育会受到极大的影响, 例如株高降低、根系生长抑制、叶片出叶速度减小等, 最终会导致成熟期的产量损失[6,15-16]。
在作物的耐渍性评价和遗传基础解析中, 多用产量和形态指标进行耐渍性评价的指标, 例如萌发期萌发率、根茎长, 苗期叶片损伤情况、地上地下部生物量、存活率、形态学适应性状, 成熟期产量和重要农艺性状等[11]。近年来, 也有研究者使用丙二醛含量、相对电导率、可溶性糖含量、可溶性蛋白含量、超氧化物歧化酶活性和过氧化物酶活性等生理指标[17-18], 归一化植被指数(NDVI)、绿色归一化植被指数(GNDVI)等反映农作物长势和营养信息的植被指数进行耐渍性评价[19-20]。胡文河等[21]对不同高粱品种的萌发种子进行渍水处理, 调查发芽势、发芽率、胚根长、胚芽长等指标, 利用主成分分析获得的综合指标对50个高粱品种的耐涝性进行划分和耐涝种质资源的筛选。陈雅慧[17]对505份甘蓝型油菜自交系群体进行萌发期淹水处理, 通过9个生长指标和电导率进行耐渍性评价, 并利用生长指标归一化后计算的综合指标MFVW和电导率共同筛选极端材料。李真等[2]使用地上部干重、根干重和总干重进行DH群体中耐湿性极端株系的筛选。唐章林等[22]考察了盆栽渍水条件下的绿叶数、地上部鲜重、地上部干重、可溶性糖、可溶性蛋白、丙二醛质、过氧化物酶活性和超氧化物歧化酶活性, 对200份甘蓝型油菜种质资源进行了耐湿性综合评价。佟汉文等[23]采用灌水处理模拟田间渍害的方式, 综合评价了37份湖北稻茬小麦品种(系)的耐渍性。
利用南方冬闲田进行油菜生产是提高油菜总产量、缓解植物油供需矛盾的重要方式, 其中关键的问题是解决稻田油菜的耐渍性问题。因此, 开展甘蓝型油菜种质资源田间耐渍性鉴定评价及耐渍种质资源筛选, 对我国油菜高产稳产和种植面积扩大有重要意义。鉴于此, 本研究以前期收集的具有广泛遗传基础的505份甘蓝型油菜种质资源为基础, 在田间条件下进行多年的苗期渍水处理。利用无人机表型采集平台结合人工鉴定的方式对甘蓝型油菜的耐渍性进行评价鉴定, 以分析甘蓝型油菜种质资源群体水平的耐渍性表现, 筛选耐渍种质资源, 为油菜渍害响应的遗传基础解析和遗传改良提供理论依据和种质资源。
1 材料与方法
1.1 试验材料与渍水处理
1.1.1 盆栽试验材料和设计 从本实验室收集的具有广泛遗传基础的505份甘蓝型油菜自交系组成的自然群体中随机选取10份种质资源进行苗期渍水处理(表1)。每份种质资源种植20盆, 每盆播种10粒种子, 在二叶一心期定苗为每盆3株。每盆装填基质4.6 kg, 盆栽基质为育苗基质(星宇星, 中国武汉)∶水稻土=7∶50。在播种30 d时, 对油菜幼苗进行渍水处理, 渍水水位保持在土面以上约1~2 cm。

表1 盆栽试验中使用的10份甘蓝型油菜自交系详单
1.1.2 田间试验材料和设计 本研究中使用具有广泛遗传基础的505份甘蓝型油菜自交系组成的自然群体进行油菜田间渍水试验[24]。田间试验点位于华中农业大学鄂州试验基地(30°21′34′′N, 114°42′25′′E)。试验田前作为中稻, 土壤质地为粉沙质黏壤土。在油菜种植前, 通过先正达金都尔(精异丙甲草胺)对土壤喷雾进行田间杂草防治。甘蓝型油菜渍水处理的3年田间试验中, 播种时间分别为2017年9月26日、2018年9月27日、2022年9月30日, 田间行距20 cm, 每份种质资源种植3行, 在三叶期进行人工除草并对每行定值10株。在油菜生长至60 d左右时进行渍水处理, 渍水水位与土面保持一致。渍水时间持续10 d, 渍水结束后及时排干积水, 田间水位恢复到渍水前的状态。
1.2 性状测定
1.2.1 盆栽试验中相关性状的采集 渍水前以及渍水后每2 d测定一次甘蓝型油菜的生长和生理指标, 每份种质资源进行3次重复测定。生长指标包括绿叶数、株高、茎鲜重; 生理指标包括最大叶的可溶性糖、脯氨酸、相对电导率、叶绿素、类胡萝卜素。生理指标的具体测定均参考《植物生理生化实验原理和技术(第2版)》[25]。
1.2.2 田间试验中的图像采集与性状提取 利用高通量无人机表型采集平台进行油菜渍水后恢复阶段的实时信息采集。表型采集平台使用的是大疆六轴飞行器Matrice 600, 具有最大6 kg的载重, 无风环境下最大水平飞行速度为18 m s–1, 可连续作业16 min。无人机平台搭载了5台Sony ILCE-QX1相机组成的多相机倾斜摄影系统以及一个五波段相机Micasense RedEdge 3。所有无人机飞行任务均于12:00—14:00时段内、晴朗的天气条件下进行。无人机平台获取的单个图像, 使用Agisoft PhotoScan Professional 1.4.3 (Agisoft LLC, 俄罗斯)以及ArcGIS (ESRI, 美国)中的Python模块进行特征提取, 按照以下3个步骤进行拼接: (1)在图像拼接中, 在每张照片中手动识别14个地面控制点(GCPs), 并将其对应到实时动态(RTK)全球定位系统(Emlid Reach RS, Emlid Ltd,俄罗斯)接收机测量的相应坐标中; (2) 构建高密度点云; (3) 生成数字表面模型和正射影像。为了减少光照变化对多周期图像的影响, 分别使用反射率为6%、24%、45%、62%和99%的5个标定反射率板, 得到5个标定目标的数字回归方程, 从而对光谱图像中的每个波段进行辐射定标。在预处理的图片中对每份种质资源进行小区划分, 以小区为单位提取到株高(plant height, PH)、冠层体积模型(canopy volume model, CVM)等4个生长指标和归一化植被指数(normalized difference vegetation index, NDVI)、绿色归一化植被指数(green normalized difference vegetation index, GNDVI)等23个植被指数, 具体性状提取方法和数据类型等细节参考Li等[26]的方法。
1.3 数据分析
利用Microsoft Excel进行数据的基础整理, 利用SPSS 21.0、R 4.2.2、Origin 2018和TBtools软件对数据进行相关性分析、隶属函数分析、因子分析、层次聚类分析、多元线性回归模型构建与相关图表的绘制[27-30]。
性状之间的相关性分析使用的数据为各指标的原始实测值。因子分析以及通过因子分析计算出来的综合评价值都基于通过隶属函数分析获得的归一化值进行计算, 具体公式如下:
对505份甘蓝型油菜种质资源在田间采集的27个指标, 按照公式(1)计算隶属函数值。(X)表示第个指标的隶属函数值, 式中X表示第个指标的原始实测值,max、min表示在群体中第个指标原始实测值的最大值和最小值。

各指标的隶属函数值基于主成分的因子分析提取公因子, 按照公式(2)计算各公因子的权重, 式中W表示第个公因子的权重,P表示被提取到的第个公因子的方差贡献率。
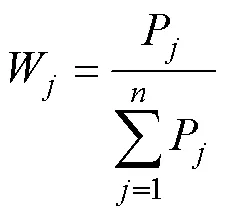
运用公式(3)计算甘蓝型油菜自然群体中各材料的综合评价值, 利用综合评价值进行甘蓝型油菜种质资源耐渍性综合评价, 综合评价值越大说明该材料的耐渍性性越强。
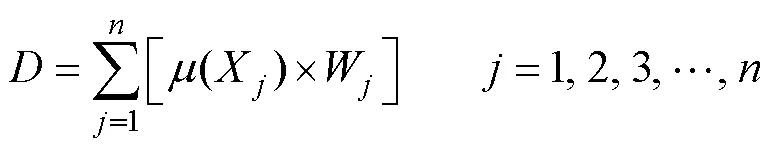
2 结果与分析
2.1 适宜油菜苗期耐渍性鉴定的渍水时间的确定
为确定适宜油菜苗期耐渍性鉴定的渍水时间, 从505份甘蓝型油菜种质资源中随机挑选了10份进行不同渍水时间的试验处理。在盆栽渍水试验中, 我们可以直观地观察到, 随着渍水时间的持续油菜生长明显受到抑制, 而且渍水加快了老叶的衰老黄化速度。为了量化油菜在渍水条件下生长抑制程度, 本研究考察了油菜在渍水期间地上部分的绿叶数、株高和鲜重这3个形态指标随渍水时间的变化动态(图1-A~C)。结果表明, 渍水的前4 d内, 油菜的绿叶数、株高和鲜重依然保持上升状态, 且在第4天显著高于处理前的水平; 随着渍水时间的继续延长, 这3个形态指标逐渐下降。渍水4 d后, 绿叶数下降的速度最快, 第6天时的绿叶数就比第4天时的显著降低; 株高则是在第8天时下降到显著低于第4天时的水平;鲜重则是这些指标中下降最慢的, 直到渍水第12天时才下降到显著低于第4天时的水平。表明, 苗期渍水初期油菜会继续保持生长, 但是随着渍水时间的持续, 油菜生长受渍水抑制的程度逐渐加大。
逆境响应相关的生理指标能侧面反映油菜在渍水胁迫下的生长状态和逆境响应程度。研究结果表明, 油菜最大叶片的可溶性糖含量、脯氨酸含量、相对电导率和类胡萝卜素含量均随着渍水时间的持续逐渐升高, 在渍水后期都达到显著高于处理前的水平; 叶绿素则随着渍水时间的持续而逐渐下降; 叶绿素的含量在渍水条件下受影响的程度较低。可溶性糖含量和脯氨酸含量响应渍水的速度最快, 在渍水第2天开始就显著高于渍水处理前的水平; 叶绿素的含量在渍水第4天开始显著受到抑制; 相对电导率则在渍水第8天开始才显著高于处理前的水平(图2)。表明苗期持续渍水抑制了油菜生长的正常状态、损害了细胞的生理功能, 同时油菜也在生理水平上积极抵御外界的渍水胁迫。

图1 不同渍水时间下甘蓝型油菜生长和生理指标的变化
A: 绿叶数; B: 株高; C: 茎鲜重; D: 可溶性糖; E: 脯氨酸; F: 相对电导率; G: 叶绿素; H: 叶绿素; I: 类胡萝卜素的动态变化。图中数值为平均值±标准误(= 10), 同一图中的不同字母表示不同时间点之间存在显著性差异(< 0.05)。
A: the number of green leaves; B: plant height; C: shoot fresh weight; D: soluble sugar; E: proline; F: the relative electric conductivity; G: chlorophyll; H: chlorophyll; I: carotenoids. The value in the figure is mean ± SE (= 10), and different letters in the same figure indicate significant differences between different time at< 0.05.
在渍水持续8 d以上时, 考察的绝大多数的生长和生理指标与渍水前水平存在显著差异; 而渍水12 d时, 绝大多数指标在渍水前后的差异达到最大。因此, 后续田间渍水试验中, 渍水10 d可以做为油菜苗期耐渍性鉴定的适宜处理时间。
2.2 甘蓝型油菜渍水后的田间表现
在田间渍水处理10 d后, 甘蓝型油菜自然群体在苗期的生长受到明显的影响, 而且苗期渍水对油菜的影响会从营养生长阶段持续到生殖生长阶段(图2-A)。渍水对甘蓝型油菜营养生长阶段的生长的影响, 除了盆栽条件下已鉴定的3个指标外, 还有叶片衰老黄化、功能叶焦枯、叶片花青素大量积累、根系腐烂等几种典型的性状发生改变(图2-B~E); 进入生殖生长阶段后, 除了植株长势变差外, 还会出现倒伏和植株彻底死亡等情况(图2-F~G)。前期的研究表明, 渍水结束10 d之后的较长一段时间内, 植株长势会下降到极低的水平[26]。本研究选用渍水结束后18 d作为表型考察的时间点, 利用无人机表型采集平台提取到4个形态指标(作物体积模型: CVM、冠层绿色覆盖度: GCC、冠层紫色覆盖度: PCC、株高: PH)和23个植被指数进行甘蓝型油菜耐渍性的后续研究。这27个指标在渍水条件下的表型值分布范围广泛, 不同种质资源对各指标的响应程度不同(表2)。表明不同甘蓝型油菜种质资源在渍水后生长抑制和响应程度存在较大的差异。

图2 甘蓝型油菜渍水后的田间表现
A: 甘蓝型油菜渍水前后的整体生长变化情况。渍水后, 油菜出现B: 叶片衰老黄化、C: 功能叶焦枯、D: 叶片花青素积累、E: 根系腐烂、F: 植株倒伏、G: 死亡等典型的表型。
A: the overall growth changes ofL. before and after waterlogging. After waterlogging,L. plants showed typical phenotypes such as leaf senescence (B), yellowing functional leaf scorching (C), leaf anthocyanin accumulation (D), root rot (E), plant lodging (F), and death (G).
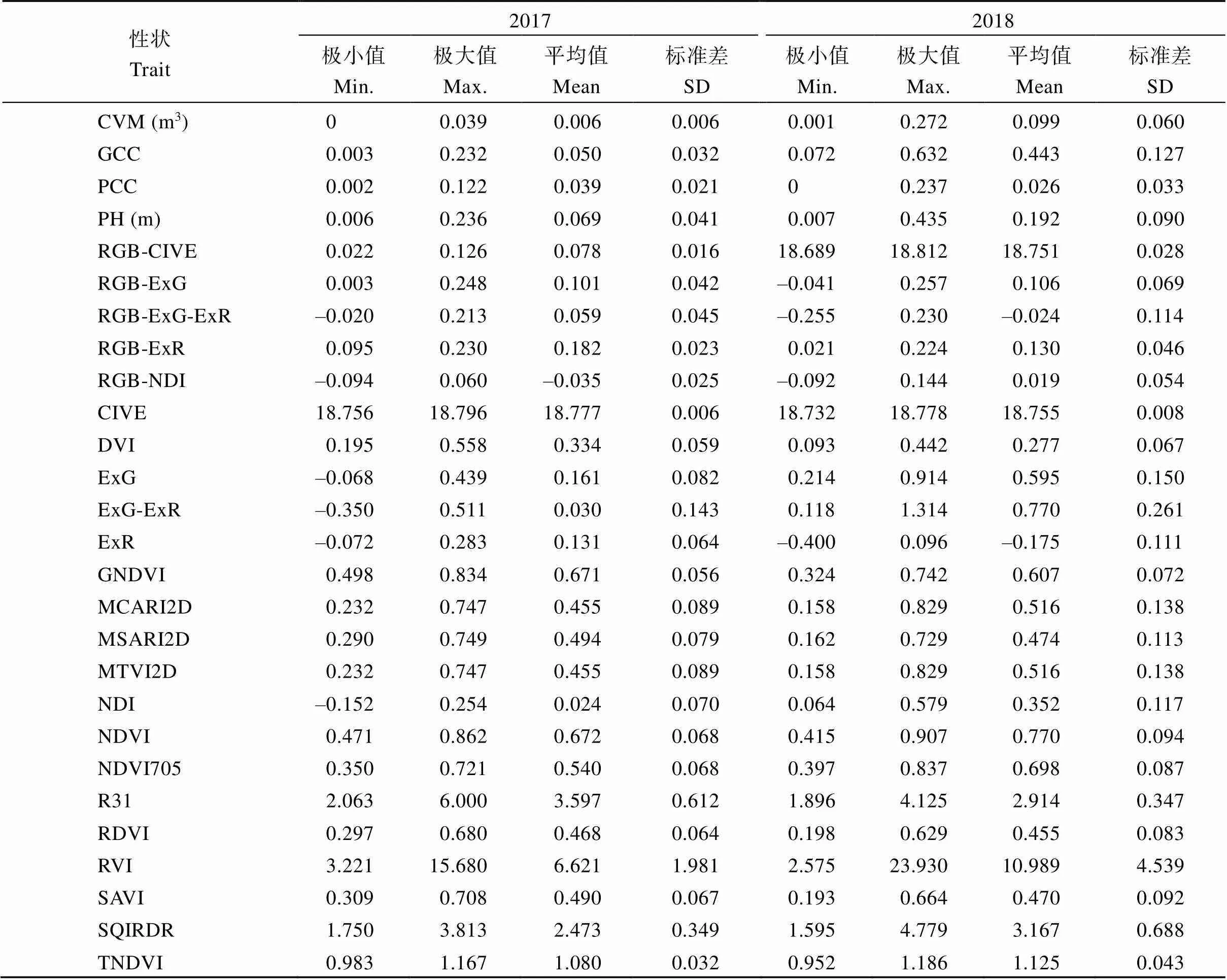
表2 505份甘蓝型油菜种质资源在渍水胁迫下各性状描述统计
性状的生物学意义、计算方法和公式参考Li等的研究[26]。CVM: 冠层体积模型; GCC: 冠层绿色覆盖度; PCC: 冠层紫色覆盖度; PH: 株高; RGB-CIVE: RGB-植被颜色指数; RGB-ExG: RGB-超绿指数; RGB-ExG-ExR: RGB-超绿超红差分指数; RGB-ExR: RGB-超红指数; RGB-NDI: RGB-归一化差异指数; CIVE: 植被颜色指数; DVI: 差值植被指数; ExG: 超绿指数; ExG-ExR: 超绿超红差分指数; ExR: 超红指数; GNDVI: 绿色归一化植被指数; MCARI2D: 改进叶绿素吸收反射指数; MSARI2D: 改进土壤吸收反射指数; MTVI2D: 改进三角植被指数; NDI: 归一化差异指数; NDVI: 归一化植被指数; NDVI705: 红边归一化差异植被指数; RDVI: 重归一化差植被指数; RVI: 比值植被指数; SAVI: 土壤调整植被指数; TNDVI: 转换归一化植被指数。
The biological significance, calculation methods, and formulas of traits refers to those given from Li et al.[26]CVM: canopy volume model; GCC: canopy cover of green leaves; PCC: canopy cover of purple leaves; PH: plant height; RGB-CIVE: color index of vegetation extraction (based on RGM image; RGB-ExG: excess green index (based on RGM image); RGB-ExG-ExR: excess green minus red index (based on RGM image); RGB-ExR: excess red index (based on RGM image); RGB-NDI: normalized difference index (based on RGM image); CIVE: color index of vegetation extraction; DVI: difference vegetation index; ExG: excess green index; ExG-ExR: excess green minus red index; ExR: excess red index; GNDVI: green normalize difference vegetation index; MCARI2D: modified chlorophyll absorption reflectance index 2; MSARI2D: modified soil adjustment reflectance index 2; MTVI2D: modified triangular vegetation index 2; NDI: normalized difference index; NDVI: normalized difference vegetation index; NDVI705: normalized difference vegetation index 705; RDVI: renormalized difference vegetation index; RVI: ratio vegetation index; SAVI: source address validation improvement; SQIRDR: square root of infrared divided by red; TNDVI: transformed normalized difference vegetation index.
2.3 甘蓝型油菜渍水后各指标的相关性分析与数据降维
相关性分析结果表明, 无人机表型采集平台提取到的不同性状之间存在不同程度的相关性(图3)。2年的试验中, PCC与RGB-CIVE、CIVE、RGB-ExR、ExR以及R31之间存在较强的正相关性, 而与其他性状之间存在较强的负相关性。形态指标中, CVM与PH的相关性最强, 2年的相关系数分别是0.9185和0.9795; 植被指数中, NDVI与TNDVI的相关性最强, 2年的相关系数均为0.9997。

图3 甘蓝型油菜各性状隶属函数值的相关性分析
缩写同表2。Abbreviations are the same as those given in Table 2.
性状之间联系密切, 表明性状之间存在严重的信息冗余, 不能简单地进行性状的线性组合来进行甘蓝型油菜耐渍性的综合评价。因此, 本研究中通过基于主成分提取的因子分析, 对2年的数据分别进行降维处理, 基于性状隶属函数值的初始特征值大于1的原则, 提取公因子(表3)。2017年的性状提取到3个公因子, 初始特征值分别为18.5、5.5和1.1, 方差贡献率分别为68.4%、20.3%和3.9%。2018年的性状提取到2个公因子, 初始特征值分别为23.0和2.1, 方差贡献率分别为85.3%和7.7%。2年的公因子累计解释的变异分别为92.6%和93.1%, 有效反映了27个指标中包含的绝大部分变异信息。
公因子载荷矩阵中, 性状在公因子中载荷的绝对值代表了其对公因子的影响程度(表4)。2年的公因子1中广泛应用于叶面积指数(LAI)预测的植被指数MCARI2D和MTVI2D均具有最高的载荷, 同时CVM、GCC、PH等体现植株长势的指标也具有较高的载荷, 说明公因子1与甘蓝型油菜渍水后的长势较为密切, 反映了植株的生长状态。2年的公因子2中反映植株花青素积累的PCC以及与之相关性较强的植被指数R31具有较高的载荷, 说明公因子2与甘蓝型油菜渍水后的生理响应较为密切, 反映了植株的生理状态。2017年的公因子3中CVM和GCC载荷最高, 但二者的载荷明显低于其在公因子1的载荷, 同时公因子3初始特征值仅1.1、解释的变异仅3.9%, 在因子分析中基于实际意义, 在后续分析中将公因子3剔除。

表3 甘蓝型油菜各指标的公因子方差贡献率
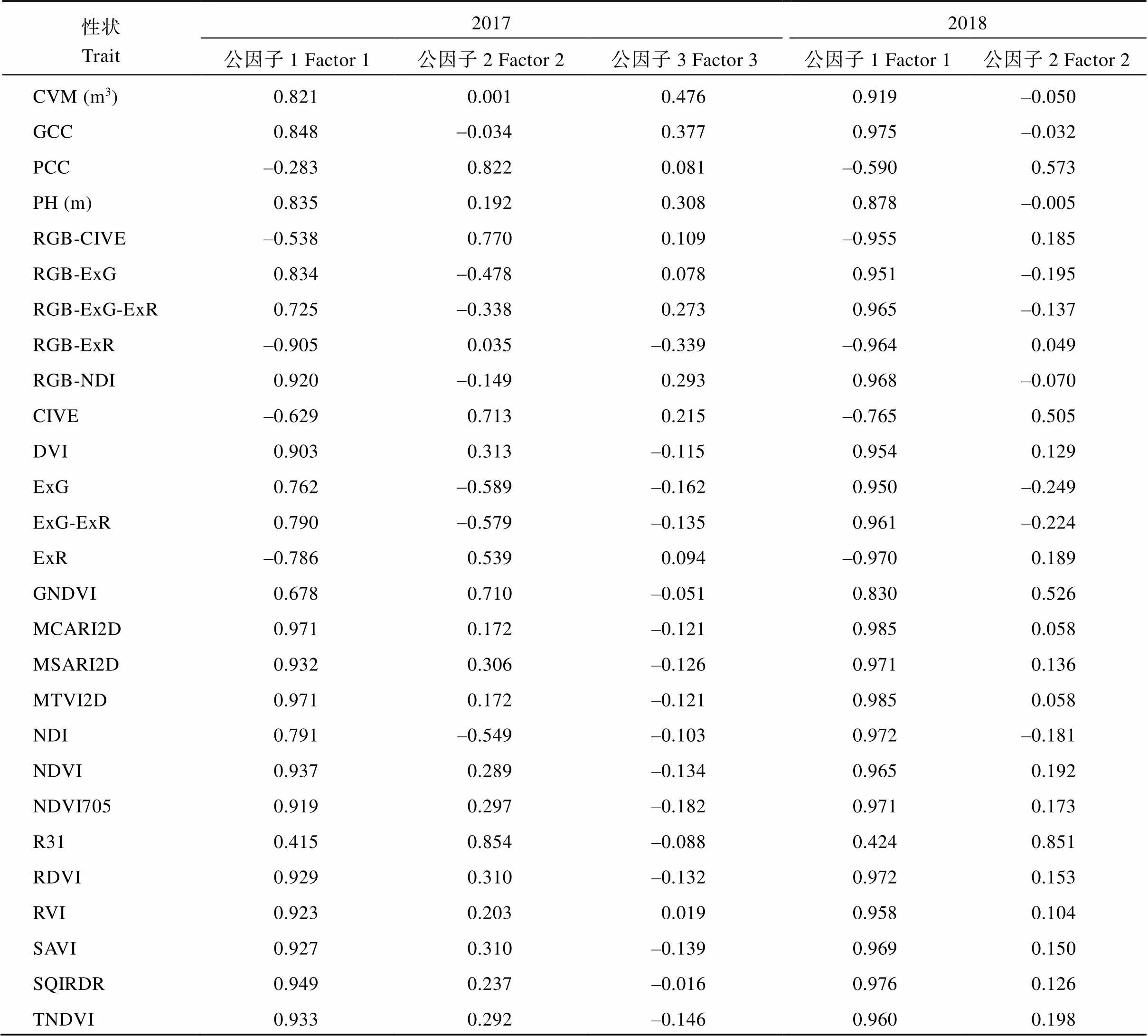
表4 公因子载荷矩阵
缩写同表2。Abbreviations are the same as those given in Table 2.
2.4 甘蓝型油菜种质资源耐渍性综合评价与极端材料鉴定
根据甘蓝型油菜种质资源的各公因子取值及其方差贡献率计算2年的综合评价值(值), 将2年的值计算平均值后用于甘蓝型油菜种质资源耐渍性的分析。分析结果表明,值在自然群体中的分布接近正态分布(图4-A)。不同亚群之间表现出了不同的耐渍性水平, 其中春性油菜的耐渍性水平显著低于冬性和半冬性亚群的甘蓝型油菜(图4-B)。通过系统聚类的方法, 对甘蓝型油菜自然群体进行聚类分析发现, 种质资源可分为四大类, 不同类别之间的耐渍性水平均存在显著差异(图4-C)。第I类是极端耐渍型, 包含99份种质, 占供试材料总数的19.6%; 第II类是较耐渍型, 包含200份种质, 占供试材料总数的39.6%; 第III类是较敏感型, 包含187份种质, 占供试材料总数的37.0%; 第IV类是极端敏感型, 包含19份种质, 占供试材料总数的3.8% (图4-D)。

图4 505份甘蓝型油菜种质资源耐渍性
A: 甘蓝型油菜自然群体渍水胁迫下综合评价值的频数分布图。B: 不同亚群种质资源的耐渍性。C: 不同类群种质资源的综合耐渍性。D: 甘蓝型油菜自然群体耐渍性的聚类分析。I: 极端耐渍型; II: 较耐渍型; III: 较敏感型; IV: 极端敏感型。E: 在2022年的田间试验中再次验证2年试验共同鉴定的极端耐渍种质资源的表型。F: 在2022年的田间试验中再次验证2年试验共同鉴定的极端敏感种质资源的表型。同一图中的不同字母表示数据集之间存在显著差异(< 0.05)。
A: frequency distribution diagram of-value ofL.natural population under waterlogging stress. B: the comprehensive waterlogging tolerance of different subgroups of germplasm resources. C: the comprehensive waterlogging tolerance of different clusters of germplasm resources. D: the cluster analysis of waterlogging tolerance ofL.natural population. I: extremely waterlogging resistant cluster; II: waterlogging resistant cluster; III: waterlogging sensitive cluster; IV: the extremely waterlogging sensitive cluster. E: phenotypic verification of germplasm resources with extreme tolerance to waterlogging co-identified by two-year field experiments in 2022. F: phenotypic verification of germplasm resources with extreme sensitivty to waterlogging co-identified by two-year field experiments in 2022. Different letters in the same figure indicate significant differences among the data sets at< 0.05.
基于值分别筛选出2年的渍害响应的极端材料后, 求取2年所鉴定极端材料的交集部分作为稳定可靠的极端材料。值大于“平均值+标准差”的种质资源被鉴定为极端耐渍材料,值小于“平均值–标准差”的种质资源被鉴定为极端耐渍材料。通过比较分析, 分别鉴定到9份稳定可靠的极端耐渍和敏感材料(表5)。稳定的极端耐渍种质资源均来自于聚类分析中的第I类(极端耐渍型), 极端敏感种质资源则来自第III类(较敏感型)和第IV类(极端敏感型)。稳定的极端耐渍种质资源均属于半冬性油菜, 而极端敏感种质资源则包含了冬性、半冬性和春性3种亚群来源的油菜。这些被稳定筛选到的极端材料在2022年的田间实验中再次进行了人工表型验证, 结果表明极端耐渍的9份材料整体具有绿叶数多、叶片黄化程度低、植株高大, 存活率高等特点; 极端敏感的9份材料则出现较严重的叶片黄化、功能叶焦枯程度高、植株矮小瘦弱、植株死亡率高等特点(图4- E~F)。表明, 2年重复鉴定到的这些极端材料在不同的年份之间具有稳定的耐渍性表现, 可以作为甘蓝型油菜耐渍性的分子基础研究和遗传改良的重要种质资源。
2.5 甘蓝型油菜耐渍性回归模型建立及快速评价指标筛选
为了便于甘蓝型油菜耐渍性的种质资源筛选和田间监测, 使用2年的试验数据分别构建了耐渍性多元线性回归模型, 并对模型进行了比较。构建模型时, 各公因子中载荷最高的性状作为自变量,耐渍性综合评价值()作为因变量, 进行线性回归分析。2017年的数据构建的多元线性回归模型为:=-4.235+0.23417.4632, 2018年的数据构建的多元线性回归模型为:= 1.218-1.64816.9432。2组方程中,均代表耐渍性综合评价值()、1均代表R31、2均代表MTVI2D或MCARI2D。运用该回归方程计算种质资源综合评价的预测值(′)与值之间的相关性系数分别为0.970和0.943, 表明2组回归方程对观测数据的真实反映程度均较高(图5-A, B)。

表5 极端耐渍和敏感材料的聚类情况和综合表现
在油菜耐渍性的田间鉴定评价时, 不同年份或地点会存在实验条件的些许不同, 导致线性回归模型不完全一致, 因此不便于广泛使用。对2年的多元线性回归模型的分析中发现, 自变量MTVI2D或MCARI2D对公式的影响最大。同时, 比较27个性状与值之间的相关性表明, 不同年份之间绝大多数性状与值之间均具有稳定的正相关或负相关性, 其中MTVI2D和MCARI2D这2个性状与值的相关性都大于0.76, 在不同年份中的表现最稳定(图5- C)。因此, 在进行油菜田间耐渍性评价时, 可以使用MTVI2D或MCARI2D作为鉴定指标, 能简单、高效地对种质资源的耐渍性进行评价或者作物受渍水影响程度的鉴定。

图5 甘蓝型油菜种质资源耐渍性的评价方法和关键指标
A: 2017年甘蓝型油菜种质资源综合评价值()与预测值()之间的相关性。B: 2018年甘蓝型油菜种质资源综合评价值()与预测值()之间的相关性。C: 27个指标与值之间的相关性。
A: the correlation between comprehensive evaluation value () and predicted value () inL.germplasm resources in 2017. B: the correlation between comprehensive evaluation value () and predicted value () inL.germplasm resources in 2018. C: the correlations between 27 indexes and-values.
3 讨论
为了便于试验结果的分析, 研究者在研究渍水对甘蓝型油菜生长生理响应、遗传基础解析和筛选耐渍性种质资源筛选中, 多采用单一的渍水时间点进行耐渍性的筛选条件。甘蓝型油菜苗期耐渍性研究中, 不同研究者选用了5~30 d中某个具体时间点作为渍水处理的时长[16,32-35], 或者根据渍水后的植株生长受损程度对渍水时长进行主观的判断[36]。Boem等[37]则比较了冬油菜在苗期进行3、7、14 d渍水之间的差异, 研究结果表明苗期渍水3 d就能显著降低甘蓝型油菜成熟期的生物量和种子产量,而且随着渍水时间的延长影响的程度也越高。本研究对甘蓝型油菜苗期渍水0~12 d后的生长和生理进行了连续观察, 结果表明渍水4 d内甘蓝型油菜会继续保持生长和生物量的积累、生理指标变化程度较小, 但是渍水时长超过4 d时甘蓝型油菜的生长会受到明显的抑制、生理指标变化程度较高, 而且随着渍水时间的持续, 生长抑制程度越来越高、生理响应也越来越高(图1)。以上结果与前人的研究均表明, 田间进行冬油菜苗期渍水相关研究时, 渍水处理时间少于4 d时对油菜生长的影响较小, 而渍水时间持续7 d以上时处理组与对照组油菜之间产生明显的生长和生理差异。
作物的非生物逆境属于多表型性状, 响应逆境的各种生长和生理性状均可作为作物的抗逆性评价指标, 然而使用单一性状难以全面、准确地对作物的整体抗逆性进行评价。因此, 近年来对逆境下多个指标进行测定、再进行数据降维处理以剔除性状之间的冗余变异信息、获得的综合指标再用于作物抗逆性的系统评价, 这一分析流程在作物抗逆等复杂性状的研究中得到了广泛应用[21-22,31,38]。本研究使用了无人机表型采集平台获得的4个形态指标和23个植被指数进行甘蓝型油菜耐渍性的评价(表2)。相关性分析的结果表明, 性状之间具有不同程度的相关性, 第1类为以CVM、GCC、PH为代表的、反映植株长势的形态指标与大多数植被指数之间具有很强的正相关性, 第2类为以PCC为代表的、反映植株生理状态的形态指标与剩余的植被指数之间具有很强的正相关性(图2)。随后进行的因子分析中发现, 提取到的公因子1中第1类指标的载荷均比较高, 而提取到的公因子2中第2类指标的载荷均比较高, 表明影响油菜耐渍性的因素主要包括了油菜在渍水条件下的生长能力和生理水平的适应性(表4)。相关性分析和因子分析, 互相印证了甘蓝型油菜耐渍性分析的合理性和可靠性。同时, 本研究基于公因子及其方差贡献率构建了油菜耐渍性评价的多元线性回归方程, 筛选出植被指数MTVI2D、MCARI2D和R31可以作为耐渍性评价的重要指标, 其中MTVI2D和MCARI2D与耐渍性综合评价值(值)之间在不同年份中均具有稳定的强相关性, 因此可以使用MTVI2D和MCARI2D对油菜耐渍性进行快速、高效地评价。
通过田间试验采集到的表型更接近作物在生产中的实际表现, 在极端材料鉴定和实际生产应用中具有更高的参考价值。然而传统的人工表型采集方式具有费时费力、成本高、精度和通量低等缺点, 限制了作物田间抗逆性的相关研究。近年来, 由于无人机表型采集平台中配套的图像采集、分析技术的提高, 使其在农业数据采集上具有了无损、高效、高通量等特点, 因此逐步应用到植物生长监测、渍水、干旱和盐胁迫等研究中[19,39-44]。本研究中, 无人机平台采集的性状与实测值相关性高、误差小[26], 基于无人机平台采集的性状计算出的耐渍性综合评价值(值)能区分出不同亚群油菜的耐渍性水平的差异, 而通过值鉴定到的极端耐渍和敏感的种质资源在随后的实验中依然稳定地表现出耐渍或者敏感的表型(图4)。以上结果表明, 无人机表型采集平台在田间耐渍性鉴定中具有较高的可靠性和稳定性, 能有效的应用到油菜耐渍性评价和种质资源筛选中。
4 结论
本研究通过甘蓝型油菜渍水后的生长和生理指标的动态变化发现10 d可以作为其苗期耐渍性鉴定的适宜渍水时间; 在田间渍水处理10 d后对505份种质资源的耐渍性进行了综合评价和比较, 发现植被指数MTVI2D和MCARI2D均可作为快速、高效评价油菜耐渍性的指标, 并最终鉴定出9份稳定的渍水敏感材料和9份稳定的耐渍材料, 为甘蓝型油菜耐渍性的分子基础研究和遗传改良提供了试验条件参考和重要的种质资源。
[1] 王瑞元. 2021年我国粮油产销和进出口情况. 中国油脂, 2022, 47(6): 1–7. Wang R Y. Introduction of grain and oil production, marketing, import and export in 2021 in China., 2022, 47(6): 1–7 (in Chinese).
[2] 李真, 蒲圆圆, 高长斌, 周广生, 涂金星, 傅廷栋. 甘蓝型油菜DH群体苗期耐湿性的评价. 中国农业科学, 2010, 43: 286–292. Li Z, Pu Y Y, Gao C B, Zhou G S, Tu J X, Fu T D. Evaluation of waterlogging tolerance in rapeseed (L.) DH lines at seedling stage., 2010, 43: 286–292 (in Chinese with English abstract).
[3] 丛日环, 张智, 鲁剑巍. 长江流域不同种植区气候因子对冬油菜产量的影响. 中国油料作物学报, 2019, 41:894–903. Cong R H, Zhang Z, Lu J W. Climate impacts on yield of winter oilseed rape in different growth regions of the Yangtze River Basin., 2019, 41:894–903 (in Chinese with English abstract).
[4] 吴丽丽, 李谷成, 尹朝静. 生长期气候变化对我国油菜单产的影响研究. 干旱区资源与环境, 2015, 29(12): 198–203. Wu L L, Li G C, Yin C J. Impact of climate change in rapeseed’s growing seasons on rapeseed production in China., 2015, 29(12): 198–203 (in Chinese with English abstract).
[5] Sasidharan R, Bailey-Serres J, Ashikari M, Atwell B J, Colmer T D, Fagerstedt K, Fukao T, Geigenberger P, Hebelstrup K H, Hill R D, Holdsworth M J, Ismail A M, Licausi F, Mustroph A, Nakazono M, Pedersen O, Perata P, Sauter M, Shih M C, Sorrell B K, Striker G G, van Dongen J T, Whelan J, Xiao S, Visser E J W, Voesenek L. Community recommendations on terminology and procedures used in flooding and low oxygen stress research., 2017, 214: 1403–1407.
[6] Setter T L, Waters I. Review of prospects for germplasm improvement for waterlogging tolerance in wheat, barley and oats., 2003, 253: 1–34.
[7] Blom C W P M, Voesenek L A C J. Flooding: the survival strategies of plants., 1996, 11: 290–295.
[8] Panozzo A, Dal Cortivo C, Ferrari M, Vicelli B, Varotto S, Vamerali T. Morphological changes and expressions of,, and putativegenes in a large set of commercial maize hybrids under extreme waterlogging., 2019, 10: 62.
[9] Marschner H. Mechanisms of adaptation of plants to acid soils., 1991, 134: 683–702.
[10] Sasidharan R, Voesenek L A. Ethylene-mediated acclimations to flooding stress., 2015, 169: 3–12.
[11] Shabala S. Physiological and cellular aspects of phytotoxicity tolerance in plants: the role of membrane transporters and implications for crop breeding for waterlogging tolerance., 2011, 190: 289–298.
[12] Colmer T D, Greenway H. Ion transport in seminal and adventitious roots of cereals during O2deficiency., 2010, 62: 39–57.
[13] Mommer L, Visser E J W. Underwater photosynthesis in flooded terrestrial plants: a matter of leaf plasticity.(London), 2005, 96: 581–589.
[14] Mommer L, Pons T L, Wolters-Arts M, Venema J H, Visser E J W. Submergence-induced morphological, anatomical, and biochemical responses in a terrestrial speciesaffect gas diffusion resistance and photosynthetic performance., 2005, 139: 497–508.
[15] Ren B Z, Zhang J W, Dong S T, Liu P, Zhao B. Effects of waterlogging on leaf mesophyll cell ultrastructure and photosynthetic characteristics of summer maize., 2016, 11: e0161424.
[16] Zhou W J, Lin X Q. Effects of waterlogging at different growth stages on physiological characteristics and seed yield of winter rape (L.)., 1995, 44: 103–110.
[17] 陈雅慧. 油菜萌发期耐淹性种质资源筛选与遗传机制解析. 华中农业大学硕士学位论文, 湖北武汉, 2019. Chen Y H. Germplasm Screening and Genetic Mechanism Analysis of Submergence Tolerance during Rapeseed Germination. MS Thesis of Huazhong Agricultural University, Wuhan, Hubei, China, 2019 (in Chinese with English abstract).
[18] 荆蓉蓉. 甘蓝型油菜苗期耐湿相关性状的全基因组关联分析. 西南大学硕士学位论文, 重庆, 2017. Jing R R. Genome-wide Association Mapping of Water Logging Traits inL. MS Thesis of Southwest University, Chongqing, China, 2017 (in Chinese with English abstract).
[19] Jimenez J C, Cardoso J A, Leiva L F, Gil J, Forero M G, Worthington M L, Miles J W, Rao I M. Non-destructive phenotyping to identifyhybrids tolerant to waterlogging stress under field conditions., 2017, 8: 167.
[20] 韩佳慧. 地块尺度冬油菜湿渍害遥感监测方法研究. 浙江大学硕士学位论文, 浙江杭州, 2017. Han J H. Study on Parcel Scale Winter Oilseed Rape Waterlogging Monitoring Method by Remote Sensing. MS Thesis of Zhejiang University, Hangzhou, Zhejiang, China, 2017 (in Chinese with English abstract).
[21] 胡文河, 朱容佳, 王婧瑜, 郭巍, 何文安, 谷岩. 高粱种质资源芽期耐涝性综合评价及筛选. 吉林农业大学学报, 2022, https://kns.cnki.net/kcms/detail/22.1100.s.20220926.1845.005.html. Hu W H, Zhu R J, Wang J Y, Guo W, He W A, Gu Y. Comprehensive evaluation and screening of waterlogging tolerance of sorghum germplasm resources at bud stage., 2022, https://kns.cnki.net/kcms/detail/22.1100.s.20220926.1845. 005.html (in Chinese with English abstract).
[22] 唐章林, 王霖, 张娅茹, 朱丽, 唐钟林, 荆蓉蓉, 李阳阳. 甘蓝型油菜种质资源苗期耐湿性综合评价与筛选. 西南大学学报(自然科学版), 2022, 44(12): 20–28. Tang Z L, Wang L, Zhang Y R, Zhu L, Tang Z L, Jing R R, Li Y Y. Comprehensive evaluation and screening of waterlogging resistance at seedling stage of.(Nat Sci Edn), 2022, 44(12): 20–28 (in Chinese with English abstract).
[23] 佟汉文, 高春保, 邹娟, 刘易科, 朱展望, 陈泠, 张宇庆, 吴波.湖北稻茬小麦新品种(系)孕穗期耐渍性的鉴定与评价. 麦类作物学报, 2016, 36: 1635–1642. Tong H W, Gao C B, Zou J, Liu Y K, Zhu Z W, Chen L, Zhang Y Q, Wu B. Evaluation of waterlogging tolerance of wheat varieties at booting stage in Hubei rice-wheat rotation system., 2016, 36: 1635–1642 (in Chinese with English abstract).
[24] Tang S, Zhao H, Lu S P, Yu L Q, Zhang G F, Zhang Y T, Yang Q Y, Zhou Y M, Wang X M, Ma W, Xie W B, Guo L. Genome- and transcriptome-wide association studies provide insights into the genetic basis of natural variation of seed oil content in., 2021, 14: 470–487.
[25] 王学奎. 植物生理生化实验原理和技术(第2版). 北京: 高等教育出版社, 2006. pp 202–283. Wang X K. Experimental Principles and Techniques of Plant Physiology and Biochemistry, 2nd edn. Beijing: Higher Education Press, 2006. pp 202–283 (in Chinese).
[26] Li J J, Xie T J, Chen Y H, Zhang Y T, Wang C F, Jiang Z, Yang W N, Zhou G S, Guo L, Zhang J. High-throughput UAV-based phenotyping provides insights into the dynamic process and genetic basis of rapeseed waterlogging response in the field., 2022, 73: 5264–5278.
[27] Hinton P R, McMurray I, Brownlow C. SPSS Explained, 2nd edn. London: Routledge, 2014. pp 338–350.
[28] Ihaka R, Gentleman R. R: a language for data analysis and graphics., 1996, 5: 299–314.
[29] Moberly J G, Bernards M T, Waynant K V. Key features and updates for Origin 2018., 2018, 10: 5.
[30] Chen C J, Chen H, Zhang Y, Thomas H R, Frank M H, He Y H, Xia R. TBtools: an integrative toolkit developed for interactive analyses of big biological data., 2020, 13: 1194–1202.
[31] 张静, 高文博, 晏林, 张宗文, 周海涛, 吴斌. 燕麦种质资源耐盐碱性鉴定评价及耐盐碱种质筛选. 作物学报, 2023, 49: 1551–1561. Zhang J, Gao W B, Yan L, Zhang Z W, Zhou H T, Wu B. Identification and evaluation of salt-alkali tolerance and screening of salt-alkali tolerant germplasm of oat (L.)., 2023, 49: 1551–1561 (in Chinese with English abstract).
[32] Leul M, Zhou W J. Alleviation of waterlogging damage in winter rape by uniconazole application: effects on enzyme activity, lipid peroxidation, and membrane integrity., 1999, 18: 9–14.
[33] 张学昆, 陈洁, 王汉中, 李加纳, 邹崇顺. 甘蓝型油菜耐湿性的遗传差异鉴定. 中国油料作物学报2007, 29: 204–208. Zhang X K, Chen J, Wang H Z, Li J N, Zou C S. Genetic difference of waterlogging tolerance in rapeseed (L.), 2007, 29: 204–208 (in Chinese with English abstract).
[34] Zou X L, Hu C W, Zeng L, Cheng Y, Xu M Y, Zhang X K. A comparison of screening methods to identify waterlogging tolerance in the field inL. during plant ontogeny., 2014, 9: e89731.
[35] 李阳阳, 荆蓉蓉, 吕蓉蓉, 石鹏程, 李欣, 王芹, 吴丹, 周清元,李加纳, 唐章林. 甘蓝型油菜湿害胁迫响应性状的全基因组关联分析及候选基因. 作物学报2019, 45: 1806–1821. Li Y Y, Jing R R, Lyu R R, Shi P C, Li X, Wang Q, Wu D, Zhou Q Y, Li J N, Tang Z L. Genome-wide association analysis and candidate genes prediction of waterlogging-responding traits inL., 2019, 45: 1806–1821 (in Chinese with English abstract).
[36] Li Z, Mei S F, Mei Z, Liu X L, Fu T D, Zhou G S, Tu J X. Mapping of QTL associated with waterlogging tolerance and drought resistance during the seedling stage in oilseed rape ()., 2014, 197: 341–353.
[37] Boem F H G, Lavado R S, Porcelli C A. Note on the effects of winter and spring waterlogging on growth, chemical composition and yield of rapeseed., 1996, 47: 175–179.
[38] 王燕茹, 袁秉琛, 孙郁婷, 王志勇, 虞道耿. 蝴蝶豆种质资源芽期耐盐性筛选及评价. 热带作物学报, 2022, 44: 955–967. Wang Y R, Yuan B C, Sun Y T, Wang Z Y, Yu D G. Screening and evaluation of salt tolerance in the bud stage ofResources., 2022, 44: 955–967 (in Chinese with English abstract).
[39] Al-Tamimi N, Brien C, Oakey H, Berger B, Saade S, Ho Y S, Schmockel S M, Tester M, Negrao S. Salinity tolerance loci revealed in rice using high-throughput non-invasive phenotyping., 2016, 7: 13342.
[40] Duan L F, Han J W, Guo Z L, Tu H F, Yang P, Zhang D, Fan Y, Chen G X, Xiong L Z, Dai M Q, Williams K, Corke F, Doonan J H, Yang W N. Novel digital features discriminate between drought resistant and drought sensitive rice under controlled and field conditions., 2018, 9: 492.
[41] Fisher L H, Han J, Corke F M, Akinyemi A, Didion T, Nielsen K K, Doonan J H, Mur L A, Bosch M. Linking dynamic phenotyping with metabolite analysis to study natural variation in drought responses of brachypodium distachyon., 2016, 7: 1751.
[42] Guo Z L, Yang W N, Chang Y, Ma X S, Tu H F, Xiong F, Jiang N, Feng H, Huang C L, Yang P, Zhao H, Chen G X, Liu H Y, Luo L J, Hu H H, Liu Q, Xiong L Z. Genome-wide association studies of image traits reveal genetic architecture of drought resistance in rice., 2018, 11: 789–805.
[43] Wu D, Guo Z L, Ye J L, Feng H, Liu J X, Chen G X, Zheng J, Yan D M, Yang X Q, Xiong X, Liu Q, Niu Z Y, Gay A P, Doonan J H, Xiong L Z, Yang W N. Combining high-throughput micro- CT-RGB phenotyping and genome-wide association study to dissect the genetic architecture of tiller growth in rice., 2019, 70: 545–561.
[44] Zhang X H, Huang C L, Wu D, Qiao F, Li W Q, Duan L F, Wang K, Xiao Y J, Chen G X, Liu Q, Xiong L Z, Yang W N, Yan J B. High-throughput phenotyping and QTL mapping reveals the genetic architecture of maize plant growth., 2017, 173: 1554–1564.
Evaluation of field waterlogging tolerance and selection of waterlogging- resistant germplasm resources ofL.
LI Ji-Jun1, CHEN Ya-Hui1,2, WANG Yi-Jin1, ZHOU Zhi-Hua1, GUO Zi-Yue3, ZHANG Jian3, TU Jin-Xing1, YAO Xuan1,*, and GUO Liang1,*
1College of Plant Science and Technology, Huazhong Agricultural University / National Key Laboratory of Crop Genetic Improvement, Wuhan 430070, Hubei, China;2Chengde Academy of Agricultural and Forestry Sciences, Chengde 067000, Hebei, China;3College of Resources and Environmental Sciences, Huazhong Agricultural University / Macro Agriculture Research Institute, Wuhan 430070, Hubei, China
L. () is one of the most important oil crops in China, and has high risk of waterlogging stress during its production. The objective of this study is to evaluate the field waterlogging tolerance and screen stable waterlogging-resistant germplasm resources. The appropriate waterlogging duration for waterlogging tolerance identification was determined under pot conditions first, and then the comprehensive evaluation and comparison of the waterlogging tolerance of 505 germplasm resources ofwere carried out. The stable extreme materials were screened in field experiments. The results showed that the growth ofplants began to be affected after four-day-waterlogging, and severely inhibited after about 10-day-waterlogging under pot conditions. In the two-year field experiment, 27 indexes extracted using the UAV phenotype acquisition platform were converted into two common factors by factor analysis. The common factor 1 represented the growth state ofunder waterlogging, and the common factor 2 represented the physiological state. The comprehensive evaluation value of waterlogging resistance (-value), which was calculated according to the load and variance contribution rate of the two common factors, divided the waterlogging resistance ofgermplasm resources into four types, including extremely waterlogging resistant type (Cluster I, 99 materials), waterlogging resistant type (Cluster II, 200 materials), sensitive type (Cluster III, 187 materials), and extremely sensitive type (Cluster IV, 19 materials). In the two-year field experiment, nine stable waterlogging sensitive materials and nine resistant materials were identified, and the results were confirmed by the field experiments in 2022. Moreover, in the two-year experiment, the vegetation indexes, MTVI2D, and MCARI2D had high correlations with the-value, and the correlation coefficients were greater than 0.76, which can be used for rapid and efficient comprehensive evaluation ofwaterlogging resistance. In conclusion, the evaluation system and rapid and comprehensive evaluation methods for waterlogging tolerance ofin the field were established, which were applied to analyze the types of waterlogging tolerance ofgermplasm resources and identify the stable waterlogging resistant and sensitive materials in this study, providing reliable evaluation methods and important germplasm resources for the research and genetic improvement of waterlogging resistance of.
L.; germplasm resources; seedling stage; waterlogging tolerance; the comprehensive evaluation
2023-05-24;
2023-06-13.
10.3724/SP.J.1006.2023.34034
通信作者(Corresponding author): 郭亮, E-mail: guoliang@mail.hzau.edu.cn; 姚璇, E-mail: xuanyao@mail.hzau.edu.cn
E-mail: liy0234@webmail.hzau.edu.cn
2023-02-22;
本研究由国家重点研发计划项目(2022YFD1200400)和湖北省重点研发计划项目(2021ABA011)资助。
This study was supported by the National Key Research and Development Program of China (2022YFD1200400) and the Key Research and Development Plan of Hubei Province (2021ABA011).
URL: https://kns.cnki.net/kcms2/detail/11.1809.S.20230609.1033.002.html
This is an open access article under the CC BY-NC-ND license (http://creativecommons.org/licenses/by-nc-nd/4.0/).

