金属锂表面Sn-Al 双金属包覆层的构筑及其空气稳定性研究
王弘毅,李晶泽
(电子科技大学 材料与能源学院,四川 成都 611731)
金属锂具有极高质量比容量(3860 mAh/g)和最低的氧化还原电位(-3.045 V vs.标准氢电极),是实现高能量密度电池的首选负极材料,因此以金属锂作为负极材料的锂二次电池是最有前景的下一代电化学储能器件[1-3]。然而金属锂负极在过去几十年的研发过程中虽有很大突破,但其电化学性能的提升不显著,且金属锂易于在潮湿空气中反应失活,从而导致金属锂电池面临请如大规模组装条件苛刻、成本高昂等问题。当前的研究对如何提高金属锂空气稳定性的关注较少,该问题的解决对于锂负极及锂二次电池的商业化具有重要意义。
在提高金属锂负极空气稳定性的方法中,采用表面包覆非常有效。目前已经报道的包覆材料种类繁多,包括无机薄膜[4-8]、金属薄膜[9-10]、聚合物薄膜[11-14]和复合薄膜[15-19]。液相法是最为常见的表面包覆方法,但存在工艺复杂、污染环境大等问题。相比较而言,气相包覆法具有包覆层厚度与成分精确可控的优点。前期本团队通过磁控溅射技术在金属锂表面制备金属铝单层膜,其空气稳定性及电化学性能均得到一定程度的提高[9,20],证明了金属薄膜真空沉积包覆方法不仅工艺简单、成本低,而且提高空气稳定性的同时有效提高了其电化学性能。但是,单层金属膜改性的金属锂在空气中的稳定时间仍然小于1 h。鉴于此,本研究采用易于商业化量产的磁控溅射技术在金属锂表面依次制备金属Al 和金属Sn 双层保护膜,所得样品标记为Sn@Al@Li。该制备方法简便且成本低,利用单质金属在空气中易于形成钝化膜的特点,延长金属膜的抗氧化时间,实现金属锂的保护。并借助两层金属之间的协同作用,进一步提高金属锂的空气稳定性至3 h,同时利用双金属层具有高离子电导率与较好的机械强度的特点,有效抑制锂枝晶和副反应产生,提高其循环寿命至300 h。
1 实验材料和方法
1.1 锡铝双层金属薄膜的制备
采用沈阳世昂真空技术有限公司的SAZK-500 直流磁控溅射设备将金属铝和金属锡逐层在金属锂箔衬底表面沉积,形成双层复合包覆。靶材采用高纯铝靶(99.99%)和高纯Sn 靶(99.99%),工作气体使用高纯氩气(99.999%),天齐锂业公司提供170 μm 厚的金属锂箔为衬底。两种金属薄膜镀膜参数相同: 氩气流量为50 sccm(标准状态下mL/min)、靶基距为7 cm、工作气压为1 Pa(电阻规)、样品台转速为10 r/min、直流电源功率为90 W(300 V×0.3 A)、镀膜时间为10 min,所得到的铝薄膜厚度为74 nm,锡薄膜厚度为3 μm。
1.2 材料及电池的组装、测试表征
空气腐蚀前后的锂片借助扫描电子显微镜(FESEM,Hitachi,S3400N)对其表面形貌进行表征。成分分析是利用X 射线衍射(XRD,ESCALAB 250Xi)和X射线能谱仪(EDS,NCAPenta FET-X3 SDD)实现。CV 测量采用电化学工作站(CHI 660C,上海辰华)进行,电压范围为-0.5~3 V,扫描速率为0.01 V·s-1。将金属Li 片作为工作电极及对电极,与隔膜(Celgard 2325)在充满氩气的手套箱中组装Li | Li 对称电池(CR2032 扣式电池)。将金属Li 片作为工作电极,不锈钢片(Stainless Steel,SS) 作为对电极,与隔膜(Celgard 2325)在充满氩气的手套箱中组装Li | SS 扣式对称电池。电解液采用1 mol/L 的LiPF6作为锂盐、碳酸乙烯酯(EC)/碳酸二乙酯(DEC)/碳酸二甲酯(DMC)(体积比1 ∶1 ∶1)的混合物作为溶剂。恒流充放电测试由BTS-5V0A 电池测试仪(深圳市新威尔电子有限公司)在恒温25 ℃下进行测试。电化学阻抗谱(EIS)测量使用电化学工作站(PARSTAT 2236)在100 kHz~100 MHz 的频率范围内、扰动幅度为10 mV 的条件下进行。
2 结果与讨论
2.1 锡铝双层金属薄膜相结构分析及形貌演变
为了研究包覆层延缓腐蚀的机制,对Sn@Al@Li样品进行了XRD 检测,如图1 所示,测试了0,1,3和6 h 四个不同腐蚀时间下Sn@Al@Li 样品的成分变化。首先,刚制备好的样品在35°和75°存在明显的Sn特征峰,显然Sn 薄膜(3 μm 厚) 成功沉积在金属Al表面并且以金属单质的形式存在,而未发现Al 特征峰的原因可能是由于Al 镀层仅74 nm,厚度太薄导致难以探测到明显的衍射峰,此外在51°出现的微弱SnO2特征峰可能是由于在空气中测试时发生了一定程度的氧化。随着腐蚀时间的增加,样品的样品表面除了在51°出现的SnO/SnO2特征峰以外,30°和64°处也出现了微弱的SnO/SnO2特征峰,但3 h 样品的SnO/SnO2特征峰强度并没有明显变化,说明形成了一层较完整致密的表面钝化层,阻止了腐蚀反应进一步发生。当腐蚀时间增加到6 h,样品表面的Sn 特征峰强度明显减弱,而SnO/SnO2特征峰强度明显增强,说明此时钝化层保护作用逐渐减弱。
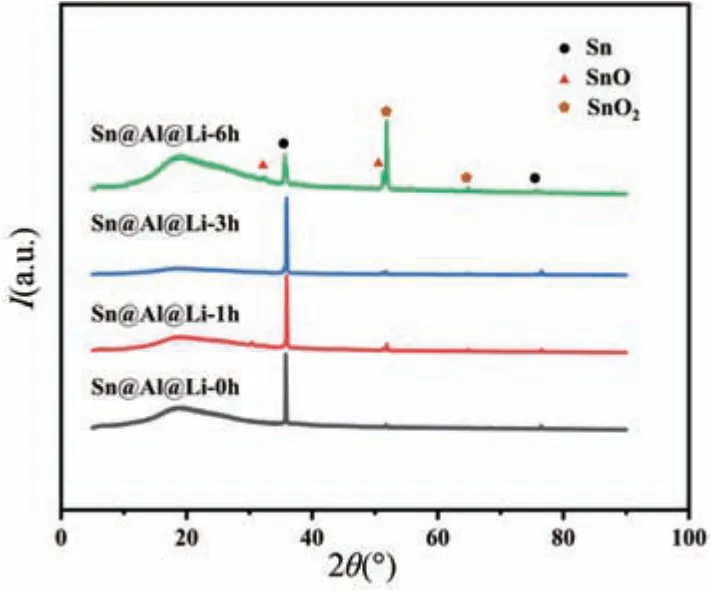
图1 Sn@Al@Li 样品在空气中腐蚀前后XRD 图Fig.1 X-ray diffraction patterns of Sn@Al@Li samples before and after corrosion in air
相结构分析表明成功制备出了Sn@ Al@ Li 样品,通过单质金属锡层自身形成的钝化膜大大提高了其空气稳定性。于是通过SEM 观察表面形貌变化,进一步探究保护机制。观察Sn@ Al@ Li 样品空气中静置0,1,3,6 h 后表面形貌变化,如图2(a~f)所示。发现表面的Sn 层在接触空气后形成了均匀的氧化层,随着在空气中静置时间的增加,样品表面逐渐出现更多裂缝,钝化膜发生碎裂和明显的位移,这是源于金属氧化物的形成破坏了薄膜结构的完整性。但包覆层仍然是均匀的且附着于锂表面,起到一定的延缓腐蚀的作用。而当静置时间达到6 h 后,如图2(g~h)所示,表面裂缝变得更宽更深,并且能够从裂缝处观察到明显的三层结构,表面的氧化层变厚并与底部的金属包覆层剥离,同时暴露在空气中的金属包覆层已发生了明显的碎裂情况,导致失去了对底部金属锂的保护作用。底部更多的金属锂暴露在空气中,导致腐蚀速度加快,发生更严重的形变,使包覆层进一步碎裂,最终失去保护作用。总的来说,Sn@Al@Li 样品表面的单质金属锡层形成了稳定致密的钝化膜,起到了较好的保护作用,然而随着空气中静置时间的延长,腐蚀层体积膨胀导致开裂,并且裂缝逐渐变多变宽,同时表面钝化层逐渐增厚并脱落,更多地暴露底部的金属包覆层,最终暴露金属锂从而失去保护作用。

图2 Sn@Al@Li 样品在空气中腐蚀前后表面SEM 图。(a~b)静置0 h;(c~d)静置1 h;(e~f)静置3 h;(g~h)静置6 hFig.2 Surface SEM images of Sn@Al@Li samples before and after corrosion in air.(a-b) 0 h;(c-d) 1 h;(e-f) 3 h;(g-h) 6 h
此外,还进一步测试了5 周电化学循环活化后的Sn@Al@Li 极片的循环伏安(CV)曲线,如图3 所示。发现在锂的脱嵌反应中仅有一对氧化还原峰,并没有出现额外的合金/脱合金反应,说明在电化学循环后,Sn@Al@Li 样品表面形成了稳定的界面层,其具有良好的电化学惰性,同时Sn@ Al@ Li 样品电流(204 mA)远高于纯锂电极(19 mA),说明包覆层在电解液中具有更高的稳定性,导致更小的界面阻抗及更大的峰值电流密度。
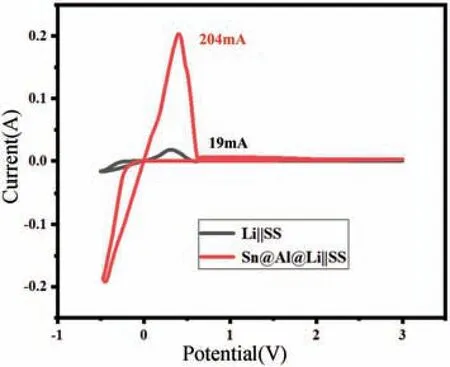
图3 Li‖SS 与Sn@Al@Li‖SS 电池的CV 曲线Fig.3 CV curves of Li‖SS and Sn@Al@Li‖SS cells
2.2 空气稳定性测试
为了确定Sn@Al@Li 样品的空气稳定性,通过表面颜色变化、质量变化和放电容量变化三个方面进行测试分析。
首先将纯锂带和已制备好的Sn@Al@Li 样品裁剪为直径12 mm 的圆片,放置在空气中对比表面颜色的变化,如图4 所示。在5 min 时,样品表面出现复杂的颜色变化,主要可能是由于刚接触空气形成一层表面钝化膜所致。在空气中放置1 h 后,可以看到Li 表面已经完全变黑,Sn@Al@Li 样品表面为银白色金属光泽,并能维持金属光泽达到3 h,说明Sn@ Al@ Li样品表面形成了具有较好致密性的钝化层,从而起到了较好的保护作用。即使空气中放置时间达到6 h 后,仍有部分表面存在一定的金属光泽。但是24 h 之后,包覆样品已经完全变成灰白色,与未保护的纯金属锂一样,表明金属锂已经全部被氧化。

图4 纯锂与Sn@Al@Li 样品在空气中腐蚀前后表面颜色变化对比图Fig.4 Comparison of surface color variation between pristine Li and Sn@Al@Li samples before and after corrosion in air
其次将样品放置在空气中测试质量变化,测量室的温度和空气湿度分别是(26±1)℃和(50±7)%。图5中Y轴代表质量变化率,来自于样品的质量变化量与样品的初始质量之商。每种样品进行三组测试,分别用1,2,3 进行标注。图5 中纯金属锂在前5 min 出现质量的快速增加现象,曲线斜率达到了1.63/min,而在表面进行双层金属包覆后未出现该现象,曲线斜率为0.09/min,说明双层金属的包覆改变了空气对金属锂的腐蚀过程,大幅延缓了腐蚀速度。5 min~1 h 内纯金属锂的质量增加速度仍然比Sn@Al@Li 样品质量增加速度快,纯锂样品的曲线斜率分别为0.15/min,0.15/min,0.12/min,而Sn@Al@Li 样品的曲线斜率分别为0.09/min,0.11/min,0.10/min,说明1 h 之内金属包覆层起到了延缓腐蚀的作用,与颜色的变化趋势一致。3 h 后Sn@Al@Li 样品保护作用开始减弱,对应的曲线斜率开始增加到0.16/min,这也与样品表面的颜色变化趋势相符。当达到24 h 后,包覆样品与纯锂样品质量变化率曲线均出现明显拐点,由上文推断此时纯Li 基本被完全腐蚀。然而能够看到此时包覆样品的质量变化率明显小于纯锂样品,可能是因为金属包覆层与Li 在界面处发生了合金化反应,形成锂合金保护层,其中合金化锂原子活性降低难以被腐蚀,导致质量变化率较低[21-22]。

图5 空气中静置48 h 的纯锂与Sn@Al@Li 样品质量变化率曲线Fig.5 Curves of mass change rate of pristine Li and Sn@Al@Li samples for 48 h in air
最后对Sn@Al@Li 样品进行剩余放电容量测试,以此判断包覆层保护性能。如图6 所示,未接触空气的Sn@Al@Li 样品可能由于表面金属包覆层在界面处与Li 发生自发的合金化反应,导致Sn@ Al@ Li-0 h样品的容量释放率为97%,略低于纯锂样品,即约有0.8 mAh 的Li 未脱出,可能存在于锂合金保护膜中。当样品在空气中放置1 h 和3 h 后,可以看到,Li 的容量释放率分别为43%和14%,而Sn@Al@Li 的容量释放率分别达到89%和79%。当在空气中放置6 h,表面保护效果明显减弱,此时Sn@Al@Li 样品的容量释放率仍能达到60%,而纯金属Li 的容量释放率仅剩3%。显然,双金属包覆层起到了优异的保护效果,在空气中有效延缓腐蚀。

图6 (a)纯锂与(b)Sn@Al@Li 样品空气中静置不同时间下的容量释放率Fig.6 Capacity release rate of (a) pristine Li and (b) Sn@Al@Li samples after exposure in the air for different time
2.3 对称电池循环性能及阻抗
如图7 所示,在1 mA/cm2、1 mAh/cm2循环条件下对比了纯金属Li 与Sn@ Al@ Li 样品的循环性能。可以看到,未包覆的金属锂片只能稳定循环约120 h,而包覆后的锂片可以稳定循环约300 h,循环性能得到明显改善,提高循环寿命接近1.5 倍。从充放电电压曲线来看,循环前期极化电压较大,可能是由于表面金属镀层在锂沉积脱出过程中与锂发生了合金化反应,随着合金相的形成,极化电压逐渐降低,循环中期极化电压逐渐小于未包覆锂片,显然合金相的高锂离子扩散系数[23-24]和较好的界面稳定性使其具有较优异的循环性能。
为了进一步证实包覆后的金属锂负极在循环过程中的界面稳定性,测试了不同循环周数下的阻抗变化情况。如图8 所示,未经循环的对称电池中纯锂负极的总阻抗Roverall为108.8 Ω,而Sn@Al@Li 包覆电极的阻抗达到了216.4 Ω,原因可能是包覆金属未与Li 完全形成锂合金相导致首次脱锂困难。通过前几周的活化以后,在金属锂负极表面包覆层中构建了良好的锂离子传输通道,同时改善了界面接触,使得界面阻抗逐渐减小,纯锂负极与Sn@Al@Li 样品的总阻抗在循环50 周后分别达到52.2 Ω 和33.7 Ω。随着循环的进行,纯锂电极暴露在有机电解液中发生副反应形成大量SEI 膜。由于锂剥离及沉积所导致的负极体积剧烈变化,破坏了机械性能较差的SEI 膜,使新鲜的锂再次暴露在电解液中,导致持续的副反应发生,形成大量电解液分解的副产物与“死锂” 并堆积在负极表面,总阻抗从100 周的51.6 Ω 快速增加到150 周的133.7 Ω。作为对比,Sn@Al@Li 样品循环至100 周阻抗仅为37.4 Ω,到150 周阻抗仅缓慢增加到41.7 Ω。这进一步证实了金属包覆层有效钝化了金属锂负极表面,包覆后的金属锂负极相比于纯锂负极具有更稳定的界面性质,有效延长了负极的循环寿命。
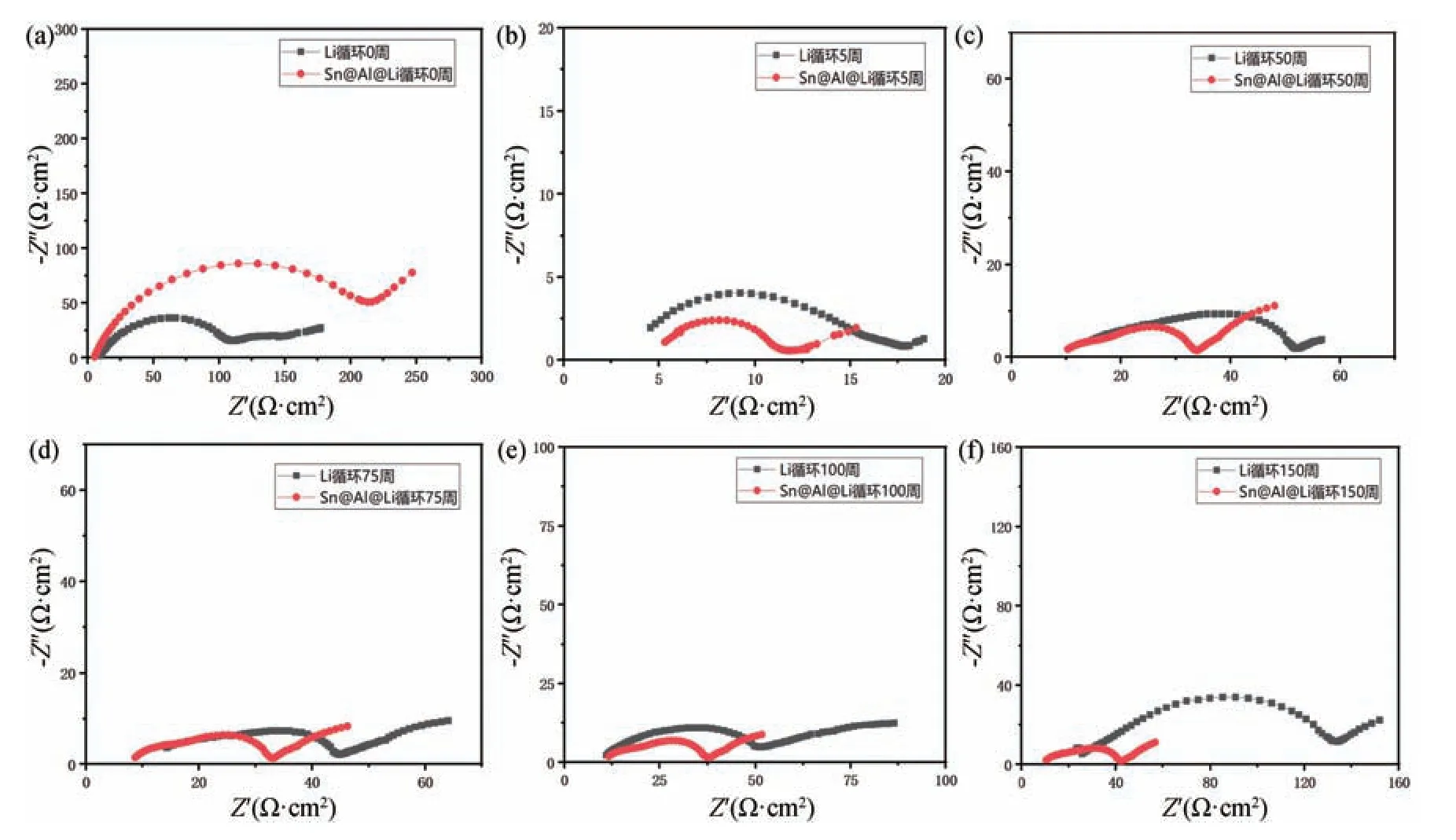
图8 纯锂与Sn@Al@Li 对称电池在不同循环条件下的交流阻抗谱。(a)未循环;(b)循环5 周;(c)循环50 周;(d)循环75 周;(e)循环100 周;(f)循环150 周Fig.8 The AC impedance of pristine Li and Sn@Al@Li symmetric cell in different cycles.(a) 0 cycle;(b) 5th cycle;(c) 50th cycle;(d) 75th cycle;(e) 100th cycle;(f) 150th cycle
2.4 结果与讨论
如图9 所示,在未循环的双层金属包覆锂负极的表面,使用Al 层作为过渡层可以使Sn 层不易与Li 自发反应形成合金相。包覆膜最外层能够存在单质金属Sn 层,并在接触空气后表面形成致密的钝化膜,有效延缓空气中O2和H2O 对金属锂的腐蚀。此外,Al 层能够进一步延缓金属锂的腐蚀,防止产生更大的形变导致包覆层开裂,因此金属锂的空气稳定性有了显著提高。在循环之后,表面的金属层与锂发生电化学合金化反应,形成具有高锂离子扩散系数的合金相层,可以帮助在合金层表面还原的锂原子快速通过锂合金层扩散,有助于减少枝晶生长。相比之下,纯锂表面在空气中形成疏松多孔的腐蚀层,水分子能够很容易通过LiOH 层快速扩散,从而腐蚀金属锂。作为负极,由于金属锂的高化学活性导致与电解液持续地发生副反应,多次循环后在表面形成不均匀的SEI 层,从而进一步诱发不均匀的锂沉积,导致产生大量锂枝晶及“死锂”,并最终使得电解液快速枯竭,极化迅速增加,电池快速失效。
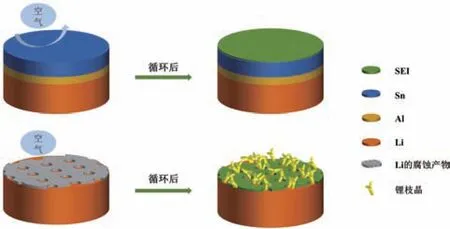
图9 在空气中静置后的Sn@Al@Li 与纯锂样品在电化学循环过程中的示意图Fig.9 Schematic diagram of the air-exposed Sn@Al@ Li and pristine Li samples in the electrochemical circulation
3 结论
采用磁控溅射方法成功制得了Sn/Al 双层金属保护的金属锂负极,即Sn@ Al@ Li 样品,并借助XRD与SEM 技术分析确定了该包覆层表面通过单质金属Sn 层自身形成的致密钝化膜提高其空气稳定性的保护机制。包覆样品表面能够保持3 h 金属光泽,即使在空气中静置时间达到6 h,样品部分表面仍有金属光泽,质量变化率曲线中Sn@Al@Li 样品质量增加速度远低于纯锂样品,斜率仅有0.07/min,而纯锂样品则达到了0.16/min。半电池放电容量测试表明包覆样品在空气中静置3 h 的容量释放率约为80%,静置6 h 仍有60%的容量释放率,而未包覆样品容量释放率仅分别为14%和3%。以上结果均说明双金属层包覆法很好地利用金属Sn 层在空气中表面形成钝化膜保护自身不被腐蚀的特性,有效延缓了金属锂的腐蚀。在电化学性能方面,组装了Sn@Al@Li 对称电池,在电流密度为1 mA/cm2、面容量为1 mAh/cm2条件下,可稳定循环超过300 h,循环寿命相对于纯锂负极120 h 提高了约1.5 倍。同时,循环150 周后,电池阻抗仅由活化后的33.7 Ω 增加到41.7 Ω。可见,双层金属包覆膜不仅利用金属Sn 单质在空气中稳定存在的机制提高了自身的空气稳定性,同时有效改善了金属锂的电化学性能。

