衣藻对盐胁迫下小麦幼苗光合生理指标的影响
王彦钦,孟宪刚,李武阳,罗光宏
(1.兰州交通大学生物与制药工程学院,甘肃 兰州 730070;2.河西学院甘肃省微藻工程技术研究中心,甘肃 张掖 734000)
盐胁迫是植物生长发育过程中经常遭遇的主要非生物胁迫之一。当植物遭遇盐胁迫,自身会启动保护机制,闭合气孔以减少水分散失,而气孔的闭合会导致叶片CO2浓度(Ci)下降,从而抑制暗反应[1]。同时,高浓度的离子还会造成光类囊体解离,使叶绿体结构遭到严重破坏,进而导致光反应受到抑制[2]。因此,盐胁迫会使作物光合效率降低,从而抑制其生长,最终导致产量降低[3]。此外,在盐胁迫下,高等植物的水分运输和抗氧化系统也会受到一定干扰,进而导致其产量和品质降低[4]。据报道,我国耕地盐渍化面积占总耕地面积的6.62%,达到了920.9 万hm2[5]。加强盐碱化土壤的综合开发与运用,将对我国粮食安全起到重要作用[6]。
微藻是一类光合利用度高的低等自养生物,其分布广泛,种类繁多,具有固碳、固氮等特性[7]。研究发现,微藻可以促进植物生长,提升植物抗逆性[8-11]。BABU 等[8]研究发现,与不接种固氮蓝藻的对照相比,接种固氮蓝藻处理小麦在处理后14 d 鲜质量增加30%~60%,干质量增加14%~40%。钟国民等[9]研究发现,应用藻类活性细胞生物肥能促进水稻分蘖,提高成穗率、有效穗数、结实率和实粒数,进而提高水稻产量。XU 等[10]研究发现,纤细席藻产生的多糖可以提高植株的K+、Ca2+、Mg2+含量及光合活性;增强超氧化物歧化酶(SOD)活性,降低活性氧含量,减少氧化损伤;还可以促进柠条、锦鸡儿的种子萌发和幼苗新陈代谢。杜氏盐藻和其β-胡萝卜素提取物可以提升中度盐胁迫下南瓜总生物量、产量、光合色素含量以及抗氧化物质含量等,进而提升南瓜抗中度盐胁迫的能力[11]。
衣藻是绿藻门衣藻科的单细胞藻类,其产生的孢子具有极强的耐受性,且藻株对环境无污染,对人畜没有致病性[12]。衣藻具有作为生物肥料的潜能,在盐胁迫环境下可以积累大量海藻糖,而海藻糖具有优良的渗透调节作用[13-14]。目前,衣藻在植物上的研究主要集中于提升土壤肥力[15]、促进植物生长[16]方面,在盐胁迫下植物上的应用研究鲜见报道,且衣藻对植物光合作用的影响尚不明确。为此,采用德巴衣藻(Chlamydomonas debaryana)藻粉作为试验材料,研究其对盐胁迫下小麦幼苗光合生理指标的影响,为衣藻粉在盐胁迫下小麦上的应用提供理论依据。
1 材料和方法
1.1 试验材料
供试小麦品种为长丰2112,购自张掖当地农贸市场;衣藻藻粉由甘肃凯源微藻工程技术中心生产的微藻(德巴衣藻)干燥制成。
1.2 试验设计
采用20% 过氧化氢对小麦种子表面消毒15 min,然后用无菌水冲洗3 次,最后置于温度为25 ℃的培养箱内黑暗培养24 h。待种子发芽后,挑选萌发一致的种子放入清洗灭菌后的砂土盆中,并将其置于25 ℃、12 h 光照[300 μmol/(m2·s)]/12 h 黑暗的培养箱内进行培养。培养期间,向砂土盆内继续添加清水保持砂土湿润,用于催发小麦种子。待小麦长至两心一叶时,进行盐胁迫处理,共设6个处理,CK:每天施加50 mL 无菌水;T0—T4:连续5 d每天施加50 mL 150 mmol/L 的NaCl 溶液,从添加NaCl 溶液当日开始,T1—T4 处理分别每3 d 添加50 mL 0.25、0.5、1.0、2.0 g/L 的衣藻藻液,T0 处理同时添加50 mL 无菌水,共添加5 次。然后测定各生理指标。
1.3 测定项目及方法
1.3.1 光合色素含量 处理后12 d,取0.1 g 小麦叶片,将其研磨捣碎后加入5 mL 80%丙酮溶液,低温超声处理20 min,于4 ℃放置24 h,离心后,取上清液,利用DR 600 紫外分光光度计分别在波长663、646、470 nm 处测定吸光值,以80%丙酮为空白对照。按下列公式计算叶绿素a、b和类胡萝卜素的质量浓度。
式中,Ca、Cb和Cxc分别代表叶绿素a、b和类胡萝卜素的质量浓度。
1.3.2 光合气体交换参数 分别于处理后3、6、9、12 d,选取生长健壮、一致的小麦10 株,选取受光方向一致的旗叶,测定其净光合速率(Pn)、蒸腾速率(Tr)、气孔导度(Gs)和Ci,重复测量3次。
1.3.3 叶绿素荧光参数 分别于处理后3、6、9、12 d,选取生长健壮、一致的小麦10 株,在环境温度为25 ℃的情况下,于9:00 选取受光方向一致的旗叶,所选叶片暗适应30 min后,在距叶尖3 cm 处,利用Handy PEA 植物效率仪测定叶绿素荧光参数光系统Ⅱ(PSⅡ)最大光化学效率(Fv/Fm),恢复光照后测定光化学淬灭系数(qP)、非光化学淬灭系数(qN)、PSⅡ实际光量子产量[(Y(Ⅱ)]和电子传递速率(ETR)。
1.4 数据处理
试验数据采用Excel 2013 进行整理,用SPSS 21.0软件进行方差分析,用OriginPro 8.5软件制图。
2 结果与分析
2.1 衣藻质量浓度对盐胁迫下小麦幼苗叶片光合色素含量的影响
由表1 可知,与CK 相比,T0 处理小麦幼苗叶片叶绿素a、叶绿素b、类胡萝卜素和总叶绿素含量分别降低48.1%、25.0%、43.8%和43.4%。添加不同质量浓度的衣藻藻液后,除叶绿素b含量外,其他色素含量总体均较T0处理显著提高。添加衣藻藻液后,对于叶绿素a 含量,各处理均较T0 处理显著提高,表现为T4>T3>T2>T1>T0,仅T3和T4处理间差异不显著;对于叶绿素b 含量,总体上有所升高,但各处理间差异不显著;对于类胡萝卜素含量,各处理均显著提高,表现为T4>T3>T2>T1>T0,T4 处理最高,接近CK,较T0 处理提高71.1%;对于总叶绿素含量,各处理总体上均显著提高,表现为T4>T3>T2>T1>T0,仅T1处理与T0处理差异不显著。

表1 衣藻质量浓度对盐胁迫下小麦幼苗叶片光合色素含量的影响Tab.1 Effect of concentration of Chlamydomonas debaryana on photosynthetic pigment content in wheat seedling leaves under salt stressng/g
2.2 衣藻质量浓度对盐胁迫下小麦幼苗叶片光合气体交换参数的影响
2.2.1 Pn 如图1 所示,处理后3~12 d,T0—T4 处理小麦幼苗叶片Pn 均低于CK;随着处理后时间的推进,CK Pn 稍有降低,变化不明显,T0—T1 处理Pn逐渐降低,T2—T4 处理Pn 逐渐升高。在处理后3 d,T0—T4处理间Pn无明显差异;处理后6 d,T0—T4 处理间Pn 开始出现明显差异,表现为T3>T4>T3>T1>T0;处理后9 d,Pn 仍表现为T3>T4>T3>T1>T0,T3 处理较T0 处理提高37.5%,T2—T4 处理较处理后6 d 提高,与CK 间的差距较处理后6 d 缩小,而T0—T1处理较处理后6 d降低;处理后12 d,T2—T4处理Pn 继续提高,尤其是T3 处理,与CK 间的差距进一步缩小,T0—T1处理Pn继续降低。

图1 衣藻质量浓度对盐胁迫下小麦幼苗叶片Pn的影响Fig.1 Effect of Chlamydomonas debaryana concentration on Pn of leaves of wheat seedlings under salt stress
2.2.2 Tr 如图2所示,处理后3~12 d,T0—T4处理小麦幼苗叶片Tr 均低于CK;随着处理后时间的推进,T0—T4 处理Tr 明显降低,CK 总体上稍微降低,T0—T4 处理与CK 间的差距逐渐变大。处理后3 d,Tr表现为CK>T4>T3>T1>T2>T0;处理后6 d,Tr表现为CK>T2>T4>T3>T1>T0,T0—T4 处理与CK 间的差距较处理后3 d 加大;处理后9 d,Tr 表现为CK>T3>T4>T2>T1>T0,T0—T4 处理与CK 间的差距较处理后6 d 加大;处理后12 d,Tr 表现与处理后9 d 一致,T0—T4处理与CK间的差距达到最大,T0处理较CK降低37.8%,T3 和T4 处理分别较CK 降低21.8%和22.9%。

图2 衣藻质量浓度对盐胁迫下小麦幼苗叶片Tr的影响Fig.2 Effect of Chlamydomonas debaryana concentration on Tr of leaves of wheat seedlings under salt stress
2.2.3 Gs 如图3所示,处理后3~12 d,随着处理后时间的推进,T0—T4 处理小麦幼苗叶片Gs 逐渐降低,CK 先降低后升高;随着衣藻质量浓度增加,Tr总体上先升高后降低,处理后3 d、9 d 和10 d 均以T3 处理最高,处理后6 d 以T2 处理最高,总体以T0处理最低;T0—T4 处理Tr 均明显低于CK,T0—T4处理Tr 与CK 间的差距在处理后12 d 最大,且T3 和T4 处理与T0 处理间的差距也在处理后12 d 最大,分别较T0处理提高25.24%和22.33%。

图3 衣藻质量浓度对盐胁迫下小麦幼苗叶片Gs的影响Fig.3 Effect of Chlamydomonas debaryana concentration on Gs of leaves of wheat seedlings under salt stress
2.2.4 Ci 如图4 所示,处理后3~12 d,随着处理后时间的推进,CK 小麦幼苗叶片Ci无明显变化,T0—T1 处理先降低后趋于平稳,T2—T4 处理先降低后升高;T0—T4 处理间Ci 在处理后3 d 和6 d 差异均不明显,在处理后9 d 和12 d 差异变大,尤其是处理后12 d,处理后9 d 和12 d Ci 均表现为T3>T4>T2>T1>T0,在处理后12 d T3处理较T0处理提高62.4%。

图4 衣藻质量浓度对盐胁迫下小麦幼苗叶片Ci的影响Fig.4 Effect of Chlamydomonas debaryana concentration on Ci of leaves of wheat seedlings under salt stress
2.3 衣藻质量浓度对盐胁迫下小麦幼苗叶片叶绿素荧光参数的影响
2.3.1 Fv/Fm 如图5 所示,处理后3~12 d,随着处理后时间的推进,CK 小麦幼苗叶片Fv/Fm 变化不大,维持在0.825~0.850,高于T0—T4 处理;T0—T4处理Fv/Fm 变化均较大,T0 和T2 处理均呈下降趋势,T3和T4处理均呈先下降后增加的趋势,T1处理呈先下降后升高再下降的趋势;T0—T4处理间Fv/Fm差异总体上逐渐增大。处理后9 d 和12 d,Fv/Fm 均表现为CK>T3>T4>T2>T1>T0;处理后12 d,T0 处理与CK间的差距达到最大,较CK降低7.3%。

图5 衣藻质量浓度对盐胁迫下小麦幼苗叶片Fv/Fm的影响Fig.5 Effect of Chlamydomonas debaryana concentration on Fv/Fm of leaves of wheat seedlings under salt stress
2.3.2 qP 如图6所示,处理后3~12 d,随着处理后时间的推进,CK 小麦幼苗叶片qP变化不明显,均远高于T0—T4 处理;T0—T4 处理qP 变化均较大,T0处理呈下降趋势,T1处理呈先下降后趋于平稳的趋势,T2—T4 处理均呈先下降后升高的趋势;T0—T4处理间qP差异总体上逐渐增大。处理后12 d,qP表现为CK>T3>T4>T2>T1>T0,T3 和T4 处理间差异较小,两者与T0处理间的差距均达到最大。

图6 衣藻质量浓度对盐胁迫下小麦幼苗叶片qP的影响Fig.6 Effect of Chlamydomonas debaryana concentration on qP of leaves of wheat seedlings under salt stress
2.3.3 qN 如图7所示,处理后3~12 d,随着处理后时间的推进,CK小麦幼苗叶片qN先下降后升高,以处理后6 d 最低;T0 处理qN 先升高后趋于平稳;T1—T4 处理qN 先升高后降低。在处理后6、9 d,T1—T4 处理qN 均高于CK、低于T0 处理;在处理后12 d,T1—T2 处理均高于CK,T3—T4 处理均低于CK,T1—T4处理均低于T0处理。

图7 衣藻质量浓度对盐胁迫下小麦幼苗叶片qN的影响Fig.7 Effect of Chlamydomonas debaryana concentration on qN of leaves of wheat seedlings under salt stress
2.3.4 Y(Ⅱ) 如图8 所示,处理后3~12 d,随着处理后时间的推进,CK 小麦幼苗叶片Y(Ⅱ)略有波动,高于T0—T4 处理;T0 处理小麦幼苗叶片Y(Ⅱ)一直下降,T1—T4 处理Y(Ⅱ)均先下降后升高最后趋于平缓,以处理后9 d 最高。处理后6、9、12 d,T1—T4 处理Y(Ⅱ)均高于T0 处理,T2—T4 处理Y(Ⅱ)均高于T1 处理,且T2—T4 处理间差异很小。处理后12 d,T3 和T4 处理Y(Ⅱ)分别较T0 处理提高31.35%和31.59%。

图8 衣藻质量浓度对盐胁迫下小麦幼苗叶片Y(Ⅱ)的影响Fig.8 Effect of Chlamydomonas debaryana concentration on Y(Ⅱ)of leaves of wheat seedlings under salt stress
2.3.5 ETR 如图9 所示,处理后3~12 d,随着处理后时间的推进,CK 小麦幼苗叶片ETR 轻微波动,高于T0—T4 处理;而T0 处理在处理后3~9 d 急速下降,并在12 d 时达到最小,在处理后6~12 d,明显低于T1—T4 处理;T1 处理ETR 下降;T2 处理ETR 先下降后缓慢升高;T3—T4 处理ETR 均变化不大,在处理后6~12 d,高于T0—T2处理。
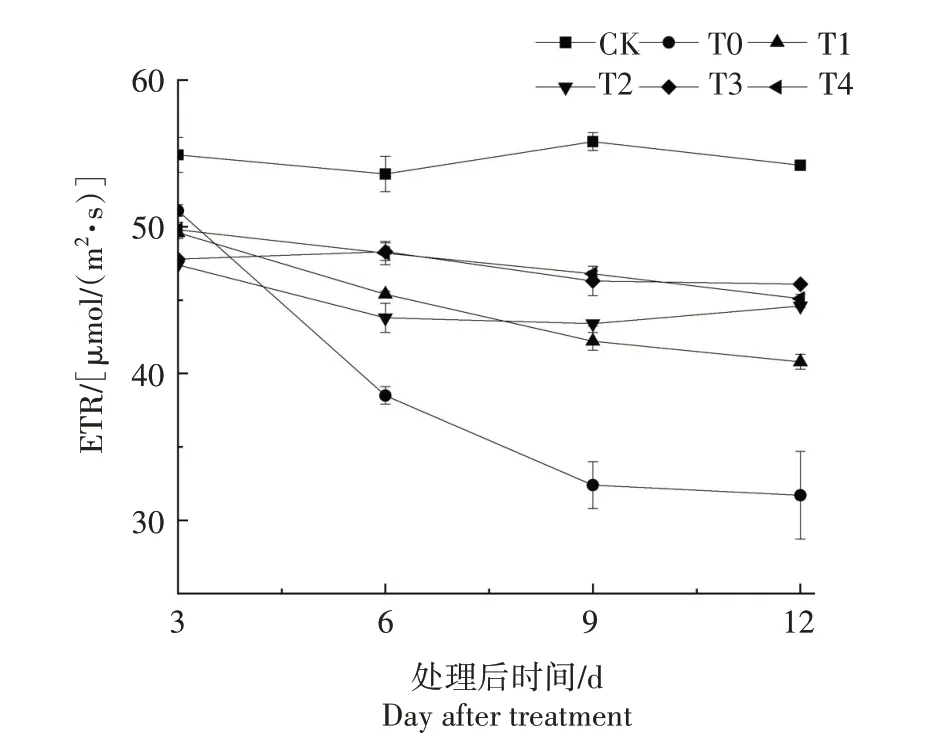
图9 衣藻质量浓度对盐胁迫下小麦幼苗叶片ETR的影响Fig.9 Effect of Chlamydomonas debaryana concentration on ETR of leaves of wheat seedlings under salt stress
3 结论与讨论
光合色素分子参与光合作用的原初反应且是类囊体的重要组成部分,光合色素含量在一定程度上可以表征植物光合作用的强弱,反映植物的健康程度[17]。有研究发现,盐胁迫条件下植物叶片的光合色素含量显著下降[18-19],叶绿素a/b 出现严重失调,从而导致光合作用减弱[20]。本研究发现,在盐胁迫条件下,小麦叶片的叶绿素含量和叶绿素a/b 均明显下降,这与朱玉雪等[21]的研究结果一致。而施加藻液的各处理(T1—T4)小麦叶片的叶绿素a和总叶绿素含量及类胡萝卜素含量均高于T0处理,尤其是T3、T4处理,两者叶绿素a和叶绿素b含量无明显差异。这是因为微藻分泌的胞外多糖等物质可增强植物抗氧化酶活性,降低植物叶绿体内的活性氧含量,从而抑制光合色素分子的降解,提高小麦各种光合色素含量,改善叶绿素a/b,进而提升光合速率[22-23]。
当植物受到盐胁迫时,气体交换参数会发生显著变化,净光合速率下降,造成这种变化的原因是气孔或者非气孔因素,它们的区别在于Pn、Ci、Gs三者的变化趋势。当高等植物的Gs、Ci、Pn 同时上升或下降时,气孔因素占主导作用;当Pn 与Gs、Ci 变化趋势相反时,非气孔因素占主导作用[24]。在本研究中,在处理后3~12 d,各衣藻藻液处理(T1—T4)小麦叶片Pn 总体上均高于T0 处理,说明衣藻能改善盐胁迫下小麦叶片Pn。T0 处理小麦幼苗的Pn、Gs 和Ci 在处理后3~12 d 明显低于CK,说明在盐胁迫条件下,小麦叶片Pn 下降的主导因素是气孔因素。此外,施加衣藻藻液的各处理(T1—T4)在处理后6~12 d,小麦叶片Gs、Ci 均高于T0 处理,说明衣藻影响盐胁迫下小麦叶片Pn 的因素主要是气孔因素。本研究中,T2—T4 处理在处理后6~12 d Pn 明显高于T0处理,以T3处理效果最佳。
原初反应后所固定的光能主要有3 个去向,主要部分流向PSⅡ,另外两部分用于热耗散和以荧光的形式散发出去。叶绿素荧光检测技术正是基于此原理,通过检测植物发出的荧光信号来表征叶片光系统对光能的吸收、传递、耗散和分配的内在特征[25-26]。其中,Fv/Fm 在高等植物中一般维持在0.80~0.85,而在植物受到外部胁迫时会迅速下降;此外,qP、ETR、Y(Ⅱ)也会下降,而qN 因光合机构产生更多过剩光能而增加。因此,Fv/Fm、qP、ETR、Y(Ⅱ)和qN 可以体现小麦受盐胁迫的程度和叶片吸收、转化光能的能力[27]。本研究中,T0 处理小麦叶片Fv/Fm、qP、ETR、Y(Ⅱ)在处理后3~12 d均低于CK;而qN 高于CK。处理后12 d T0 处理Fv/Fm、qP、ETR、Y(Ⅱ)较处理后3 d 均降低,这与其他人对盐胁迫下小麦[28]和桑树[27]的研究结果类似。这些结果说明小麦的光合生理过程对盐胁迫响应明显,盐胁迫导致小麦叶片对光能的吸收和转换能力变弱,PSⅡ反应中心开放程度降低,产生的过剩光能增加。本研究中,施加衣藻藻液处理(T1—T4)Fv/Fm、ETR、Y(Ⅱ)、qP总体上在处理后6、9、12 d均高于T0处理,而qN低于T0处理,这与其他促生长物质或肥料[29-32]对小麦叶绿素荧光参数的影响类似。在处理后9、12 d,T3 处理Fv/Fm、qP、ETR、Y(Ⅱ)和qN 与T4 处理差异不大,而T4 处理衣藻藻液的用量是T3处理的2 倍,从效果和经济性两方面评估,添加1.0 g/L 衣藻藻液为宜。说明衣藻能够有效改善盐胁迫下小麦叶片对光能的吸收和转换能力,维持PSⅡ反应中心的开放程度和PSⅡ的功能,增加对过剩光能的热耗散以提高对光合机构的保护作用,从而提升小麦叶片整体的光合作用能力。

