射波刀联合表皮生长因子受体-酪氨酸激酶抑制剂一线治疗表皮生长因子受体突变晚期非小细胞肺癌患者的临床研究
谢有科,梁广霞,肖慧敏,韦婷婷,唐阳,卢幻真,练祖平#
广西中医药大学附属瑞康医院1肿瘤科,3射波刀治疗中心,南宁 530000
2遵义医科大学第五附属(珠海)医院肿瘤科,广东 珠海 5191000
随着酪氨酸激酶抑制剂(tyrosine kinase inhibitor,TKI)药物的不断问世和临床应用,驱动基因阳性的晚期非小细胞肺癌(non-small cell lung cancer,NSCLC)患者接受一线TKI 治疗已经成为了标准治疗方案。与化疗相比,接受TKI 治疗的患者可获得更长的无进展生存期(progression-free survival,PFS)(10.2~18.9 个月)和总生存期(overall survival,OS)(24.5~38.6 个月),生活质量显著提高[1]。目前在临床研究中对于不同TKI 治疗顺序存在不同观点,无论是一线使用一代TKI 或三代TKI,还是一/二代TKI 序贯三代TKI,都能使患者不同程度获益。但是,TKI 治疗后耐药问题始终困扰着临床医师和患者。尽管在疾病进展后仍有化疗、抗血管生成药物、免疫治疗等多种治疗方法,但其疗效相对低下且有较高的不良反应发生率,严重影响患者生活质量,甚至危及生命。如何发挥TKI 高效低毒的优势,延长患者TKI 暴露时间,是医药工作者关注的热点。体部立体定向放射治疗(stereotactic body radiation therapy,SBRT)于20 世纪90 年代中期开始应用于临床。研究表明,低分割大剂量SBRT 能够克服常规放疗的限制,提高NSCLC 局部控制率[2-4]。在一项小样本回顾性研究中,TKI 治疗后出现寡转移的NSCLC 患者分为SBRT 组和化疗组,分别接受SBRT 和化疗,结果发现,SBRT 组患者中位OS 明显长于化疗组,分别为28.2 个月和14.7 个月,中位PFS 分别为7.0 个月和4.1 个月,≥3级放疗不良反应发生率低于5%[3]。射波刀(cyberknife,CK)是SBRT 的一种新型立体定向放疗设备,采用实时呼吸同步追踪定位系统,定位精确,减少了因呼吸运动造成的计划靶体积的增加,增加了治疗精确度以及放射生物效应,明显提高了肿瘤的局部控制率,减少了正常组织的受照射范围,大大降低了治疗的不良反应[5]。与常规SBRT比较,CK 在等剂量分布、局部控制和减少远处转移等方面具有更大的优势。CK 对早期肺癌的治疗效果与手术切除效果相当[6-8],对晚期肺癌的其他应用包括寡转移灶的局部治疗和一些危险病灶的姑息治疗,也取得较好的疗效[9-11]。CK 以快速有效杀灭肿瘤病灶、极低的3 级以上不良反应发生率、对身体条件要求少等优点,受到越来越多临床医师和患者的认可和接受,成为NSCLC 患者临床治疗的重要手段之一[12]。CK 联合TKI 治疗能否进一步延长TKI 驱动基因阳性晚期NSCLC 患者的PFS 和OS,仍有待研究。本研究探讨CK 联合表皮生长因子受体(epidermal growth factor receptor,EGFR)-TKI 一线治疗EGFR突变晚期NSCLC 的疗效并分析影响因素,现报道如下。
1 资料与方法
1.1 一般资料
收集2012 年1 月至2021 年5 月在广西中医药大学附属瑞康医院接受CK 和TKI 一线治疗的Ⅳ期NSCLC 患者的病历资料。纳入标准:①CK 治疗前经病理学或影像学检查诊断为Ⅳ期NSCLC 患者,经基因检测提示驱动基因阳性,包括EGFR19+、L858R+,或经检测无EGFR热点突变但实际服用TKI 后提示有效,不包括EGFR其他外显子少见突变或复合突变;②初诊为NSCLC,接受一线TKI 规范化治疗前/后行转移灶和/或原发灶CK 治疗(TKI 与CK 治疗间隔时间在3 个月以内),或TKI治疗3 个月以上经CT 或MRI 检查提示转移灶未见明显缩小或局部病灶增大或新发转移病灶,予CK局部治疗转移灶和/或原发灶,后继续原有TKI 药物治疗,如明确原有TKI 耐药可更换为其他临床可选的EGFR-TKI 药物,治疗过程中局部新发转移灶或可疑耐药病灶均可应用CK 局部治疗,直至广泛转移且无CK 局部治疗价值为止;③血常规及心、肝、肾功能无明显异常,无严重基础疾病;④生存期﹥3 个月。排除标准:①严重心肺疾病不能耐受放疗;②妊娠期、哺乳期女性以及精神障碍、依从性差;③死于非肿瘤引起的疾病或意外;④随访时间短于3 个月,或CK 治疗后无法获得后续相关随访信息;⑤在TKI 治疗和CK 治疗期间使用抗血管生成药物、化疗药物、程序性死亡受体1(programmed cell death 1,PDCD1,也称PD-1)/程序性死亡受体配体1(programmed cell death 1 ligand 1,PDCD1LG1,也称PD-L1)抗体药物、直线加速器放疗等抗肿瘤治疗。根据纳入、排除标准,共纳入138 例晚期NSCLC 患者,其中,男性57 例,女性81例;年龄34~81 岁,中位57 岁;腺癌129 例,鳞状细胞癌6 例,腺鳞癌3 例;CK 治疗前卡氏功能状态(Karnofsky performance status,KPS)评分:70~90 分136 例,﹤70 分2 例。本研究经医院伦理委员会批准通过,所有患者均知情同意。
1.2 治疗方法
1.2.1 CK 治疗 所有患者均采用第三代CK X 线立体定向放射外科治疗系统实施放疗。97 例患者采用金标植入加呼吸同步追踪技术(Xsight-Fiducial+Synchrony),在CT 或B 超引导下将2~4 枚纯金颗粒植入肿瘤内部或周边,距离肿瘤≤2.0 cm,第2天行彩超或X 线检查确定金标所在肿瘤部位,1 周后使用真空负压袋固定体位进行CT 或MRI 增强扫描定位,大体肿瘤靶区(gross tumor volume,GTV)为影像资料显示的肿瘤病灶体积,GTV 外放3~5 mm 形成计划靶区(planning target volume,PTV)。颈段以上的病灶以颅骨为标志进行追踪定位,CT 或MRI 扫描前应用热塑记忆面网固定头部;胸椎及以下的病灶采用椎体追踪技术(Xsight-Spine),使用真空垫固定体位;同时勾画出双肺、气管、心脏、脊髓、食管、胃、十二指肠、结肠、脑干、眼球、视神经、垂体等邻近危及器官(organ at risk,OAR),OAR 剂量限制参照美国放射治疗肿瘤协作组(Radiation Therapy Oncology Group,RTOG)0236标准。颅内转移瘤处方剂量为15.0~33.9 Gy,椎体转移瘤为25~36 Gy,其他部位肿瘤病灶为24~60 Gy(中位剂量35 Gy),分割次数为3~5 次,每日1 次。CK 治疗期间予地塞米松每天5~10 mg,预防放射性组织损伤。
1.2.2 TKI 治疗 患者初诊时或首次CK 治疗时给予规范化一代EGFR-TKI 药物(吉非替尼、厄洛替尼、埃克替尼)或三代EGFR-TKI 药物(奥希替尼、阿美替尼),直至疾病不能经CK 治疗缓解而出现肿瘤进展或因不良反应无法耐受而停药。如患者一线治疗使用一代TKI 药物,疾病进展后可序贯三代TKI 药物治疗,治疗期间定期监测血常规、肝肾功能,并进行CT 及MRI 等相关检查。
1.3 观察指标
收集患者临床资料,包括年龄、转移灶类型、原发灶根治情况、CK 与TKI 治疗是否同步、EGFR突变类型、TKI 治疗策略以及CK 疗程数等。转移灶定义:寡转移,转移病灶≤5 个,且通过1 个CK 治疗计划能完全灭活;多发转移,除肺原发灶以外,发生原发灶本侧肺内、对侧肺叶、脑、肝、骨等部位≥2 处转移病灶且无法通过1 个CK 治疗计划完全灭活。放靶同异步定义:放靶同步治疗,CK 局部治疗在TKI 治疗3 个月内进行,或CK 治疗后开始TKI 治疗;放靶异步治疗,TKI 药物治疗后﹥3 个月进行CK 局部治疗。
1.4 随访及评价标准
随访开始时间为TKI 用药第1 天,如果先行CK 治疗后行TKI 治疗,则从CK 治疗结束后第1 天开始计算。随访截止时间为2022 年5 月31 日,随访时间为10~110 个月,中位随访时间55.8 个月。患者CK 治疗结束后6 个月内每1.5~2.0 个月进行影像学复查1 次,包括颅脑MRI、胸腹部增强CT 或MRI;6 个月后每3 个月复查1 次。评估肿瘤治疗效果,记录肿瘤进展时间和死亡时间,计算PFS 和OS。PFS 和OS 均自患者首次服用TKI 药物或CK治疗开始计算,PFS 为至TKI 药物耐药并且发生广泛肿瘤进展,无法使用CK 治疗的时间,使用不同TKI 药物治疗的患者PFS 累积计算;OS 为从治疗开始至随访中任何原因引起患者死亡或随访截止时间。不良反应发生情况根据国家癌症研究所不良事件通用术语标准(National Cancer Institute common terminology criteria for adverse event,NCICTCAE)5.0 版进行评价。
1.5 统计学方法
采用SPSS 25.0 软件进行数据分析,计数资料以例数及率(%)表示,组间比较采用χ2检验;采用Kaplan-Meier 法绘制生存曲线,生存情况的比较采用Log-rank 检验;影响因素采用Cox 比例风险回归模型进行多因素分析;以P﹤0.05 为差异有统计学意义。
2 结果
2.1 临床特征
本研究共纳入138 例行TKI 治疗并先后接受局部CK 治疗的EGFR突变晚期NSCLC 患者,均经病理学和影像学检查确诊为NSCLC 及转移瘤。其中,男性57 例,女性81 例;年龄34~81 岁,中位57岁,≥60 岁64 例,﹤60 岁74 例;腺癌129 例,鳞状细胞癌6 例,腺鳞癌3 例;有吸烟史33 例;寡转移30例,多发转移108 例;根治术后仅发生1 个器官肿瘤转移30 例,2 个器官肿瘤转移33 例,≥3 个器官肿瘤转移75 例,转移部位包括对侧肺、胸膜、脑、骨、淋巴结、肝、肾上腺等;基因检测:EGFR19+ 93例,EGFR21+ 31 例,阴性(盲服TKI 药物有效)14例;EGFR-TKI 药物治疗:口服一代药物55 例,口服三代药物12 例,口服一代药物进展后序贯三代药物治疗71 例;肺癌根治术后复发33 例;仅接受肺部原发灶放疗28 例,转移灶放疗92 例,全身多发病灶放疗18 例;接受≤2 个CK 治疗疗程125 例,接受≥3 个CK 治疗疗程13 例。
2.2 PFS 和OS 分析
138 例患者中位随访时间为55.8 个月,中位PFS、中位OS 分别为26 个月和47 个月,12、24、36个月无进展生存率分别为77.5%、55.1%和36.0%,12、24、36、60 个月总生存率分别为98.1%、82.0%、68.3%和28.3%。(图1)
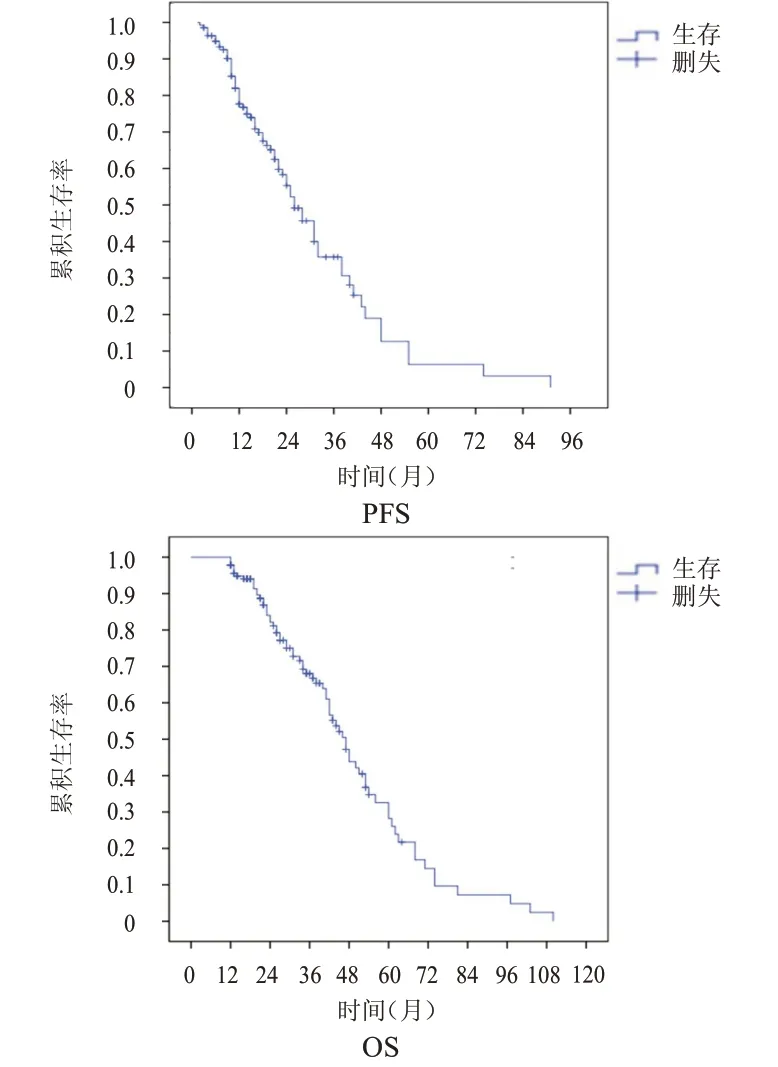
图1 CK联合EGFR-TKI治疗晚期NSCLC患者的PFS曲线和OS曲线
2.3 预后影响因素的单因素分析
2.3.1 放靶同步/异步治疗 放靶同步治疗、异步治疗患者中位PFS 分别为28 个月和26 个月(χ2=0.065,P=0.799),中位OS 分别为38 个月和53 个月(χ2=6.766,P=0.026)。(图2)
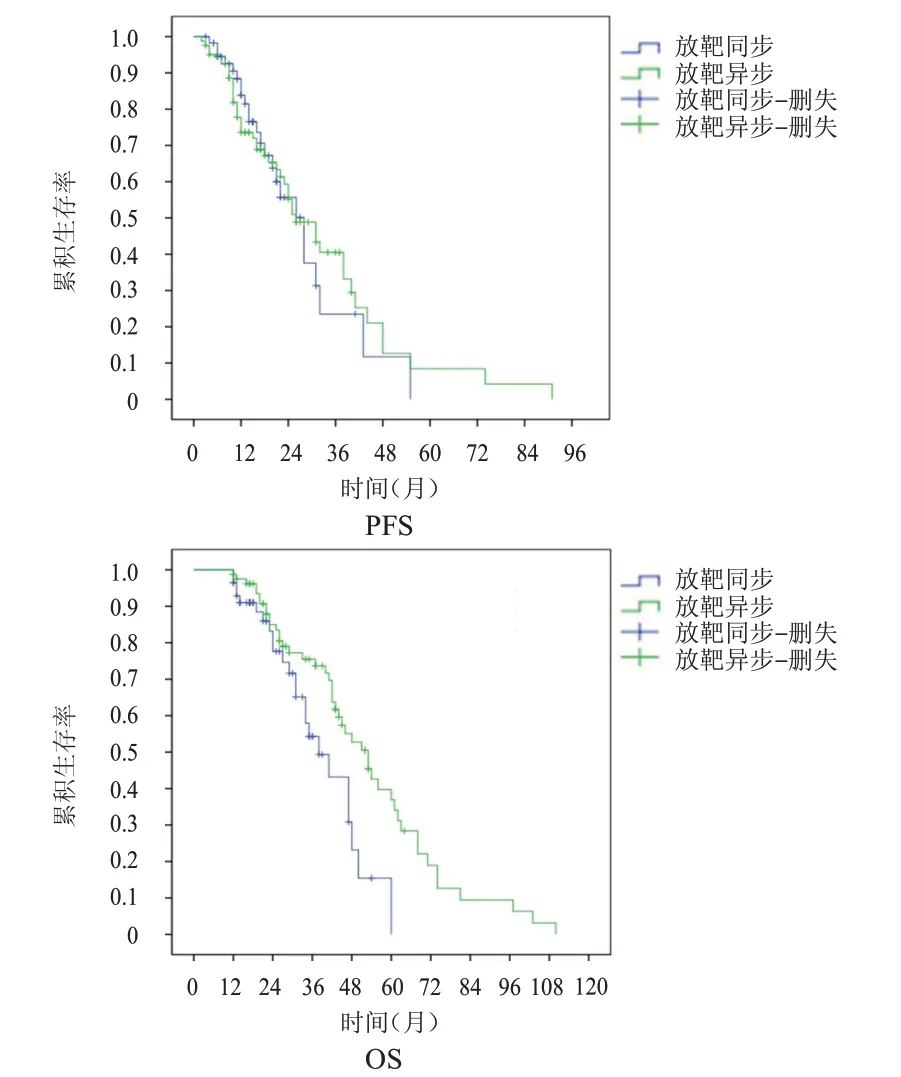
图2 放靶同步治疗(n=57)与放靶异步治疗(n=81)晚期NSCLC患者的PFS曲线和OS曲线
2.3.2 转移灶类型 寡转移和多发转移患者中位PFS 分别为32 个月和24 个月(χ2=3.538,P=0.060),中位OS 分别为48 个月和44 个月(χ2=4.259,P=0.039)。(图3)
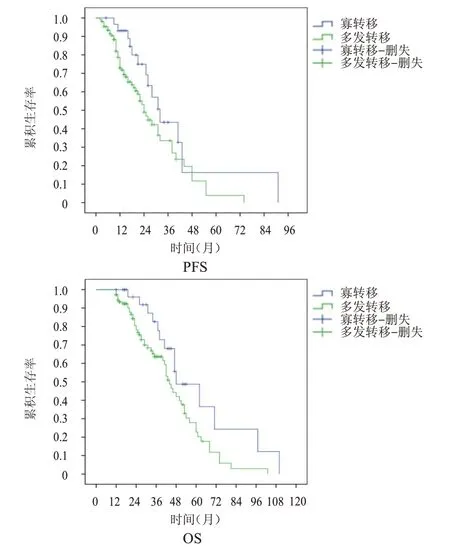
图3 寡转移(n=30)与多发转移(n=108)晚期NSCLC患者的PFS曲线和OS曲线
2.3.3 首次CK 治疗靶区类型 按首次CK 治疗靶区类型分为原发灶、转移灶、全部病灶,原发灶、转移灶、全部病灶CK 治疗患者中位PFS 分别为31、26、26 个月(P=0.880),中位OS 分别为42、46、47 个月(P=0.642)。(图4)
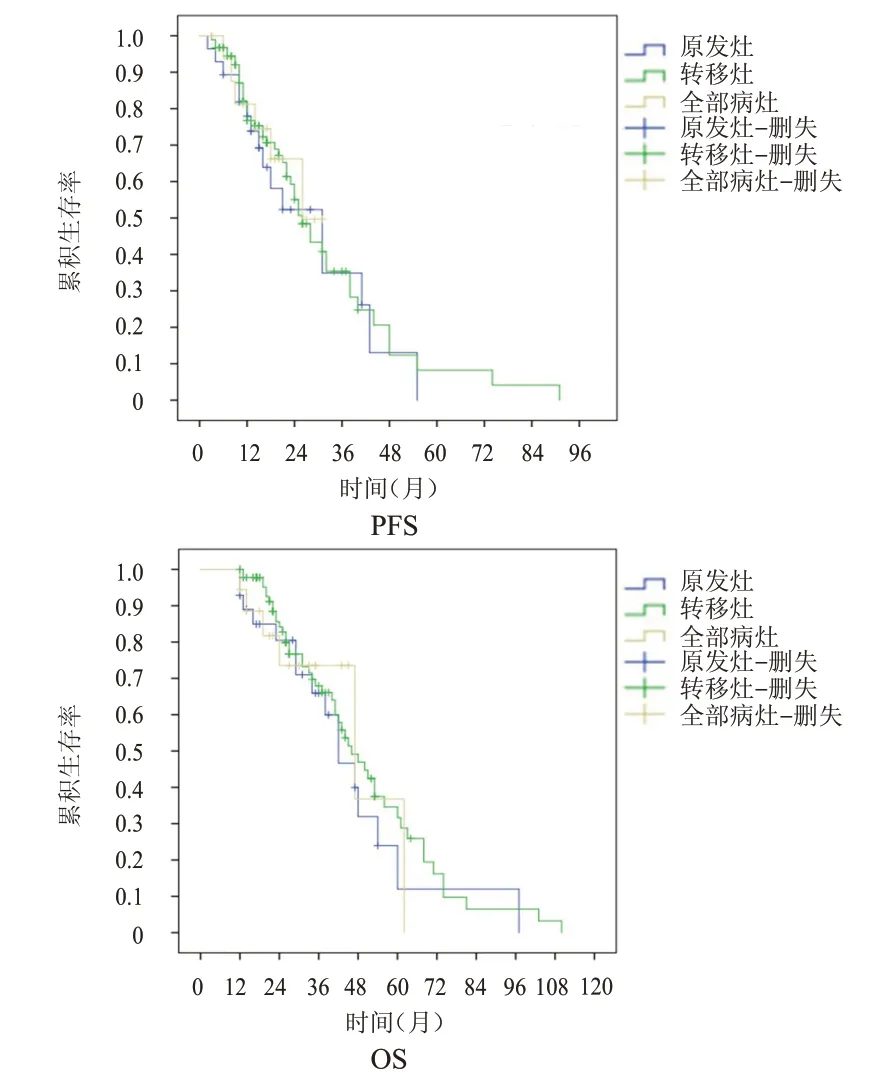
图4 原发灶(n=28)、转移灶(n=92)和全部病灶(n=18)CK治疗的晚期NSCLC患者的PFS曲线和OS曲线
2.3.4 TKI 治疗策略 一代、三代、一代序贯三代TKI 治疗患者的中位PFS 分别为24、28、28 个月(P=0.943),中位OS 分别为47、46、47 个月(P=0.716)。(图5)
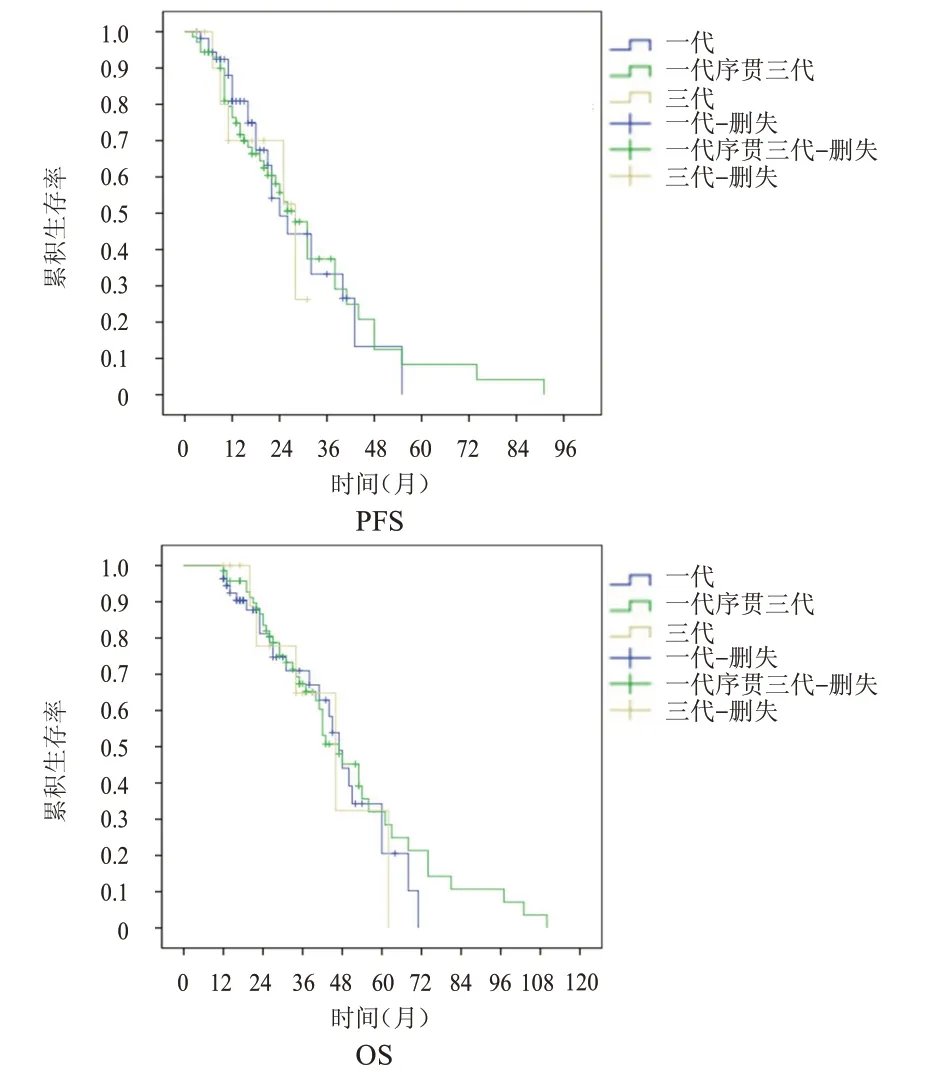
图5 一代(n=55)、三代(n=12)和一代序贯三代(n=71)TKI治疗的晚期NSCLC患者的PFS曲线和OS曲线
2.3.5 CK 疗程数 ≤2 个CK 治疗疗程、≥3 个CK治疗疗程患者的中位PFS 分别为28 个月和26 个月(P=0.946),中位OS 分别为47 个月和46 个月(P=0.807)。(图6)
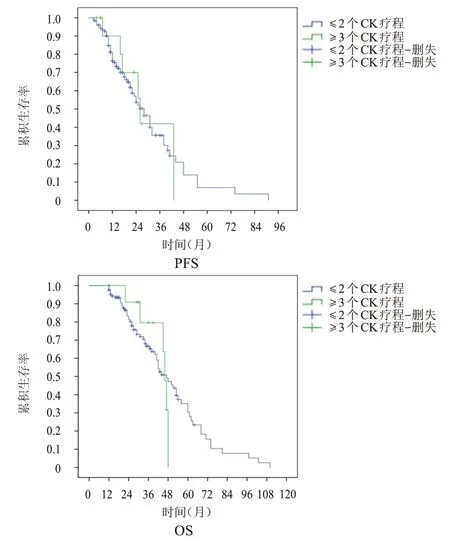
图6 ≤2个CK疗程(n=125)、≥3个CK疗程(n=13)晚期NSCLC患者的PFS曲线和OS曲线
2.3.6 原发灶根治情况 已根治和未根治患者的中位PFS 分别为31 个月和24 个月(P=0.702),中位OS 分别为47 个月和43 个月(P=0.585)。(图7)
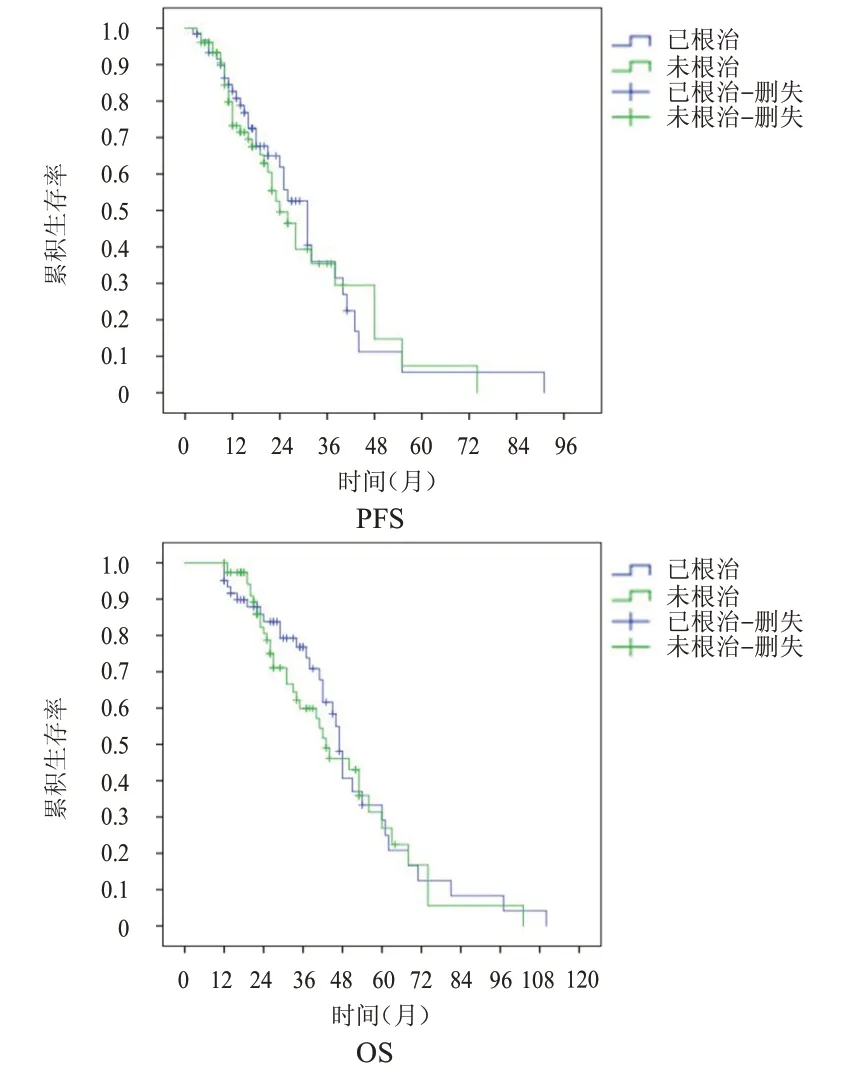
图7 已根治(n=61)和未根治(n=77)晚期NSCLC患者的PFS曲线和OS曲线
2.3.7 基因突变类型EGFR19+、EGFR21+和阴性患者的中位PFS分别为26、31 和28 个 月(P=0.943),中位OS 分别为47、53 和42 个 月(P=0.519)。(图8)
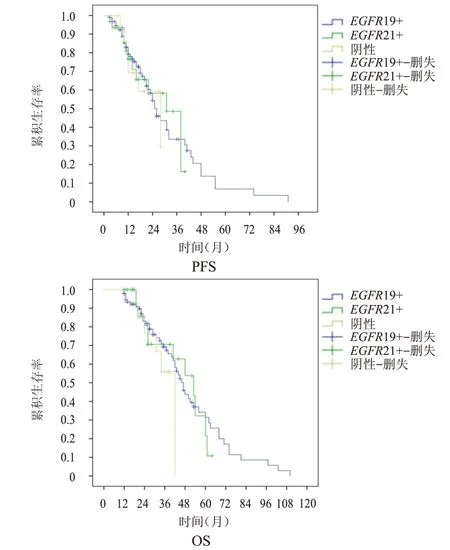
图8 EGFR19+(n=93)、EGFR21+(n=31)和阴性(n=14)晚期NSCLC患者的PFS曲线和OS曲线
2.4 CK 联合TKI 一线治疗Ⅳ期NSCLC 患者预后影响因素的多因素分析
将放靶同异步、原发灶根治情况、转移灶类型、TKI 治疗策略、年龄、首次CK 治疗靶区类型等因素作为自变量,OS 作为因变量,进行Cox 多因素分析。结果提示,寡转移、年龄≥60 岁、放靶异步治疗均是CK 联合TKI 一线治疗Ⅳ期NSCLC 患者OS的独立保护因素(P﹤0.05)。(表1)
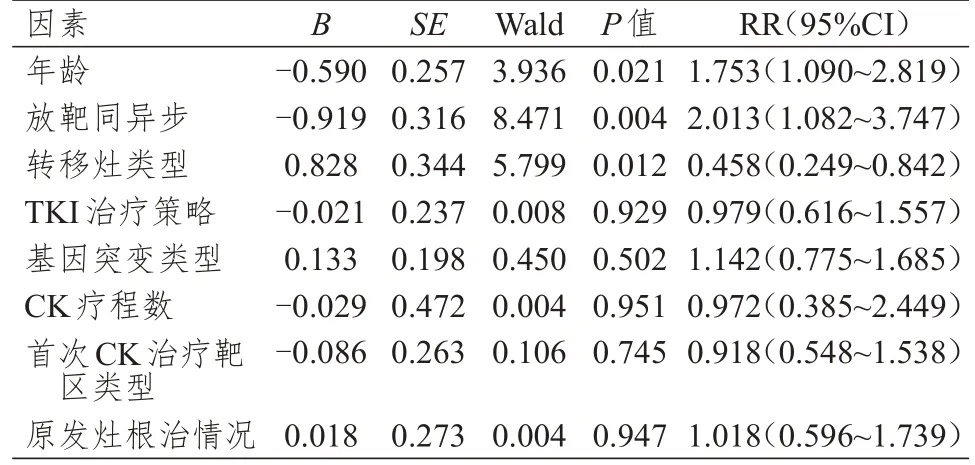
表1 CK 联合TKI 一线治疗Ⅳ期NSCLC 患者预后影响因素的多因素分析
2.5 不良反应
TKI 治疗期间患者常见不良反应包括乏力、恶心、呕吐、口腔溃疡、食欲减退、腹泻、皮疹及肝功能异常。CK 治疗后3 个月内的急性放射不良反应主要为乏力、咳嗽、食欲减退、放射性皮炎及呼吸困难;治疗后3 个月放射不良反应包括放射性肺炎、放射性皮炎、疼痛、肋骨骨折、放射性食管炎及放射性心脏损伤等。患者各不良反应:食欲减退35 例(25.4%)、呕吐30 例(21.7%)、恶心24 例(17.4%)、放射性肺炎(≤Ⅱ级)22 例(15.9%)、皮疹15 例(10.9%)、腹泻10 例(7.2%)、丙氨酸转氨酶(alanine aminotransferase,ALT)增高10 例(7.2%)、口腔溃疡8 例(5.8%)、天冬氨酸转氨酶(aspartate aminotransferase,AST)增高7 例(5.1%)。没有患者因不良反应而停止TKI 药物治疗,未见发生≥Ⅲ级放射性肺炎、骨髓抑制、胸壁疼痛、肋骨骨折、放射性食管炎及放射性心脏损伤等不良反应。15 例(10.9%)金标植入患者发生轻微气胸,经对症处理后好转。
3 讨论
IPASS 研究是一项评估吉非替尼对比联合化疗一线治疗晚期NSCLC 患者的Ⅲ期临床研究,在EGFR突变患者亚组分析中发现,吉非替尼组患者客观缓解率(objective response rate,ORR)为71%,中位PFS 约为10.0 个月,而所有患者ORR 仅为32%,中位PFS 约为5.8 个月[13]。其他一代或二代EGRF-TKI 药物治疗患者的PFS 也只有9.8~14.0 个月,ORR 为63%~71%[14]。即使效果较为出色的三代EGFR-TKI 药物奥希替尼,其PFS 也只有18.9 个月,ORR 为80%[15]。在OS 获益方面,至今只有FLAULA 研究证实奥希替尼有效延长OS(38.6 个月),其他TKI 均未发现能改善患者OS[15]。在TKI药物联合其他药物的临床研究中,目前仍未发现PFS 获益转化OS 获益[16-18]。Landre 等[19]在 一 项 荟萃分析研究中探讨抗血管生成抑制剂联合厄洛替尼对比单用厄洛替尼一线治疗EGFR突变的晚期NSCLC 患者,结果发现,联合用药有利于PFS 获益,减缓厄洛替尼耐药的发生,但联合用药不能改善患者OS。Nishio 等[20]在雷莫芦单抗联合吉非替尼治疗未经治疗的EGFR突变转移性NSCLC 患者的探索性研究中也发现联合治疗能改善患者PFS,但OS 数据尚未成熟。局部SBRT 治疗已经成为公认的治疗少转移性NSCLC 患者的有效方法,SBRT联合TKI 治疗可能使患者获益。研究证实,EGFR突变的局部晚期NSCLC 患者应用吉非替尼+同期胸部放疗(64 Gy/32 f)有改善PFS 和OS 的作用,分别为18.6 个月和61.1 个月,2 年无进展生存率达到29.6%[21]。一项回顾性研究发现,EGFR突变的少转移(转移灶≤5 个,转移器官≤2 个)且无脑转移的NSCLC 寡转移患者一线分别予以单独TKI 治疗与TKI 联合CK 治疗,患者中位PFS 分别为12.5、20.2 个月(P﹤0.01),中位OS 分别为17.4、25.5 个月(P﹤0.01)。TKI 联合CK 治疗患者未见5 级不良事件,症状性3~4 级肺炎发生率为6%[22]。本研究纳入的CK 联合TKI 一线治疗晚期NSCLC 多发转移患者比例达78.2%,138 例患者平均随访时间为55.8 个月,中位PFS、中位OS 分别为26 个月和47 个月,12、24、36 个月无进展生存率分别为77.5%、55.1%和36.0%,12、24、36、60 个月总生存率分别为98.1%、82.0%、68.3%和28.3%。Cox 回归分析显示,寡转移、年龄≥60 岁、放靶异步治疗均是CK 联合TKI 一线治疗Ⅳ期NSCLC 患者OS 的独立保护因素。与既往文献数据对比,本研究提示,CK联合TKI 一线治疗后患者中位PFS 增加超过4 个月,优于文献报道;尽管本研究中中位OS 仅为47个月,低于文献报道的60 个月[3],但本研究入组患者分期较晚,且多合并2 个以上器官或系统转移,最终60 个月总生存率仍达到28.3%,明显高于单纯EGFR-TKI 治疗数据[15]。本研究中,不良反应发生率低,未见发生≥Ⅲ级放射不良反应。本团队推测PFS 延长的原因可能与CK 治疗可在患者同一部位或不同部位病灶反复治疗有关;而OS 数据下降则与纳入患者的分期较高有关;联合治疗的不良反应远低于SBRT,安全性优于SBRT。因此,CK 联合TKI 一线治疗晚期NSCLC 患者是延长TKI 治疗时间的有效方法。
对于CK 联合TKI 一线治疗晚期NSCLC 患者过程中CK 介入时机,即CK 与TKI 同步治疗,或TKI 治疗后有耐药倾向时行CK 治疗,目前仍存在争议。既往研究提示,TKI 治疗与同期胸部放疗能改善局部晚期NSCLC 患者PFS 和OS,有寡转移的患者同期治疗也能达到相同效果[20]。本研究发现,CK 与TKI 同步治疗与异步治疗(﹥3 个月)患者的中位PFS 分别为28 个月和26 个月(P=0.799),中位OS 分别为38 个月和53 个月(P=0.026),提示TKI治疗后序贯CK 治疗(异步治疗)优于TKI 与CK 同步治疗。本研究团队认为,晚期NSCLC 患者初始经过TKI 治疗后身体条件改善,可能促进肿瘤抗原识别,提高抗肿瘤免疫应答水平,从而改善患者的预后,但仍有待进一步研究证实。
另外,既往文献证实,对比原发灶不根治性放疗患者,NSCLC 合并寡转移灶患者局部SBRT 治疗原发灶和转移灶能带来更好的PFS 和OS 获益[3]。本研究表明,对于多发转移的患者,肺部原发灶是否经根治术或CK 局部根治性治疗,均不能影响PFS 和OS。寡转移患者对比多发转移患者,可能获得更好的OS 获益,但PFS 未能获益,结果与既往文献稍有不同,不除外与样本量偏少有关。
本研究是一个单中心、回顾性的临床研究,存在不可避免的选择性偏倚,例如样本量偏小,未能纳入EGFR少见突变或复合性突变,存在一定的局限性。
综上所述,与单纯EGFR-TKI 治疗比较,CK 联合TKI 一线治疗晚期EGFR突变NSCLC 患者更能延长患者的PFS 和OS,且临床安全性好。寡转移、年龄≥60 岁、放靶异步治疗均是CK 联合TKI 一线治疗Ⅳ期NSCLC 患者OS 的独立保护因素。患者接受EGFR-TKI 治疗后3 个月以上联合CK 局部治疗原发灶或消退缓慢的病灶,能显著延长患者生存期。TKI 药物使用顺序、基因突变类型、原发灶 根治与否、CK 治疗疗程数均不影响患者预后。

