前列宁通过调控前列腺MMP-2、TIMP-2降解层粘连蛋白治疗良性前列腺增生的机制研究
周建衡,赵锦燕,王雪皎,李 斐,林久茂*
(1.福建中医药大学中西医结合学院,福建 福州 350122;2.福建中医药大学中西医结合研究院,福建 福州 350122)
良性前列腺增生(benign prostatic hyperplasia,BPH)不可避免发病于中老年男性,尿路梗阻是其较为常见症状,而且随年龄增加发病率逐渐增加[1]。调查显示,该病发病率规律是每增加十岁BPH 发病率就增加10%,男性从40 岁开始,BPH 患病率随着年龄而逐渐升高,80 岁时患病率将达到80%以上[2]。BPH 的病因及病理生理机制迄今仍不完全清楚,目前认为间质-上皮的相互作用与BPH 发病相关性已得到医学界普遍认可[3-4],细胞外基质(extracellular matrix,ECM)在间质-上皮相互作用中发挥至关重要作用,层粘连蛋白(laminin,LN)是ECM 重要成分之一,与BPH 有密切联系[5-7]。前期研究表明,前列宁(Qianliening,QLN)对BPH 具有明显治疗作用[8]。本研究旨在通过体内外实验观察QLN 对前列腺组织、BPH-1 细胞中LN 及LN 调控因子表达的影响,探讨QLN 对BPH 的治疗机制。
1 材 料
1.1 实验动物及细胞 雄性SPF 级6~7 周龄健康雄性SD 大鼠50 只,体质量(150±20 g),购自上海斯莱克实验动物有限责任公司,批号:0017446,实验动物许可证号:SCXK(沪2017-0005)。大鼠饲养于福建中医药大学实验动物中心,饲养室温度为20~26 ℃,相对湿度40%~70%,灯照周期为12 h,7:00~19:00 灯照,19:00~7:00 黑暗。本实验获福建中医药大学动物伦理委员会批准(审批号:FJTCM IACUC 2022178)。人前列腺增生细胞-1(humanbeing prostatic hyperplasia cell-1,BPH-1)由深圳Otwo Biotech公司提供,批号:HTX2051。
1.2 实验药物与主要试剂 QLN 由酒大黄15 g,水蛭3 g,黄芪12 g,牛膝9 g,菟丝子6 g 组成,该方由福建中医药大学药学院研制并已申请发明专利;丙酸睾丸酮注射液(上海通用药业股份有限公司,规格:25 mg/mL,批号:H31020524);细胞培养双抗100×(上海汉恒生物科技有限公司,批号:HB-PSS-100);细胞裂解液(批号:MB9900-Apr-12H)、细胞增殖及毒性试剂盒(批号:C0042)均购自大连美仑生物技术有限公司;鼠MMP2-抗体(批号:66366-1-lg)、兔LN(批号:12858-1-AP)均购自美国Proteintech公司;兔TIMP-2 抗体(美国Immunoway 公司,批号:YT4659)。
1.3 主要仪器 ChemiDoc XRS 凝胶成像系统(美国Bio-Rad 公司);Countstar 细胞自动计数仪(上海睿钰生物科技有限公司);PowerPAC™ HC 高电流电泳仪(美国Bio-Rad 公司);RM2235 石蜡切片机(德国徕卡公司);常规倒置显微镜(德国徕卡公司)。
2 方 法
2.1 QLN 药液制备 动物灌胃用QLN 由福建中医大学药学院制备;细胞用QLN 购自江苏天江药业颗粒剂,以200 mg QLN 粉末,加入1 mL 蒸馏水溶解后高压、超声助溶,配制成浓度为200 mg/mL 的母液,用完全培养基DMEM 倍比稀释后配置成3 种不同浓度(0.25、0.5、1.0 mg/mL)的工作液,0.22 μm 过滤器过滤后加入细胞中。
2.2 BPH 大鼠模型制备 依据前期基础及查阅文献成功制备模型[9-10],SPF 级雄性SD 大鼠50 只,6~7 周龄,适应性喂养1 周,除空白组外,其余各组腹腔注射氯胺酮(100 mg/kg)麻醉,无菌手术,摘除双侧睾丸,术后恢复1 周,模型组及低、中、高剂量组皮下注射丙酸睾酮(5 mg/kg),连续28 d。
2.3 分组及干预 采用数字随机法将大鼠分为空白组、模型组和低、中、高剂量组,每组10只。模型组及低、中、高剂量组去势1 周后注射造模同时,开始灌胃给药,空白对照组和模型组灌服生理盐水,各剂量组采用灌胃QLN。剂量分别为:空白组、模型组生理盐水10 mL/(kg·d),低剂量组3 g/(kg·d)、中剂量组6 g/(kg·d)、高剂量组12 g/(kg·d);即分别相当于临床用药量的3、6、12 倍,以上均采用灌胃给药,1 次/d,期间每周称体质量1 次并按体质量调整给药剂量,共28 d。
2.4 标本采集 末次给药后禁食12 h,大鼠体质量,手术分离出完整的前列腺组织,测量前列腺湿重和体积(容积法);选取相同部位前列腺组织一块,10%甲醛固定作免疫组化用。
2.5 指标检测
2.5.1 大鼠前列腺湿重、体积和前列腺指数 测量5 组大鼠的前列腺的湿重、体积并计算前列腺指数(PI),PI 的计算公式如下:
PI=前列腺湿重(g)/体质量(g)
2.5.2 免疫组化法测5 组大鼠前列腺组织LN 的蛋白表达水平 分别取5 组大鼠前列腺组织侧叶0.5 cm×0.5 cm×0.1 cm 组织块,PBS 清洗,10%甲醛进行固定,包埋存档,切片。石蜡切片分作LN 免疫组化染色,一抗(比例1∶1 000),二抗(比例1∶1 000),PBS 洗,标记后PBS 洗,DAB 显色,严格按说明书操作。
2.5.3 QLN 干预BPH-1 细胞培养及形态学观察用0.25%胰酶消化并收集细胞,之后每孔加入3 mL含低(0.25 mg/mL)、中(0.5 mg/mL)、高(1.0 mg/mL)不同浓度QLN 药液的完全培养基及等量完全培养基,分别在干预24、48 h 后,倒置显微镜下观察细胞的形态、数量变化并拍照。
2.5.4 CCK-8 法检测BPH-1 细胞存活率 用0.25%胰酶消化并收集细胞,分别在12、24 h 时避光加入10 μL CCK-8 溶液,1.5~2 h 后在酶标仪(570 nm 波长下、持续震荡15 s)检测其吸光值。细胞存活率的计算公式如下:
细胞存活率=用药组A值/空白组(对照组)A值×100%)
2.5.5 Western blot 检测BPH-1 细胞MMP-2、TIMP-2、LN 蛋白表达量 用0.25%胰酶消化收集离心后,总蛋白浓度测定与定量,电泳,转膜,封闭,于化学发光成像系统ChemiDoc XRS+下成像。用Image J软件对蛋白灰度值进行数据分析,得出MMP-2、TIMP-2、LN 蛋白相对表达量。
2.6 统计学方法 所得数据采用Prism GraphPad 8.0.1 作图,并采用SPSS 23.0 软件进行统计分析。数据均采用正态检验及方差齐性检验,计量资料服从正态分布以(±s)表示,多组间比较采用单因素方差分析。P<0.05 表示差异具有统计学意义。
3 结 果
3.1 5组大鼠前列腺湿重、体积和PI比较 见表1。
表1 5 组大鼠前列腺湿重、体积和PI 比较(±s)
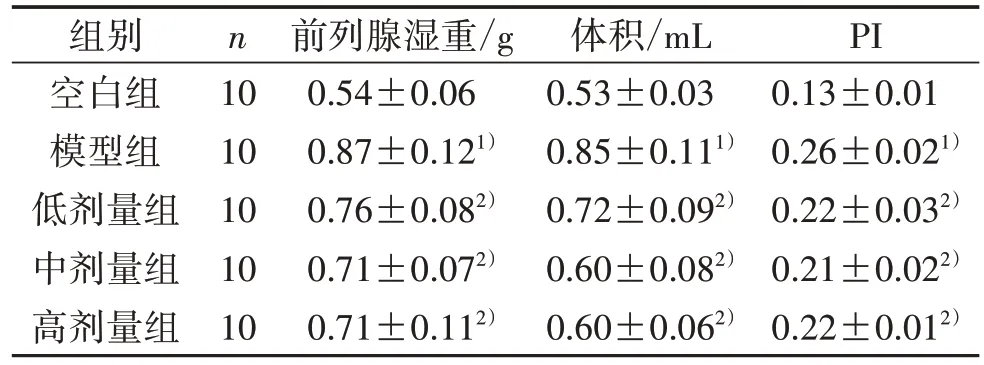
表1 5 组大鼠前列腺湿重、体积和PI 比较(±s)
注:与空白组比较,1) P<0.01;与模型组比较,2) P<0.05。
组别空白组模型组低剂量组中剂量组高剂量组PI 0.13±0.01 0.26±0.021)0.22±0.032)0.21±0.022)0.22±0.012)n 10 10 10 10 10前列腺湿重/g 0.54±0.06 0.87±0.121)0.76±0.082)0.71±0.072)0.71±0.112)体积/mL 0.53±0.03 0.85±0.111)0.72±0.092)0.60±0.082)0.60±0.062)
3.2 5组大鼠前列腺组织中LN蛋白表达量比较 见图1。
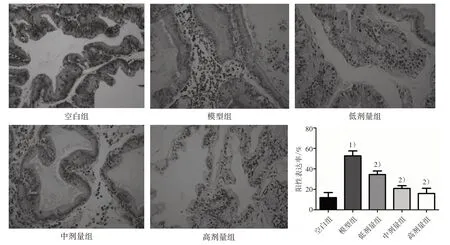
图1 5 组大鼠前列腺组织中LN 蛋白表达(×400)及阳性表达率比较
3.3 4组BPH-1 细胞形态及经QLN 干预后活力变化 倒置显微镜下观察,空白组BPH-1 细胞形态正常,呈菱形,细胞边界菱角清晰,细胞贴壁牢固,细胞汇合度紧密;经QLN 干预后,随着QLN 浓度的增加,可观察到细胞形态完整性逐渐改变,细胞呈悬浮状态,细胞汇合度降低,出现细胞脱落,悬浮细胞逐渐增加。见图2。CCK-8 检测显示,与空白组比较,低、中、高剂量组细胞活力在24 h 及48 h 均显著下降(P<0.05),且QLN 药物浓度越高而细胞活力越低,其中以中、高剂量组最为显著,但QLN 干预24 h 与干预48 h 比较差异无统计学意义(P>0.05),不存在时间依赖关系。见图3。
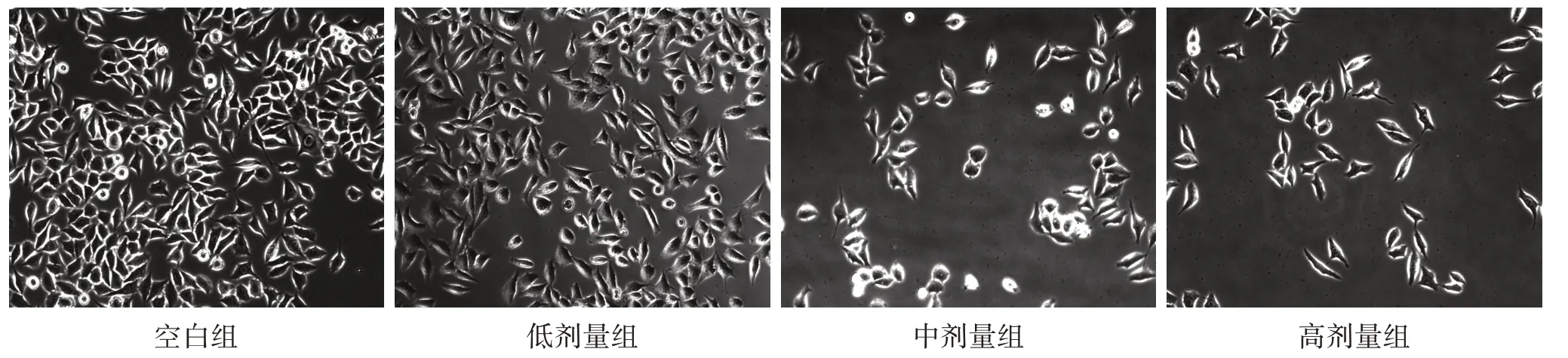
图2 4 组BPH-1 细胞形态比较(×100)
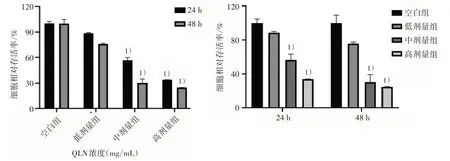
图3 4 组BPH-1 细胞24、48 h 细胞活力变化(5 000 个细胞/孔)
3.4 4组BPH-1 细胞MMP-2、TIMP-2、LN 蛋白表达量比较 见图4。
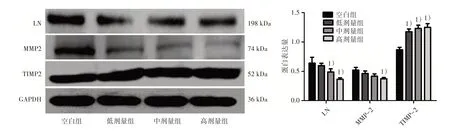
图4 4 组BPH-1 细胞MMP-2、TIMP-2、LN 蛋白表达量比较
4 讨 论
BPH 在中医学中归属为“癃闭”“精癃”等范畴,其病因病机迄今仍未诠释。现代医学研究显示,ECM 学说一直是BPH 发病的重要机制[11],ECM主要成分包括胶原蛋白、LN、纤维连接蛋白(FN)等,其中,collagens、elastin、LN 等与BPH 密切相关[12]。有研究显示,前列腺细胞的增殖与ECM 增加密切相关,ECM 与各种生长因子及雄-雌激素相互作用发生BPH,前列腺组织中活性肽类物质也可以由ECM 调节,刺激细胞产生不同的ECM[13-17]。ECM 受多种酶类降解,其中MMPS是最重要的一类,MMP-2属于MMPS 家族中的明胶酶,可降解collagenⅣ、FN和LN 等,MMP-2 在降解上述ECM 过程中受到其抑制剂TIMP-2 调控,MMP-2、TIMP-2 达到一定比值时,能发挥最佳调控效果[18-19]。
BPH 的基本病机为热毒瘀阻、气血失调、痹阻络脉、日久肾虚而致。针对此病机,课题组提出了祛瘀软坚、补肾益气的治法,研制成前列宁方。课题组研究发现,QLN 对BPH-1 细胞增殖有抑制作用,可诱导细胞凋亡,并对多种细胞因子有调节作用,对BPH 治疗具有明显效果[20-23],同时可以调节部分ECM 成分及MMP-2 作用[10]。在体内实验中,动物模型组大鼠前列腺指数、前列腺体积明显高于空白组,各剂量组中大鼠前列腺指数、前列腺体积较模型组不同程度减少,表明QLN 具有治疗大鼠BPH 作用;免疫组化检测大鼠前列腺组织LN 蛋白表达水平明显减少,表明LN 蛋白减少与治疗BPH具有相关性,与文献报道一致[17-19]。体外实验中,QLN 直接购自江苏天江药业成分颗粒剂,未采取含药血清给药而是蒸馏水溶解后高压、超声助溶方法,在前期研究中已取得成熟稳定给药方法,结果稳定可靠[23,10]。在细胞实验中,经QLN 干预的低、中、高剂量组中细胞存活率呈现不同程度下降,CCK-8 检测显示QLN 作用24 h 和48 h 后各组细胞存活率出现不同程度下降,与空白组比较,QLN 药物浓度越高细胞存活率越低,其中以0.5、1 mg/mL最为显著;Western blot 检测发现,QLN 干预细胞培养,MMP-2、LN 蛋白表达量明显降低,TIMP-2 蛋白表达量升高,表明在细胞培养中QLN 能够有效抑制MMP-2、LN 蛋白表达量并且具有增强TIMP-2 蛋白表达量作用,与体内实验中QLN 降低BPH 大鼠模型前列腺组织LN 表达水平一致,同时体外实验中QLN 降低MMP-2 蛋白表达量,提高TIMP-2 蛋白表达量升高,与文献报道ECM 调控与MMP-2、TIMP-2密切相关,并非单纯受MMP-2影响。
综上所述,本研究证实了QLN 调控前列腺组织细胞MMP-2、TIMP-2 降解LN 从而对BPH 起 到治疗作用,具有一定临床指导意义,后期将围绕QLN 可能通过调控微小基因片段降解ECM 治疗BPH 展开进一步研究,以期深入阐明QLN 治疗BPH 机制。

