3种苯二氮类药物对幽门螺杆菌的抗菌作用及其机制
陈旭 张冬 唐丽华 仲莉君 张娟 李玉兰
摘要:目的 探究苯二氮類药物对幽门螺杆菌(Hp)的抗菌作用及其机制分析。方法 以Hp国际标准菌株ATCC43504作为实验菌株,苯二氮类药物地西泮、咪达唑仑、瑞马唑仑为实验药物,阿莫西林、克拉霉素为阳性对照,注射用水为阴性对照,采用药敏纸片法测量每种药物的抑菌圈。采用抗菌效能检测药物对Hp的最低抑菌浓度(MIC)及最低杀菌浓度(MBC)。配置Hp菌悬液,分别用地西泮(地西泮组)、咪达唑仑(咪达唑仑组)处理,不加药的菌悬液作为对照组,使用全自动生化分析仪检测各组药物干预前(T0)及干预后1(T1)、2(T2)、3(T3)、4(T4)、5(T5)、6(T6)、7 h(T7)菌悬液中K+浓度。提取Hp脲酶,分别采用1/2 MIC地西泮、MIC地西泮、2 MIC地西泮、1/2 MIC咪达唑仑、MIC咪达唑仑、2 MIC咪达唑仑、1 mg/ml乙酰氧肟酸、注射用水处理,酚红显色法检测各组pH值从6.8升至7.7所需的时间。结果 地西泮、咪达唑仑、瑞马唑仑、阿莫西林、克拉霉素、注射用水对Hp的抑菌圈分别为52.3、42.7、6.0、72.3、60.8、6.0 mm。地西泮、咪达唑仑对Hp的MIC分别为12.5、25.0 μg/ml,MBC分别为25、50 μg/ml。与T0比较,T1~T7地西泮组、咪达唑仑组和对照组的K+浓度均明显升高(P均<0.01);T1~T4地西泮组和咪达唑仑组的K+浓度明显高于对照组(P均<0.01)。1/2 MIC地西泮组、MIC地西泮组、2 MIC地西泮组、1/2 MIC咪达唑仑组、MIC咪达唑仑组、2 MIC咪达唑仑组对脲酶活性的抑制时间分别为(39.86±5.11)、(36.52±6.65)、(38.58±4.83)、(39.25±6.19)、(36.36±4.61)、(35.81±6.18)min,明显短于乙酰氧肟酸组(P均<0.01),但与注射用水组差异无统计学意义(P均>0.05)。结论 苯二氮类药物地西泮、咪达唑仑对Hp有良好的抗菌作用,其抗菌机制可能与Hp细胞裂解有关,与脲酶抑制无关。
关键词:幽门螺杆菌;苯二氮类;抗菌
中图分类号: R517.9;R971+.3 文献标志码: A 文章编号:1000-503X(2023)05-0783-06
DOI:10.3881/j.issn.1000-503X.15651
Inhibitory Effects and Mechanisms of Three Benzodiazepines on Helicobacter pylori
CHEN Xu1,ZHANG Dong2,TANG Lihua3,ZHONG Lijun3,ZHANG Juan3,LI Yulan4
1The First School of Clinical Medicine,Lanzhou University,Lanzhou 730000,China
2Department of Gastroenterology,3Department of Microbiology,Jiuquan City Peoples Hospital,Jiuquan,Gansu 735000,China
4Department of Anesthesiology,The First Hospital of Lanzhou University,Lanzhou 730000,China
Corresponding author:LI Yulan Tel:13519625065,E-mail:jasm@sina.com
ABSTRACT:Objective To explore the inhibitory effects and mechanisms of benzodiazepines on Helicobacter pylori (Hp).Methods The Hp international standard strain ATCC43504 was treated with benzodiazepines diazepam,midazolam,and remimazolam,respectively.The treatments with amoxicillin and clarithromycin were taken as the positive controls,and that with water for injection as the negative control.The inhibition zone of each drug was measured by the disk diffusion method.The minimum inhibitory concentration(MIC)and minimum bactericidal concentration(MBC)of each drug against Hp were determined.Hp suspension was configured and treated with diazepam and midazolam,respectively.The bacterial suspension without drug added was used as the control group.The concentration of K+ in each bacterial suspension was measured by an automatic biochemical analyzer before drug intervention(T0)and 1(T1),2(T2),3(T3),4(T4),5(T5),6(T6),and 7 h(T7)after intervention.Hp urease was extracted and treated with 1/2 MIC diazepam,1 MIC diazepam,2 MIC diazepam,1/2 MIC midazolam,1 MIC midazolam,2 MIC midazolam,1 mg/ml acetohydroxamic acid,and water for injection,respectively.The time required for the rise from pH 6.8 to pH 7.7 in each group was determined by the phenol red coloring method.Results The inhibition zones of diazepam,midazolam,remimazolam,amoxicillin,clarithromycin,and water for injection against Hp were 52.3,42.7,6.0,72.3,60.8,and 6.0 mm,respectively.Diazepam and midazolam showed the MIC of 12.5 μg/ml and 25.0 μg/ml and the MBC of 25 μg/ml and 50 μg/ml,respectively,to Hp.The concentrations of K+ in the diazepam,midazolam,and control groups increased during T1-T7 compared with those at T0(all P<0.01).The concentration of K+ in diazepam and midazolam groups during T1-T4 was higher than that in the control group(all P<0.01).The time of inhibiting urease activity in the 1/2 MIC diazepam,1 MIC diazepam,2 MIC diazepam,1/2 MIC midazolam,1 MIC midazolam,and 2 MIC midazolam groups was(39.86±5.11),(36.52±6.65),(38.58±4.83),(39.25±6.19),(36.36±4.61),and(35.81±6.18)min,respectively,which were shorter than that in the acetohydroxamic acid group(all P<0.01)and had no significance differences from that in the water for injection group(all P>0.05).Conclusion Diazepam and midazolam exerted inhibitory effects on Hp,which may be related to the cleavage of Hp cells rather than inhibiting urease.
Key words:Helicobacter pylori;benzodiazepines;antibacterial
Acta Acad Med Sin,2023,45(5):783-788
幽门螺杆菌(Helicobacter pylori,Hp)感染与慢性胃炎、消化性溃疡、胃癌以及胃黏膜相关淋巴组织淋巴瘤等多种胃部疾病密切相关,也可引起难治性缺铁性贫血、难治性荨麻疹等消化道以外疾病。目前认为Hp感染是导致胃癌的主要危险因素[1]。根除Hp感染是预防和治疗胃部疾病的重要途径。但随着Hp根治治疗的广泛开展,其耐药性逐渐增加,如何有效提高Hp根除率仍面临着挑战[2],探寻新的抗Hp药物具有重要的临床意义[3]。苯二氮类药物是临床镇静、催眠的常用药物之一。1995年英国学者Magee等[4]发现含有咪达唑仑的注射器在使用数小时后微生物培养呈阴性,之后Ayoglu等[5]发现咪达唑仑对金黄色葡萄球菌、大肠杆菌、铜绿假单胞菌、鲍曼不动杆菌等具有杀菌作用。近期又有学者发现一些新合成的苯二氮类化合物具有广泛的抗菌活性[6-7]。然而苯二氮药物是否能杀灭或抑制Hp目前国内外缺乏相关报道。本研究拟采用Hp国际标准菌株,观察苯二氮类药物对Hp的抗菌作用,并探讨其抗菌效能和机制。
材料和方法
菌株、试剂和仪器 Hp菌株ATCC43504购自商城北纳创联生物科技有限公司,该菌株为美国临床实验室标准化协会(Clinical and Laboratory Standards Institute,CLSI)细菌药敏试验执行指南推荐的质控菌株。地西泮(批号:1501531)购自天津金耀药业有限公司,咪达唑仑(批号:MZ210608)购自江苏恩华药业股份有限公司,苯磺酸瑞马唑仑(批号:20T04081)购自宜昌人福药业有限公司,哥伦比亚血平板、Mueller-Hinton血平板、Mueller-Hinton琼脂粉、脑心浸液肉汤、羊血均购自英国OXOID公司,微需氧产气袋、密封箱购自日本三菱公司,尿素、酚红、乙酰氧肟酸、PBS缓冲液购自合肥博美生物科技公司。生物安全柜购自力康精密科技(上海)有限公司,恒温箱购自北京福意联医疗设备有限公司,比浊仪购自美国PhoenixSpec公司,全自动生化分析仪购自美国Beckman公司,超低温冰柜购自日本三菱公司,微量移液器购自德国Eppendorf公司。
菌株复苏和鉴定 取出-80 ℃冰箱中冻存的Hp菌株,置于37 ℃水浴箱中解冻,吸取100 μl均匀涂布于哥伦比亚血平板上,将血平板倒置,置于37 ℃、微需氧环境(5% O2、10% CO2和85% N2)中培养3 d后观察菌落,并通过革兰氏染色、氧化酶试验、尿素酶试验鉴定[8],同时收集复苏后的菌落,PCR扩增产物进行双向测序,在美国国家生物技术信息中心(National Center for Biotechnology Information,NCBI)数据库进行BLAST-N对比。将鉴定无误的细菌在上述环境中传代增菌,用于后续实验。
药物筛选 按照Matuschek等[9]的方法制作药敏纸片,将10片空白药敏纸片分别置入浓度为2 mg/ml的地西泮、咪达唑仑、瑞马唑仑溶液和注射用水中,30 min后将药敏纸片置入另一干燥无菌平皿中,室温下放置15 min待其干燥。以25 μg/片阿莫西林和15 μg/片克拉霉素药敏纸片作为阳性对照,注射用水药敏纸片作为阴性对照。配制0.5麦氏单位的菌悬液,取100 μl均匀涂布于Mueller-Hinton血平板,室温下放置15 min。使用无菌镊将干燥的药敏纸片贴于已接种Hp的平板上,每种药物贴3个平板,在37 ℃、微需氧环境中培养3 d后,观察并测量抑菌圈直径。依据CLSI M45-A3(2015)中的标准,抑菌圈>17 mm定义为Hp对该药敏感。
抗菌效能检测 将筛选出的Hp敏感药物,制作0、3.125、6.250、12.500、25.000、50.000、100.000 mg/ml浓度的含药培养皿[10-11],并接种100 μl浓度为0.5麦氏单位的菌悬液,每种药物浓度接种3个培养皿,在37 ℃、微需氧环境中培养3 d,观察Hp生长情况,记录完全抑制Hp生长的培养基药物最低浓度,即最低抑菌浓度(minimal inhibitory concentration,MIC)。将大于等于MIC的培养皿用10%甘油洗脱,涂布于不含药的空白培养皿上,培养3 d,观察Hp生长情况,记录完全杀死Hp的培养皿所对应的第1批培养皿的药物最低浓度,即最低杀菌浓度(minimum bactericidal concentration,MBC)。
细胞渗漏试验 配制0.5麦氏单位的Hp菌悬液,分别与12.5 μg/ml地西泮(地西泮组)和25 μg/ml咪达唑仑(咪达唑仑组)以1∶1比例混合,配成1/2 MIC的药菌混合液,以不加药的菌悬液作为对照组,加入24孔板中,每孔2 ml,每组重复3次[12]。将24孔板置于37 ℃、微需氧环境中培养,采用全自动生化分析仪检测各组药物干预前(T0)、干预后1(T1)、2(T2)、3(T3)、4(T4)、5(T5)、6(T6)和7 h(T7)菌悬液中K+浓度。
脲酶试验 按照Yu等[13]方法提取Hp脲酶,将50 ml Hp菌悬液置于离心管中,5 000 g、4 ℃离心收集Hp,用磷酸盐缓冲液(pH=7.4)洗涤2次,将沉淀的Hp置于-80 ℃保存1 d,取出恢复至室温,加入3 ml蒸馏水和蛋白酶抑制剂,超声波振荡1 min,15 000 g、4 ℃離心10 min,取上清液透析除盐,所得到的脲酶溶液加入等体积的甘油后于4 ℃储存。分别将1/2 MIC地西泮、MIC地西泮、2 MIC地西泮、1/2 MIC咪达唑仑、MIC咪达唑仑、2 MIC咪达唑仑、1 mg/ml乙酰氧肟酸、注射用水加入脲酶中,每组重复3次,37 ℃培养箱中孵育1 h,加入缓冲液、尿素和酚红,检测各组pH值从6.8升至7.7所需的时间。脲酶浓度为14 U/ml(对应2.0麦氏单位Hp菌悬液)。
统计学处理 采用SPSS 25.0软件,符合正态分布的计量资料以均数±标准差表示,多组间比较采用单因素方差分析,组内比较采用重复测量设计的方差分析。P<0.05为差异有统计学意义。
结果
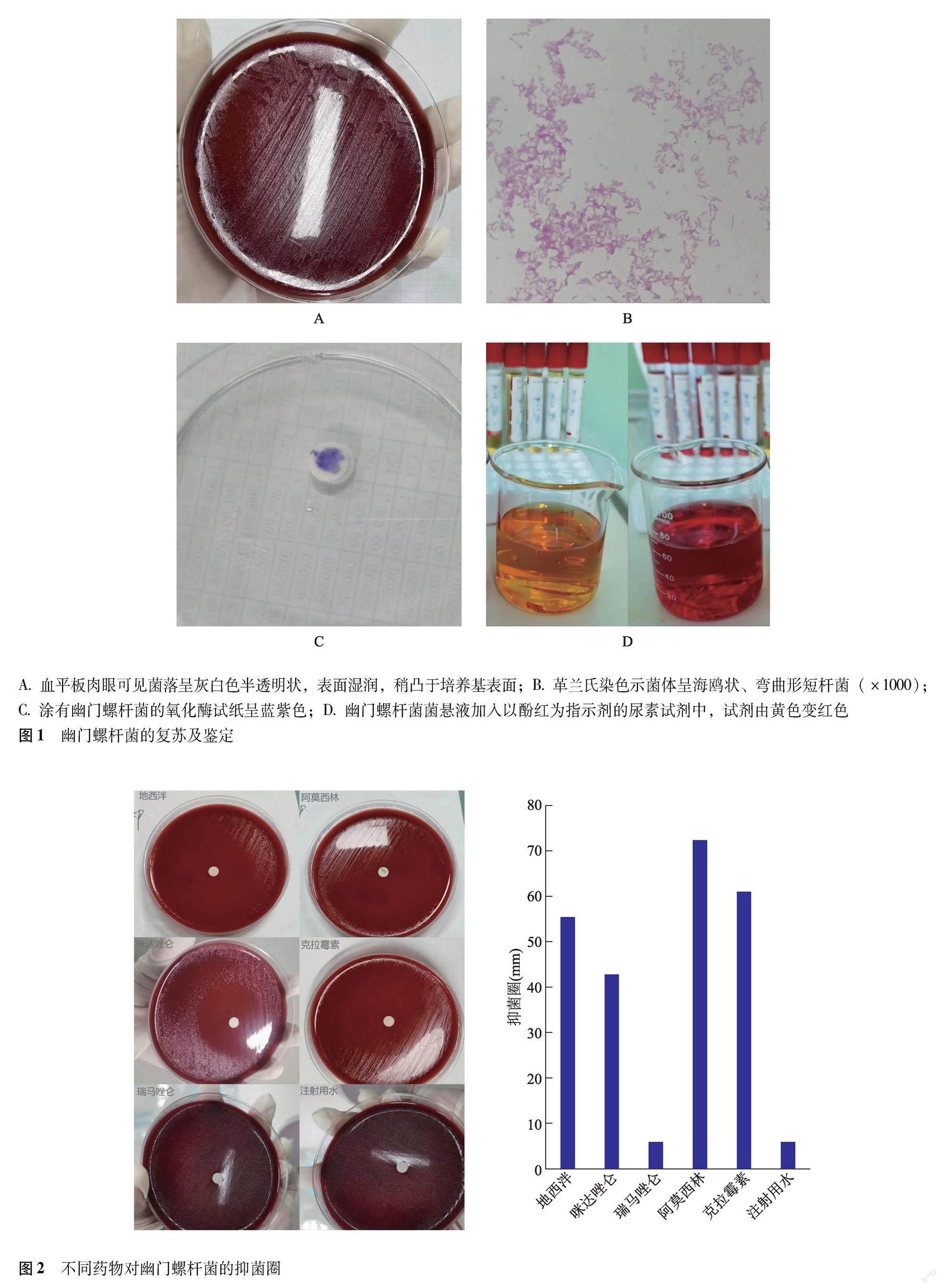
Hp复苏与鉴定 在涂有Hp的哥伦比亚血平板上,肉眼可见菌落呈灰白色半透明状,表面湿润,稍凸于培养基表面;挑取单个菌落做革兰氏染色,镜检菌体呈海鸥状、弯曲形短杆菌;氧化酶试验显示,沾有菌落的氧化酶试纸1 min内呈现蓝紫色;快速尿素酶试验显示,当将菌悬液加入以酚红为指示剂的尿素试剂中,试剂由黄色变红色。复苏的菌落经16S扩增测序,在NCBI进行BLAST-N对比,结果显示与Hp一致性为99.92%(图1)。
药物筛选 地西泮、咪达唑仑、瑞马唑仑、阿莫西林、克拉霉素、注射用水对Hp的抑菌圈分别为52.3、42.7、6.0、72.3、60.8、6.0 mm(图2)。
抗菌效能比较 地西泮和咪达唑仑对Hp的MIC分别为12.5、25.0 μg/ml,MBC分别为25、50 μg/ml。
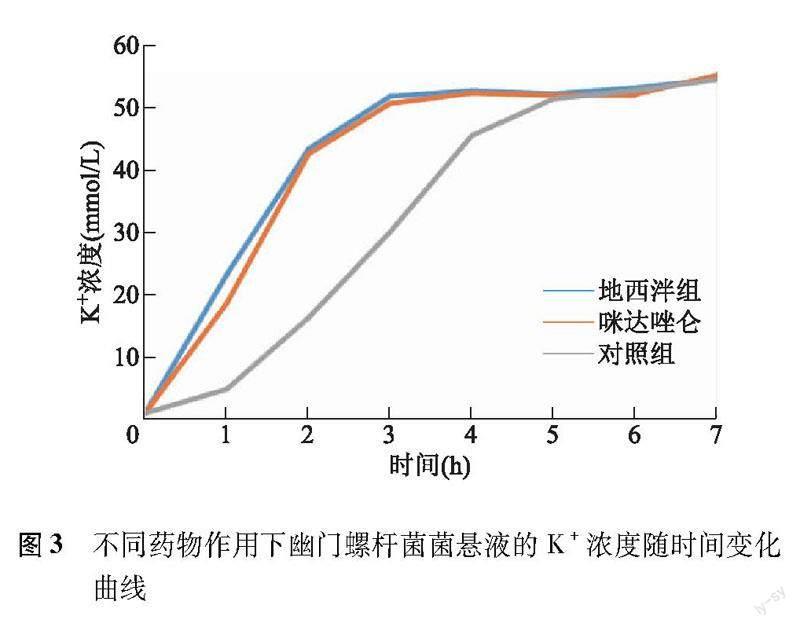
不同药物治疗组K+浓度比较 与T0比较,T1~T7地西泮组、咪达唑仑组和对照组的K+浓度均明显升高(P均<0.01);T1~T4地西泮组和咪达唑仑组的K+浓度明显高于对照组(P均<0.01)。地西泮组和咪达唑仑组K+浓度在2 h内快速升高,3 h达峰,之后趋于稳定;对照组K+浓度1 h后逐渐升高,直至5 h后趋于稳定(图3)。
脲酶反应时间 1/2 MIC地西泮组、MIC地西泮组、2 MIC地西泮组、1/2 MIC咪达唑仑组、MIC咪达唑仑组、2 MIC咪达唑仑组对脲酶活性的抑制时间分别为(39.86±5.11)、(36.52±6.65)、(38.58±4.83)、(39.25±6.19)、(36.36±4.61)、(35.81±6.18)min,明显短于乙酰氧肟酸组[(88.26±5.69)min](P均<0.01),但与注射用水组[(37.72±4.34)min]差异无统计学意义(P均>0.05)。
讨论
Hp感染是一个严重的全球性问题。世界卫生组织已经将Hp列为Ⅰ类致癌因子[14],因此根治Hp对于预防Hp引起的一系列疾病具有重要的临床意义。目前,抗生素治疗Hp的效果受到了耐药性问题的限制,寻找或者合成新型抗Hp药物具有重要的研究意义。苯二氮类药物是一类常用的镇静麻醉药,在临床上已被广泛应用于镇静、催眠、抗焦虑以及遗忘等领域。本研究结果显示,地西泮、咪达唑仑对Hp有显著抗菌作用。
据报道,某些抗抑郁药和抗精神病类药物具有抑制部分细菌和真菌的作用[15-16]。研究表明,舍曲林具有抗Hp作用,其MIC为2~8 μg/ml[17]。另一项研究显示,咪达唑仑对金黄色葡萄球菌和粪肠球菌的MIC分别为256 μg/ml和128 μg/ml[5]。此外,Kathwate等[18]的研究结果表明地西泮和咪达唑仑对白色念珠菌的MIC分别为400、100 μg/ml。本研究结果显示地西泮和咪达唑仑对Hp的MIC分别为12.5、25 μg/ml。从MIC值可以看出,与其他细菌相比,这两种药物对Hp的抗菌作用更强,其效能类似于甲硝唑[19],但略低于阿莫西林[19]。尽管静脉注射的苯二氮类药物很难达到产生抗菌效应所需的血药浓度,但很多患者通过口服地西泮或咪达唑仑进行治疗后,在胃内产生较高的药物浓度,可以形成抑制或杀灭Hp的环境。由于普通混合食物的胃排空时间通常为4~6 h,而地西泮、咪达唑仑1~3 h内即可杀灭Hp细胞,因此达到抗菌效果。
本研究细胞渗漏试验结果显示,地西泮和咪达唑仑干预的菌悬液在用药1~3 h K+浓度快速升高,提示地西泮、咪达唑仑治疗可以破坏Hp的细胞膜,显著减少Hp细胞数量,并导致K+大量渗漏。而未加药的空白菌悬液K+浓度在1 h内缓慢上升,之后在5 h达到峰值并趋于稳定,这可能是由于Hp缺乏适宜的气体及温度环境所致,随着时间的推移,细菌逐渐死亡。
Hp脲酶是Hp与其他胃肠道微生物区分的主要特征之一,对于Hp的生存和定植至关重要[20]。脲酶能够催化尿素水解,产生NH3、CO2和HCO3,其中NH3可以中和胃酸,为Hp在强酸环境中生存创造近中性的条件。脲酶是治疗Hp感染的重要靶点[21]。既往文献报道,咪唑类化合物具有脲酶抑制的活性[22-23]。由于本研究的干预药物地西泮、咪达唑仑含有咪唑环结构,故采用脲酶抑制试验,以探究这两种药物对Hp脲酶的抑制作用。实验结果表明,地西泮和咪达唑仑干预后的反应体系pH值从6.8上升至7.7所需时间与注射用水基本一致,远远短于阳性对照乙酰氧肟酸,说明这两种药物的抗菌作用与脲酶抑制无关。
2008年土耳其麻醉医师Ayoglu等[5]发现咪达唑仑具有抗菌作用,并认为这一作用是由于药液的低pH值而非药物本身的药理作用所导致。但本研究中咪达唑仑的pH值为2.9~3.7,瑞马唑仑的pH值为3.0~4.0,两种药物pH值相似,然而抑菌效果却完全不同(咪达唑仑抗菌作用明显,而瑞马唑仑无效),因此,可以初步排除低pH值是咪达唑仑产生抗菌作用的原因。
本研究尚存在不足之处:(1)仅体外证实了地西泮、咪达唑仑的抗Hp作用,未进行动物实验验证;(2)僅采用细胞渗漏试验证实药物干预后Hp细胞裂解,对于抗菌机制、作用通路及靶点未进行更深一步的探索,未来拟通过蛋白质组学技术分析地西泮、咪达唑仑对Hp的抗菌机制。
综上,本研究结果表明,苯二氮类药物地西泮、咪达唑仑对Hp具有良好的抗菌作用,其机制与Hp的细胞裂解有关,与脲酶抑制无关。地西泮和咪达唑仑可能成为Hp的潜在治疗药物,并为抗Hp新药的研发提供参考。
参考文献
[1]Ford AC,Yuan Y,Moayyedi P.Helicobacter pylori eradication therapy to prevent gastric cancer:systematic review and meta-analysis[J].Gut,2020,69(12):2113-2121.DOI:10.1136/gutjnl-2020-320839.
[2]Abdoh Q,Kharraz L,Ayoub K,et al.Helicobacter pylori resistance to antibiotics at the An-Najah National University Hospital:a cross-sectional study[J].Lancet,2018,391:S32.DOI:10.1016/S0140-6736(18)30398-2.
[3]Ghobadi E,Ghanbarimasir Z,Emami S.A review on the structures and biological activities of anti-Helicobacter pylori agents[J].Eur J Med Chem,2021,223:113669.DOI:10.1016/j.ejmech.2021.113669.
[4]Magee L,Godsiff L,Matthews I,et al.Anaesthetic drugs and bacterial contamination[J].Eur J Anaesthesiol Suppl,1995,12:41-43.
[5]Ayoglu H,Kulah C,Turan I.Antimicrobial effects of two anaesthetic agents:dexmedetomidine an midazolam[J].Anaesth Intensive Care,2008,36(5):681-684.DOI:10.1177/0310057X0803600508.
[6]Wang LZ,Li XQ,An YS.1,5-Benzodiazepine derivatives as potential antimicrobial agents:design,synthesis,biological evaluation,and structure-activity relationships[J].Org Biomol Chem,2015,13(19):5497-5509.DOI:10.1039/c5ob00655d.
[7]da Silva AV,Meneghetti SMP,Meneghetti MR.Benzodiazepines:drugs with chemical skeletons suitable for the preparation of metallacycles with potential pharmacological activity[J].Molecules,2021,26(9):2796.DOI:10.3390/molecules26092796.
[8]李凡,徐志凯,黄敏,等.医學微生物学[M].9版.北京:人民卫生出版社,2018:122-123.
[9]Matuschek E,Brown DF,Kahlmeter G.Development of the EUCAST disk diffusion antimicrobial susceptibility testing method and its implementation in routine microbiology laboratories[J].Clin Microbiol Infect,2014,20(4):O255-O266.DOI:10.1111/1469-0691.12373.
[10]Wiegand I,Hilpert K,Hancock RE.Agar and broth dilution methods to determine the minimal inhibitory concentration(MIC)of antimicrobial substances[J].Nat Protoc,2008,3(2):163-175.DOI:10.1038/nprot.2007.521.
[11]Goswami S,Bhakuni RS,Chinniah A,et al.Anti-Helicobacter pylori potential of artemisinin and its derivatives[J].Antimicrob Agents Chemother,2012,56(9):4594-4607.DOI:10.1128/AAC.00407-12.
[12]Pina-Vaz C,Rodrigues AG,Sansonetty F,et al.Antifungal activity of local anesthetics against Candida species[J].Infect Dis Obstet Gynecol,2000,8(3-4):124-137.DOI:10.1155/S1064744900000168.
[13]Yu XD,Zheng RB,Xie JH,et al.Biological evaluation and molecular docking of baicalin and scutellarin as Helicobacter pylori urease inhibitors[J].J Ethnopharmacol,2015,162:69-78.DOI:10.1016/j.jep.2014.12.041.
[14]Li BZ,Threapleton DE,Wang JY,et al.Comparative effectiveness and tolerance of treatments for Helicobacter pylori:systematic review and network meta-analysis[J].BMJ,2015,351:h4052.DOI:10.1136/bmj.h4052.
[15]Caldara M,Marmiroli N.Antimicrobial properties of antidepressants and antipsychotics-possibilities and implications[J].Pharmaceuticals(Basel),2021,14(9):915.DOI:10.3390/ph14090915.
[16]Munoz-Bellido JL,Munoz-Criado S,Garcìa-Rodrìguez JA. Antimicrobial activity of psychotropic drugs:selective serotonin reuptake inhibitors[J].Int J Antimicrob Agents,2000,14(3):177-180.DOI:10.1016/s0924-8579(99)00154-5.
[17]Krzyek P,Franiczek R,Krzyanowska B,et al.In vitro activity of sertraline,an antidepressant,against antibiotic-susceptible and antibiotic-resistant Helicobacter pylori Strains[J].Pathogens,2019,8(4):228.DOI:10.3390/pathogens8040228.
[18]Kathwate GH,Shinde RB,Karuppayil SM.Antiepileptic drugs inhibit growth,dimorphism,and biofilm mode of growth in human pathogen Candida albicans[J].Assay Drug Dev Technol,2015,13(6):307-312.DOI:10.1089/adt.2015.29007.ghkdrrr.
[19]Fauzia KA,Miftahussurur M,Syam AF,et al.Biofilm formation and antibiotic resistance phenotype of Helicobacter pylori clinical isolates[J].Toxins(Basel),2020,12(8):473.DOI:10.3390/toxins12080473.
[20]Zambelli B,Musiani F,Benini S,et al.Chemistry of Ni2+ in urease:sensing,trafficking,and catalysis[J].Acc Chem Res,2011,44(7):520-530.DOI:10.1021/ar200041k.
[21]Hameed A,Al-Rashida M,Uroos M,et al.A patent update on therapeutic applications of urease inhibitors(2012-2018)[J].Expert Opin Ther Pat,2019,29(3):181-189.DOI:10.1080/13543776.2019.1584612.
[22]呂婧.脲酶结构与功能的动力学研究及其抑制剂的设计筛选[D].杭州:浙江大学,2011.
[23]康莉,周文生,侯翠红,等.脲酶抑制剂的研究综述[J].河南化工,2009,26(2):8-10.DOI:10.14173/j.cnki.hnhg.2009.02.016.
(收稿日期:2023-04-25)

