紫菀酮对小鼠脊髓损伤后神经元凋亡的影响
许轶博 孙洋 肖林雨 朱国庆 宋雪 胡建国 齐琦
基金項目:国家自然科学基金(82071360)、安徽省高校自然科学研究重点项目(KJ2020A0587)和蚌埠医学院科研创新计划(Byycx22010、Byycx22031)
摘要:目的 探讨紫菀酮(SHI)对脊髓损伤(SCI)小鼠运动功能的影响及可能的分子机制。方法 采用C57BL/6小鼠构建SCI模型,分为模型组(SCI组)和SHI药物治疗组(SCI+SHI组),假手术小鼠为对照组。采用Basso小鼠量表(BMS)评分评估SCI小鼠运动功能恢复情况,采用HE染色和Nissl染色观察SCI小鼠脊髓组织纤维化和神经元的形态学变化,采用免疫荧光染色分析脊髓组织中神经元凋亡情况。体外培养小鼠海马神经元HT22细胞,分为肿瘤坏死因子α(TNF-α)诱导组和SHI药物治疗组,采用Western blot检测各组细胞凋亡相关蛋白的表达。利用网络药理学、基因本体和京都基因与基因组百科全书富集分析预测SHI促进SCI功能恢复的可能分子靶点和信号通路,并通过体内外实验对其分子机制进行验证。结果 与SCI组比较,SCI+SHI组小鼠BMS评分在第21、28、35、42天显著升高(P=0.003、P=0.004、P=0.023、P=0.007),脊髓组织纤维化面积显著降低(P=0.021),神经元存活数量显著增加(P=0.001),活化的半胱氨酸天冬氨酸蛋白酶3(cleaved-Caspase3)表达显著降低(P=0.017)。与TNF-α组比较,SHI组cleaved-Caspase3、Bax蛋白表达水平显著降低(P=0.010、P=0.001),而Bcl-2蛋白表达水平显著升高(P=0.001)。生物信息学分析结果显示SHI改善SCI小鼠运动功能可能与磷脂酰肌醇3-激酶(PI3K)/蛋白激酶 B(Akt)信号通路相关。体内和体外实验检测结果显示,SHI可抑制SCI小鼠或TNF-α诱导的HT22细胞中PI3K和Akt的磷酸化水平(P均<0.05),而胰岛素样生长因子-1干预后HT22细胞凋亡数量显著高于SHI组(P=0.003)。结论 SHI可能通过PI3K/Akt信号通路抑制神经元凋亡,从而促进SCI小鼠运动功能恢复。
关键词:脊髓损伤;紫菀酮;神经元;凋亡;磷脂酰肌醇3-激酶/蛋白激酶 B
中图分类号: R285.5 文献标志码: A 文章编号:1000-503X(2023)05-0703-10
DOI:10.3881/j.issn.1000-503X.15586
Effect of Shionone on Neuron Apoptosis After Spinal Cord Injury in Mice
XU Yibo1,2,SUN Yang2,3,XIAO Linyu2,3,ZHU Guoqing2,4,SONG Xue2,5,HU Jianguo2,4,QI Qi1
1Department of Histology and Embryology,College of Basic Medical Sciences,Bengbu Medical College,Bengbu,Anhui 233030,China
2Anhui Province Key Laboratory of Basic and Translational Research of Inflammation-Related Diseases,3Department of Rehabilitation,4Clinical Laboratory,5Central Laboratory,The First Affiliated Hospital of Bengbu Medical College,Bengbu,Anhui 233000,China
Corresponding author:QI Qi Tel:0552-3175282,E-mail:qq233003@163.com
ABSTRACT:Objective To explore the effect of shionone(SHI)on motor function in the mouse model of spinal cord injury(SCI)and probe into the underlying molecular mechanism.Methods C57BL/6 mice were treated to induce the SCI model and then assigned into a model group(SCI group),a SCI+SHI group,and a sham surgery(control)group.The Basso mouse scale(BMS)score was determined to evaluate the recovery of motor function in SCI mice.Hematoxylin-eosin(HE)staining,Nissl staining,and immunofluorescence staining were employed to examine the fibrosis,morphological changes of neurons,and neuron apoptosis in the spinal cord tissue of SCI mice,respectively.The mouse hippocampal neuronal cell line HT22 was cultured in vitro and then classified into tumor necrosis factor α(TNF-α)induction and SHI groups.Western blotting was employed to determine the expression of apoptosis-associated proteins.Network pharmacology,gene ontology annotation,and Kyoto Encyclopedia of Genes and Genomes pathway enrichment were employed to predict the possible molecular targets and signaling pathways of SHI in promoting functional recovery from SCI.Furthermore,the prediction results were verified by in vitro and in vivo experiments.Results Compared with the SCI group,the SCI+SHI group showed increased BMS score on days 21,28,35,and 42(P=0.003,P=0.004,P=0.023,and P=0.007,respectively),reduced area of spinal cord fibrosis(P=0.021),increased neurons survived(P=0.001),and down-regulated expression of cleaved cysteine aspastic acid-specific protease 3(cleaved Caspase-3)(P=0.017).Compared with the TNF-α group,the SHI group presented down-regulated expression levels of cleaved Caspase-3 and Bax(P=0.010,P=0.001)and up-regulated expression level of Bcl-2(P=0.001).The results of bioinformatics analysis showed that SHI might improve the motor function of SCI mice via the phosphatidylinositol 3-kinase(PI3K)/protein kinase B(Akt)signaling pathway.The results of in vivo and in vitro experiments showed that SHI inhibited the phosphorylation of PI3K and Akt in SCI mice or HT22 cells exposed to TNF-α(all P<0.05).The number of apoptotic HT22 cells after treatment with insulin-like growth factor 1 was higher than that in the SHI group(P=0.003).Conclusion SHI may inhibit neuron apoptosis via the PI3K/Akt signaling pathway,thereby promoting the recovery of motor function in SCI mice.
Key words:spinal cord injury;shionone;neuron;apoptosis;phosphatidylinositol 3-kinase/protein kinase B
Acta Acad Med Sin,2023,45(5):703-712
脊髓损伤(spinal cord injury,SCI)会导致长期或永久性的神经功能缺损,造成运动和感觉功能障碍,影响患者生活质量,同时也给社会和家庭带来巨大的经济负担[1-2]。原发性损伤后的一系列继发性损伤可导致神经元凋亡,是造成运动功能障碍的重要原因,早期干预减少神经元凋亡是促进SCI后运动功能恢复的关键[3]。然而,目前尚无有效药物可以抑制SCI神经元凋亡,因此急需寻找和开发新的治疗药物,以促进SCI患者的康复。天然植物化合物以其生物学作用多样且安全的特点受到关注,越来越多的学者尝试从中草药中提纯有效成分用于SCI的治疗[4]。紫菀为菊科紫菀属草本植物,以干燥根茎入药[5]。据报道紫菀具有抗视网膜血管细胞凋亡的特性,而作为紫菀的主要活性成分紫菀酮(shionone,SHI)调控细胞凋亡及在SCI中的作用相关报道较少[6-7]。本研究以SCI小鼠模型为研究对象,观察SHI对SCI小鼠运动功能恢复的作用效果;并结合体内和体外实验,分析SHI调控神经元细胞凋亡在SCI中的作用及可能的分子机制,以期为临床药物治疗提供参考。
材料和方法
材料 SHI购自上海源叶生物科技有限公司,小鼠海马神经元HT22细胞购自武汉普诺赛生命科技有限公司,胎牛血清购自美国Gibco公司,胰岛素样生长因子-1(insulin-like growth factor 1,IGF-1)购自美国MedChemExpress公司,HE染色液购自珠海贝索细胞科学技术有限公司,Bcl-2、Bax、活化的半胱氨酸天冬氨酸蛋白酶3(cleaved-cysteine asparate protease 3,cleaved-Caspase3)、磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)、蛋白激酶B(protein kinase B,Akt)、磷酸化PI3K(phosphorylation PI3K,p-PI3K)、磷酸化Akt(phosphorylation Akt,p-Akt)、β-actin抗体均购自英国Abcam公司,神经元特异性核蛋白(neuron specific nuclear protein,NeuN)购自武汉三鹰生物技术公司,肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)购自美国Sigma公司。
实验动物 6~8周龄野生型C57BL/6雌性小鼠购自江苏集萃药康生物科技股份有限公司,生产许可证号SCXK(苏)2018-0008,饲养于SPF级环境中。本研究经蚌埠医学院动物研究伦理委员会批准(伦理审批编号:伦动科批字〔2020〕第044号)。
SCI小鼠模型建立 采用美国PSI公司脊髓打击器IH-0400建立小鼠SCI模型[8]。采用1%戊巴比妥钠(60 mg/kg)腹腔注射麻醉,切除第9胸椎椎板,充分暴露脊髓,稳定脊柱后使用具有50 kdyn的脊髓打击器(直径1.3 mm)垂直击打脊髓建立SCI模型,打击后小鼠出现尾部痉挛摇摆,双下肢瘫痪,表明造模成功。假手术组只切除椎板不损伤脊髓。建模后小鼠每日皮下注射0.5 ml 8000 U青霉素预防感染,每日3次手动排空膀胱,直至小鼠自主排尿。
动物分组 将48只C57BL/6小鼠(体重20~25 g)随机分为3组:假手术组(对照组)、模型组(SCI组)和治疗组(SCI+SHI组),每组16只。SCI+SHI组小鼠每日给予20 mg/kg SHI灌胃治疗,连续给药7 d;对照组和SCI组每日给予等体积生理盐水进行灌胃。于造模后第7天和第6周处死小鼠,分离脊髓组织[9]。
Basso小鼠量表评分 每组随机抽取6只小鼠,于术前和术后第1、3、7、14、21、28、35、42天采用Basso小鼠量表(Basso mouse scale,BMS)评分标准对小鼠后肢进行连续运动功能状态评估[10]。将小鼠置于空旷平坦的场地中,自由活动3 min,采用双盲法进行评分,观察指标包括小鼠后肢踝关节活动度、协调性、脚爪姿态和躯干稳定性等,评分分为10个等级,0分:完全观察不到踝关节运动;1分:踝关节轻度活动,关节活动范围≤50%;2分:踝关节大幅运动,关节活动范围>50%;3分:爪子主动放置在地面上,拇指和小指都触地,可以负重或不负重,或者偶尔/频繁/持续以足背负重行走,无足底负重行走;4分:偶见(≤50%)足底负重行走;5分:频繁(51%~94%)到持续(95%~100%)足底负重行走,但无前、后肢协调;6分:频繁到持续足底负重行走,有少量前、后肢协调,并且后爪在刚触地时平行;7分:频繁到持续足底负重行走,有大量前、后肢协调,并且后爪在刚触地和抬起时平行,但躯体严重不稳;8分:频繁到持续足底负重行走,有大量前、后肢协调,并且后爪在刚触地和抬起时均平行,有轻度躯体不稳表现;9分:足底可以负重行走,前后肢协调,躯干稳定。由两名经过培训并熟练掌握评分细则的BMS评分员,在未知小鼠分组的情况下,独立观察小鼠3~5 min,统计两名评分者的平均评分。
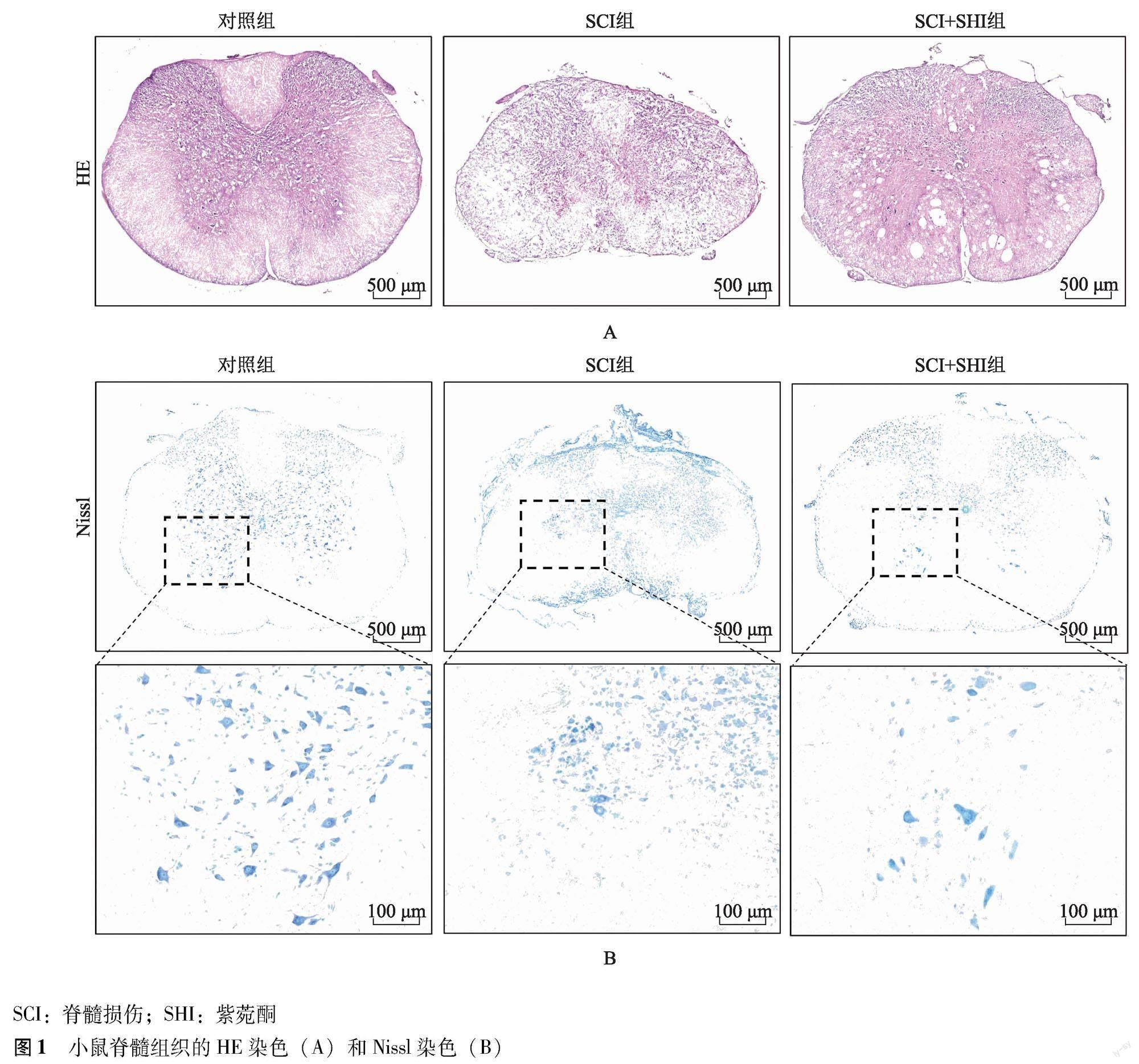
组织病理学观察 各组小鼠随机选取6只于造模后第42天麻醉处死,4%多聚甲醛行左心室—主动脉灌注后,分離以损伤点为中心上下共1 cm的脊髓组织,常规包埋后制作冰冻切片。采用HE染色、Nissl染色评估脊髓组织纤维化面积及神经元凋亡情况[11]。
细胞培养及分组 HT22细胞采用含10%胎牛血清的DMEM完全培养基培养,待细胞生长至对数期,以2×105个/孔的密度接种于6孔板中,分为对照组(单纯DMEM完全培养基)、TNF-α组(100 ng/ml TNF-α诱导12 h)、SHI组(100 ng/ml TNF-α诱导12 h加20 μmol/L SHI治疗1 d)。此外,采用100 ng/ml PI3K/Akt信号通路激动剂IGF-1处理HT22细胞24 h,观察该信号通路关键蛋白的变化情况[12-13]。
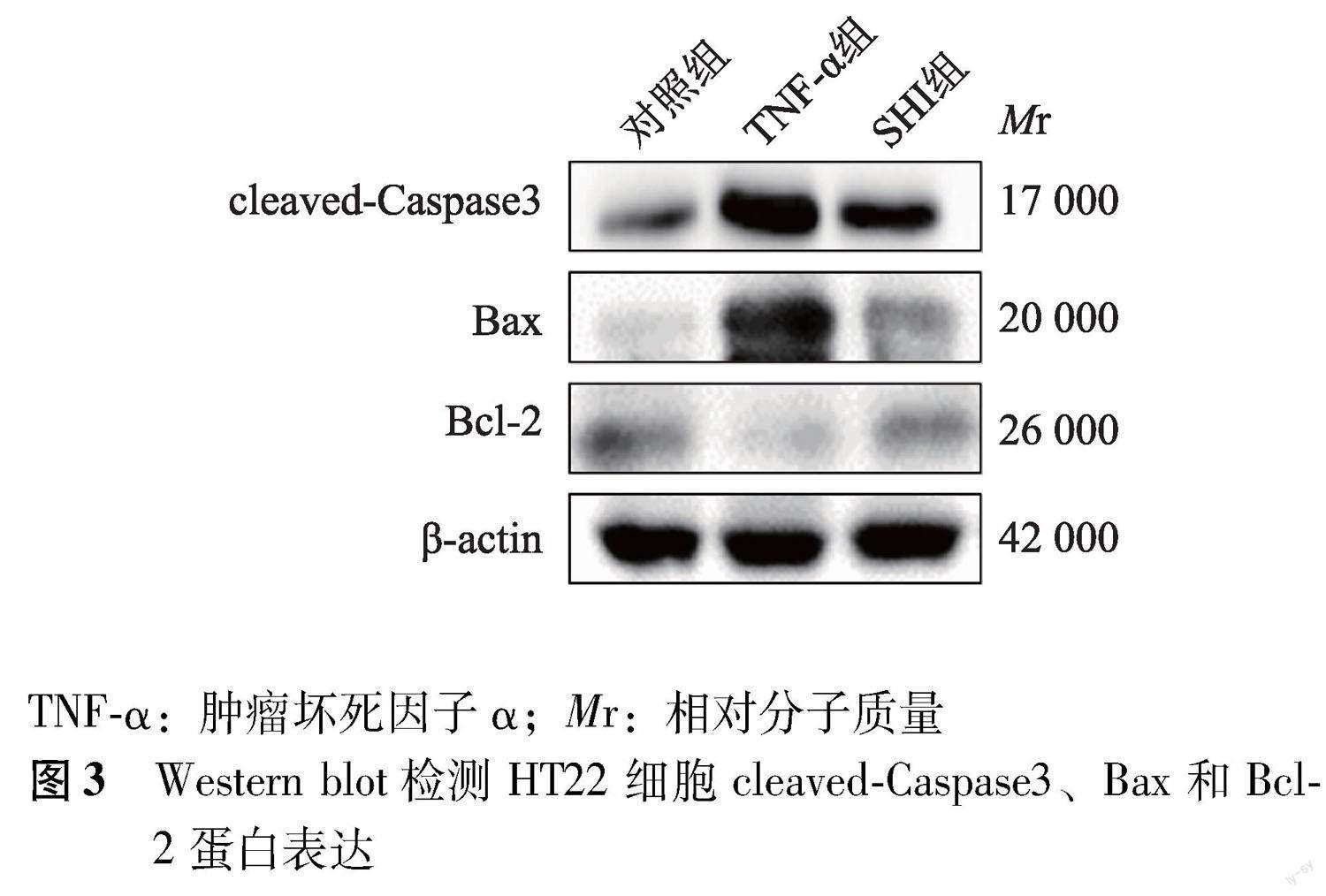
Western blot检测 各组脊髓组织和细胞经PBS洗涤后,采用RIPA裂解液裂解并提取总蛋白,BCA法检测蛋白浓度。取50 μg蛋白进行SDS-PAGE电泳,将分离的蛋白转移至PVDF膜上,5%脱脂奶粉封闭,分别加入Bcl-2(1∶1000)、Bax(1∶1000)、cleaved-Caspase3(1∶1000)、PI3K(1∶1000)、Akt(1∶1000)、p-PI3K(1∶1000)、 p-Akt(1∶1000)、β-actin(1∶1000)和辣根过氧化物酶标记的山羊抗兔/小鼠IgG(1∶3000),使用ECL发光液曝光后采集图片,并采用Image-J软件分析灰度值。
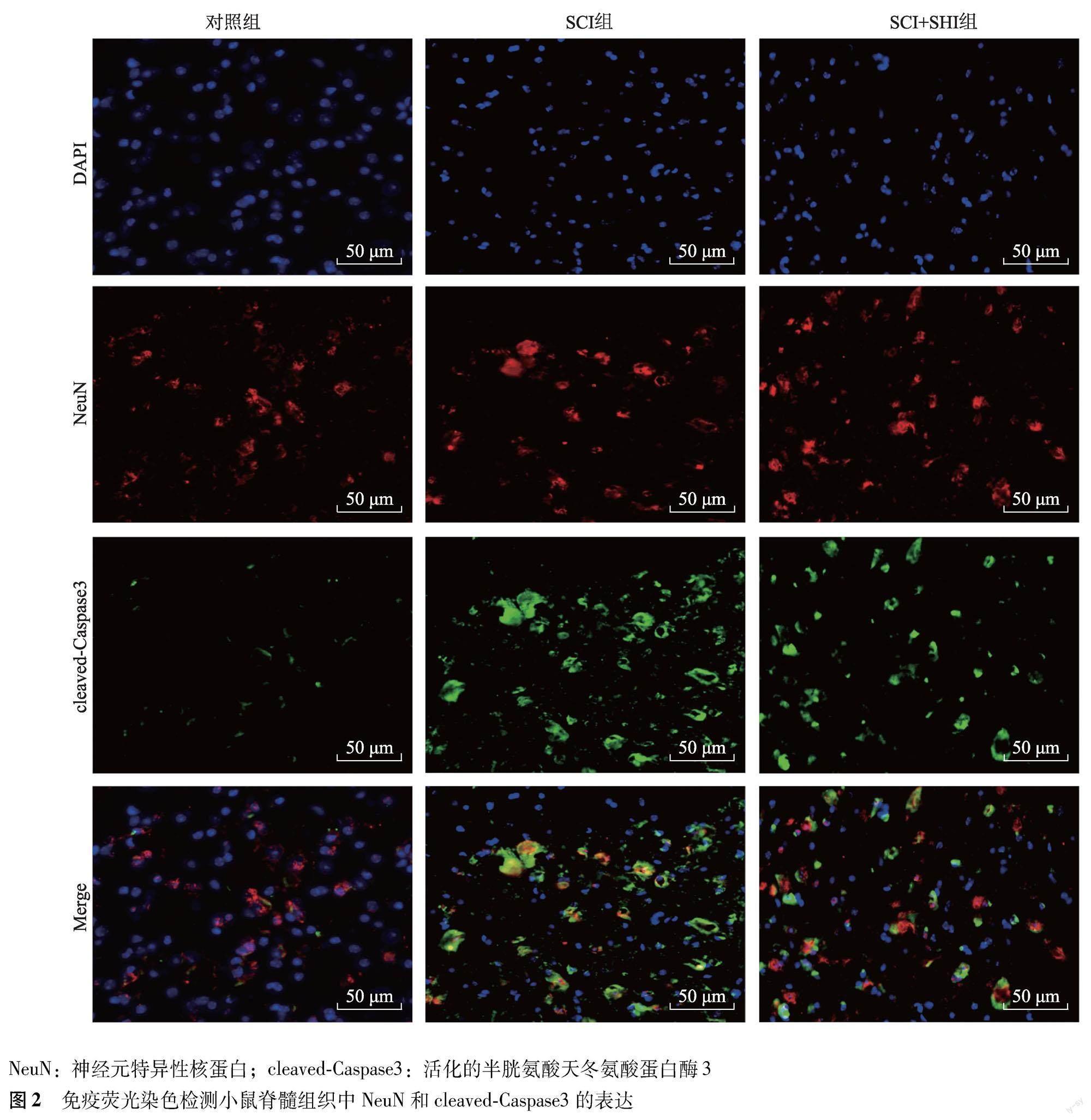
免疫荧光染色 脊髓组织冰冻切片经PBS洗涤、固定和封闭后,加入NeuN(1∶200)和cleaved-Caspase3(1∶200)4 ℃孵育过夜,PBS洗涤后加入FITC标记的山羊抗小鼠IgG(H+L)(1∶500)和Alexa Fluor555标记的山羊抗兔IgG(H+L)(1∶1000)室温孵育1 h,经2 μg/ml DAPI复染细胞核和封片后,置于激光扫描共聚焦显微镜下采集图片。HT22细胞爬片固定后,0.2% Triton-100破膜20 min,封闭1 h,加入一抗cleaved-Caspase3(1∶200)、Bcl-2(1∶200)4 ℃孵育过夜,二抗室温孵育1 h,封片后于激光扫描共聚焦显微镜下观察。
SHI与SCI交集靶点筛选 从Pubchem数据库获得SHI结构式,并将其SMILES结构导入Swiss Target Predictio数据库和PharmMapper数据库,以可能性>0为限制条件进行筛选,预测SHI潜在作用靶点。利用Genecards数据库检索SCI相关靶点并剔除非人源基因。将SHI潜在作用靶点和SCI相关靶点导入Venny 2.1.0在线工具,绘制韦恩图。
蛋白质互作网络分析 将SHI与SCI的交集靶点基因输入STRING数据库,获得蛋白质互作网络(protein-protein interaction networks,PPI)的数据文件。将蛋白质相互作用关系文件导入Cytoscape 3.7.2软件,建立SHI与SCI靶点蛋白PPI网络图。根据PPI网络图中各靶点的点度中心性参数筛选出关键靶点基因。
基因本体和京都基因与基因组百科全书富集分析 将筛选的关键靶点基因输入DAVID数据库,进行京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)信号通路富集和基因本体(gene ontology,GO)功能分析。
统计学处理 采用SPSS 26.0软件,符合正态分布和方差齐性的计量资料以均数±标准差表示,两组间均数比较采用t检验,多组间均数比较采用单因素方差分析;不符合正态分布和方差齐性的计量资料采用非参数检验。P<0.05为差异有统计学意义。所有实验均独立重复3次。
结 果
BMS评分比较 与SCI组比较,SCI+SHI组BMS评分在第21、28、35、42天显著升高(P=0.003、P=0.004、P=0.023、P=0.007)。
组织病理学变化 HE染色结果显示,SHI显著减少SCI后脊髓组织的纤维化面积(P=0.021)(圖1A)。Nissl染色结果显示,SCI+SHI组在距离损伤中心0.5 mm处残余的前角运动神经元的数量显著多于SCI组(P=0.001)(图1B)。
SHI对SCI小鼠脊髓神经元细胞凋亡的影响 免疫荧光染色结果显示,与SCI组比较,SCI+SHI组小鼠脊髓组织中NeuN和cleaved-Caspase3表达阳性的细胞数显著减少(P=0.017)(图2)。
SHI对TNF-α诱导的HT22细胞凋亡的影响 Western blot检测结果显示,与TNF-α组比较,SHI组HT22细胞Bax(2.08±0.24比4.82±0.42;t=7.940,P=0.001)和cleaved-Caspase3蛋白(5.24±0.13比8.90±1.13;t=4.557,P=0.010)表达水平显著降低,而Bcl-2蛋白表达水平显著增加(0.72±0.04比0.39±0.03;t=10.010,P=0.001)(图3)。
PPI网络分析 韦恩图发现106个SHI和SCI的交集靶点(图4A),并构建PPI网络图(图4B),拓扑分析得出前6位的交集靶点分别为SRC、HSP90AA1、MAPK1、PIK3R1、EGFR和IGF1,点度中心性值依次为66、60、54、54、54、48。
GO功能注释分析 对106个交集靶点进行GO功能注释分析结果显示,SHI的调控功能可能与抗凋亡和PI3K信号通路的调节有关(图5)。
KEGG富集分析 对106个交集靶点进行KEGG通路富集分析结果显示,SHI的抗凋亡作用可能与PI3K/Akt信号通路有关(图6)。
SHI对SCI小鼠脊髓组织PI3K/Akt通路蛋白表达的影响 Western blot检测结果显示,与SCI组比较,SCI+SHI组p-PI3K(2.64±0.15比4.56±0.92;t=2.919,P=0.043)和p-Akt表达(1.85±0.19比3.03±0.25;t=5.276,P=0.006)显著降低(图7)。
SHI抑制PI3K/Akt通路对神经元凋亡的影响 Western blot检测结果显示,与TNF-α组比较,SHI组p-PI3K(4.25±0.23比8.66±0.31;t=16.130,P<0.001)和p-Akt表达(2.38±0.36比9.37±0.48;t=16.470,P<0.001)显著降低,PI3K/Akt通路激动剂IGF-1干预后p-PI3K(6.21±0.48比4.25±0.23;t=5.161,P=0.007)和p-Akt表达(3.61±0.44比2.38±0.36;t=3.044,P=0.038)显著升高(图8A)。免疫荧光染色结果显示,与TNF-α组比较,SHI组cleaved-Caspase3阳性细胞数显著降低(P=0.001),而Bcl-2阳性细胞数显著升高(P=0.004);IGF-1干预后cleaved-Caspase3阳性细胞数显著增多(P=0.003),Bcl-2阳性细胞数显著减少(P=0.002)(图8B)。
讨论
SCI治疗是一个世界性难题,通过药物干预抑制神经元凋亡等病理损伤是减缓SCI神经功能障碍的有效方法之一[14]。本研究发现菊科植物紫菀的活性单体SHI具有改善SCI小鼠运动功能的作用,可能与其靶向抑制PI3K/Akt信号通路,进而拮抗神经元凋亡有关。
本研究发现SHI可改善SCI小鼠运动功能,表现为SHI干预后SCI小鼠的BMS评分显著升高、脊髓组织纤维化面积明显减少以及残留的前角运动神经元数量增多。随着中医药的兴起,越来越多的中国学者尝试从中草药中提纯有效成分用于治疗无特效药物的疾病,包括炎症性肠病、自身免疫性疾病及SCI等[15-16]。中药单体具有分子量小,易吸收,可通过血脊髓屏障等优点,受到SCI治疗药物研发者的青睐。目前,已有多种中药单体被证明可以改善SCI损伤,包括白术内酯Ⅲ[17]、槲皮素[18]及莫诺苷[19]等。本研究结果为SCI治疗药物选择提供了新的方向,同时也证明了SHI的药用价值及适用疾病范围。
中药单体化合物生物活性多样,具有抗炎、调控细胞增殖和凋亡等作用[20]。据报道SHI具有抗视网膜血管细胞凋亡的作用,而抑制细胞凋亡是治疗SCI的关键环节[21]。本研究结果证实SHI可通过抑制损伤脊髓组织中的神经细胞凋亡发挥神经元保护作用,从而促进SCI后运动功能恢复。在众多的凋亡调控基因中Caspase家族和Bcl-2蛋白家族最受关注[22]。Caspase是凋亡程序的重要执行者,其中Caspase3是哺乳动物细胞凋亡通路中的关键死亡蛋白酶,在细胞凋亡中起着不可替代的作用。本研究通过神经元特异性标志物NeuN和cleaved-Caspase3对SCI小鼠的脊髓组织进行免疫荧光双染,结果表明SHI治疗后cleaved-Caspase3表达数量显著减少,说明SHI可以抑制SCI小鼠的神经元凋亡。Bcl-2是抗凋亡蛋白,Bax是Bcl-2家族中促凋亡蛋白,凋亡程度通常由Bcl-2/Bax的比值决定[24]。本研究结果显示,SHI可以促进TNF-α诱导的HT22细胞中Bcl-2的表达,抑制Bax的表达,提示SHI的神经保护作用可能与Bcl-2家族的抗凋亡作用有关。
中药单体作为小分子化合物,调控细胞生物学功能的分子机制复杂,常可直接结合靶蛋白调控下游信号通路。本研究通过网络药理学方法分析获得106个SHI和SCI的交集靶点,经PPI网络分析筛选出SRC、HSP90AA1、MAPK1、PIK3R1、EGFR、IGF1可能为SHI发挥作用的关键靶蛋白。既往研究报道,SRC、HSP90AA1、PIK3R1、EGFR和IGF1蛋白均可通过PI3K/Akt信号通路调控细胞凋亡等多种生物学过程[25-29]。此外,KEGG富集分析也显示SHI对SCI的保护作用可能与PI3K信号通路有关。研究发现PI3K/Akt/哺乳动物雷帕霉素靶蛋白信号通路是SCI后的一条经典途径,其调控神经元凋亡、轴突脱髓鞘和炎症反应等过程,拮抗其激活有助于SCI早期神经功能恢复[30-31]。本研究采用Western blot和免疫荧光染色等方法,从体内外实验验证SHI抑制神经元凋亡可能与其抑制PI3K/Akt信号通路有关。
本研究存在以下不足:首先,SCI神经元凋亡的调控十分复杂,受多种因素影响,SHI除抑制神经元凋亡外,是否还参与SCI其他病理过程有待进一步探究;其次,本研究采用的SHI用药剂量是通过预实验确定的,有关SHI的最佳注射剂量仍然需要进一步研究,为本研究成果的临床转化提供参考。
综上,本研究结果表明,SHI可能通过抑制PI3K/Akt信号通路发挥抗神经元凋亡作用,从而促进SCI小鼠运动功能恢复。
参考文献
[1]Kiyotake EA,Martin MD,Detamore MS.Regenerative rehabilitation with conductive biomaterials for spinal cord injury[J].Acta Biomater,2022,139:43-64.DOI:10.1016/j.actbio.2020.12.021.
[2]Eftekharpour E,Karimi-Abdolrezaee S,Fehlings MG.Current status of experimental cell replacement approaches to spinal cord injury[J].Neurosurg Focus,2008,24(3-4):E19.DOI:10.3171/FOC/2008/24/3-4/E18.
[3]McKay CA,Pomrenke RD,McLane JS,et al.An injectable,calcium responsive composite hydrogel for the treatment of acute spinal cord injury[J].ACS Appl Mater Interfaces,2014,6(3):1424-1438.DOI:10.1021/am4027423.
[4]Tu Y.Artemisinin-a gift from traditional Chinese medicine to the world(nobel lecture)[J].Angew Chem Int Ed Engl,2016,55(35):10210-10226.DOI:10.1002/anie.201601967.
[5]張笑玲,孟义江,贾凯旋,等.紫菀中有效成分紫菀酮含量的时空变化规律[J].江苏农业科学,2021,49(16):174-179.DOI:10.15889/j.issn.1002-1302.2021.16.032.
[6]Zhang Y,Wang Q,Wang T,et al.Inhibition of human gastric carcinoma cell growth in vitro by a polysaccharide from aster tataricus[J].Int J Biol Macromol,2012,51(4):509-513.DOI:10.1016/j.ijbiomac.2012.06.019.
[7]Kim J,Jo K,Lee IS,et al.The extract of aster koraiensis prevents retinal pericyte apoptosis in diabetic rats and its active compound,chlorogenic ccid inhibits age formation and AGE/RAGE interaction[J].Nutrients,2016,8(9):585.DOI:10.3390/nu8090585.
[8]陳月娟,石玲玲,谢秀梅,等.大鼠PSI-IH脊髓撞击损伤模型的制备[J].华中科技大学学报(医学版),2016,45(4):420-423.DOI:10.3870/j.issn.1672-0741.2016.04.014.
[9]Chung KS,Cheon SY,Roh SS,et al.Chemopreventive effect of aster glehni on inflammation-induced colorectal carcinogenesis in mice[J].Nutrients,2018,10(2):202.DOI:10.3390/nu10020202.
[10]Ge MH,Tian H,Mao L,et al.Zinc attenuates ferroptosis and promotes functional recovery in contusion spinal cord injury by activating Nrf2/GPX4 defense pathway[J].CNS Neurosci Ther,2021,27(9):1023-1040.DOI:10.1111/cns.13657.
[11]Espanol MT,Litt L,Chang LH,et al.Adult rat brain-slice preparation for nuclear magnetic resonance spectroscopy studies of hypoxia[J].Anesthesiology,1996,84(1):201-210.DOI:10.1097/00000542-199601000-00022.
[12]Zhu L,Shen H,Gu PQ,et al.Baicalin alleviates TNBS-induced colitis by inhibiting PI3K/AKT pathway activation[J].Exp Ther Med,2020,20(1):581-590.DOI:10.3892/etm.2020.8718.
[13]Song Y,Wu Q,Jiang H,et al.The effect of shionone on sepsis-induced acute lung injury by the ECM1/STAT5/NF-κB pathway[J].Front Pharmacol,2022,12:764247.DOI:10.3389/fphar.2021.764247.
[14]Stokes S,Drozda M,Lee C.The past,present,and future of traumatic spinal cord injury therapies:a review[J].Bone Jt Open,2022,3(5):348-358.DOI:10.1302/2633-1462.35.BJO-2021-0177.R1.
[15]Zhao Y,Yang Y,Zhang J,et al.Lactoferrin-mediated macrophage targeting delivery and patchouli alcohol-based therapeutic strategy for inflammatory bowel diseases[J].Acta Pharm Sin B,2020,10(10):1966-1976.DOI:10.1016/j.apsb.2020.07.019.
[16]Luo W,Lin K,Hua J,et al.Schisandrin b attenuates diabetic cardiomyopathy by targeting MyD88 and Inhibiting MyD88-dependent inflammation[J].Adv Sci(Weinh),2022,9(31):e2202590.DOI:10.1002/advs.202202590.
[17]Xue MT,Sheng WJ,Song X,et al.Atractylenolide III ameliorates spinal cord injury in rats by modulating microglial/macrophage polarization[J].CNS Neurosci Ther,2022,28(7):1059-1071.DOI:10.1111/cns.13839.
[18]Fan H,Tang HB,Shan LQ,et al.Quercetin prevents necroptosis of oligodendrocytes by inhibiting macrophages/microglia polarization to M1 phenotype after spinal cord injury in rats[J].J Neuroinflammation,2019,16(1):206.DOI:10.1186/s12974-019-1613-2.
[19]Duan FX,Shi YJ,Chen J,et al.The neuroprotective role of morroniside against spinal cord injury in female rats[J].Neurochem Int,2021,148:105105.DOI:10.1016/j.neuint.2021.105105.
[20]Han X,Xu T,Fang Q,et al.Quercetin hinders microglial activation to alleviate neurotoxicity via the interplay between NLRP3 inflammasome and mitophagy[J].Redox Biol,2021,44:102010.DOI:10.1016/j.redox.2021.102010.
[21]Bhimani AD,Kheirkhah P,Arnone GD,et al.Functional gait analysis in a spinal contusion rat model[J].Neurosci Biobehav Rev,2017,83:540-546.DOI:10.1016/j.neubiorev.2017.09.007.
[22]Krueger A,Baumann S,Krammer PH,et al.FLICE-inhibitory proteins:regulators of death receptor-mediated apoptosis[J].Mol Cell Biol,2001,21(24):8247-8254.DOI:10.1128/MCB.21.24.8247-8254.2001.
[23]Chang HY,Yang X.Proteases for cell suicide:functions and regulation of caspases[J].Microbiol Mol Biol Rev,2000,64(4):821-846.DOI:10.1128/MMBR.64.4.821-846.2000.
[24]Tuli HS,Joshi R,Aggarwal D,et al.Molecular mechanisms underlying chemopreventive potential of butein:current trends and future perspectives[J].Chem Biol Interact,2021,350:109699.DOI:10.1016/j.cbi.2021.109699.
[25]Quan XJ,Liang CL,Sun MZ,et al.Overexpression of steroid receptor coactivators alleviates hyperglycemia-induced endothelial cell injury in rats through activating the PI3K/Akt pathway[J].Acta Pharmacol Sin,2019,40(5):648-657.DOI:10.1038/s41401-018-0109-4.
[26]Hu B,Zhang Y,Jia L,et al.Binding of the pathogen receptor HSP90AA1 to avibirnavirus VP2 induces autophagy by inactivating the AKT-mTOR pathway[J].Autophagy,2015,11(3):503-515.DOI:10.1080/15548627.2015.1017184.
[27]Dyment DA,Smith AC,Alcantara D,et al.Mutations in PIK3R1 cause short syndrome[J].Am J Hum Genet,2013,93(1):158-166.DOI:10.1016/j.ajhg.2013.06.005.
[28]Zaryouh H,De Pauw I,Baysal H,et al.Recent insights in the PI3K/Akt pathway as a promising therapeutic target in combination with EGFR-targeting agents to treat head and neck squamous cell carcinoma[J].Med Res Rev,2022,42(1):112-155.DOI:10.1002/med.21806.
[29]Nanji M,Hopper NA,Gems D.LET-60 ras modulates effects of insulin/IGF-1 signaling on development and aging in caenorhabditis elegans[J].Aging Cell,2005,4(5):235-245.DOI:10.1111/j.1474-9726.2005.00166.x.
[30]Bi X,Liu J,Yao Y,et al.Deregulation of the phosphatidylinositol-3 kinase signaling cascade is associated with neurodegeneration in Npc1-/-mouse brain[J].Am J Pathol,2005,167(4):1081-1092.DOI:10.1016/S0002-9440(10)61197-2.
[31]張鹏.芸香苷抑制脊髓损伤大鼠炎症反应及相关机制的实验研究[D].太原:山西医科大学,2017.
(收稿日期:2023-03-20)

