光信号对AmRosea1过表达84K杨花青素合成及基因表达的影响
闫惠铃 张鑫鑫 赵曦阳 曲冠证 王兆宁 韩 锐*
(1.林木遗传育种国家重点实验室,东北林业大学,哈尔滨 150040; 2.林学与草学学院,吉林农业大学,长春 130118)
花青素(anthocyanin)又称花色苷,广泛存在于植物的花、叶、茎、果实等器官中,是重要的植物类黄酮化合物,也是重要的水溶性植物色素。已知的花青素有600 多种,超过80%是由天竺葵素(pelargonidin,Pg)、芍药花素(peonidin,Pn)、矢车菊素(cyanidin,Cy)、锦葵素(malvidin,Mv)、矮牵牛素(petunidin,Pt)和飞燕草素(delphinidin,Dp)6 种常见的花青素衍生而来的[1]。不同种类的花青素使植物呈现出不同的颜色,例如,天竺葵素及其衍生物使植物组织或器官呈现红色或橙色,矢车菊素及其衍生物主要呈现红色或紫色,飞燕草素及其衍生物主要呈现蓝色或紫色[1-2]。
花青素合成通路在高等植物中较为保守,主要分为花青素基本骨架的形成、花青素前体的形成及花青素前体修饰,属于黄酮类化合物。由苯丙氨酸(phenylalanine)为起点,经过苯丙氨酸解氨酶(phenylalanine ammonia lyase,PAL)、肉桂酸羟化酶(cinnamate 4-hydroxylase,C4H)和4-香豆酰CoA 连接酶(4-coumarate CoA ligase,4CL)修饰合成柚皮素(naringenin),以此为节点,形成3 个分支,其一是通过异黄酮7-O-葡糖苷-6″-O-丙醇基转移 酶(isoflavone 7-O-glucoside-6″-O-malonyltransferase,IF7MAT)合成异黄酮化合物,其二经过黄酮醇-3-O-葡萄糖苷L-鼠李糖基转移酶(flavonol-3-Oglucoside L-rhamnosyltransferase,FG2)合成黄酮化合物,其三经过二氢黄酮醇-4-还原酶(dihydroflavonol 4-reductase,DFR)、花青素合成酶(anthocyanidin synthase,ANS)、糖基转移酶(3-O-glucosyltransferase,UFGT/BZ1)合成花青素[1]。每个阶段涉及了多种酶促反应,需要多条编码相关酶的结构基因参与其中,根据参与时间的先后,这些结构基因分为早期生物合成基因(early biosynthetic genes,EBGs):CHS、CHI、F3H和F3′H等;晚期生物合成基因(late biosynthetic genes,LBGs):DFR、ANS和UFGT等,其中晚期生物合成基因的表达受MYB-bHLH-WD40三元复合物调控[3]。
光照是影响花青素积累的主要环境因子之一,研究表明,光强和光质的变化均可以激活花青素合成通路中的相关基因,从而对植物体中花青素含量产生影响。例如,强光可以激活结构基因的表达,使拟南芥(Arabidopsis thaliana)更容易合成花青素,而弱光或者黑暗会抑制结构基因的表达,从而减少花青素的合成[4];光照条件下,与普通绿豆(Vigna radiata)相比,黑绿豆中花青素大量积累,飞燕草素和矢车菊素含量较高,VrDFR、VrLDOX等11 条结构基因表达量显著上调,PAL、CHI和UFGT 活性较高;遮光条件下,普通绿豆和黑绿豆种皮明显失绿,花青素各组分含量、花青素合成结构基因的表达量和花青素合成相关酶活性均明显减低[5]。此外,对于园艺作物来说,蓝光照射可以促使草莓(Fragaria×ananassa)果实、葡萄(Vitis vinifera)果皮、矮牵牛花(Petunia hybrida)中花青素积 累[6-8],激 活 彩 椒(Capsicum annuum)中PAL、4CL、F3H、ANS等基因的表达[9]。而植物中合成的可溶性糖为植物提供呼吸底物同时也维持植物的渗透压,也以糖信号的形式影响花青素的生物合成。花青素作为抗氧化代谢物之一,可以有效的清除叶片的自由基。过氧化物(POD)作为植物的氧化还原酶之一,同样能够清除植物体内的自由基,检测植物内POD 酶的活性,可以确定植物内的抗氧化状态[9]。
AmRosea1是从金鱼草(Antirrhinum majus)中分离出来的R2R3-MYB转录因子,同时过表达Am-Rosea1和AmDelila基因,可以使橙色的胡萝卜(Daucus carota)或番茄(Solanum lycopersicum)变为紫色[10]。因此对Rosea1基因及黄酮类代谢物合成途径的节点酶基因IF7MAT、FG2、DFR、ANS、BZ1进行定量检测,可以进一步确定Rosea1基因在不同光信号下对转基因杨树的花青素合成的调控机理。本研究团队前期在84K 杨(Populus alba×P.glandulosa‘84K’)中过量表达AmRosea1基因,共获得13 个转基因株系,且生长在自然光下的高表达转基因株系植株呈现红色,矢车菊素、飞燕草素、芍药花素和天竺葵素相关代谢产物和总花青素含量较高[11]。然而,光信号引起AmRosea1过表达84K 杨植株颜色变化的原因还尚不清晰。因此,本研究以野生型和AmRosea1过表达84K 杨为试验材料,开展不同光强和光质下野生型和转基因株系生理特性和基因表达分析,研究结果为解析光信号激活AmRosea1过表达84K杨花青素生物合成通路的机制奠定理论基础,也为其他彩叶木本植物的创制提供参考。
1 材料与方法
1.1 材料
光强处理试验材料:东北林业大学林木遗传育种国家重点实验室获得的野生型84K 杨(命名为WT)和3 个过表达AmRosea184K 杨(命名分别为A-3、A-10 和A-24)。将在生根培养基(1/2 MS+0.10 mg·L-1IBA+0.01 mg·L-1NAA+20.00 g·L-1蔗糖,pH=5.8)中培养30 d 左右的无菌苗转移至土壤基质(V(营养土)∶V(蛭石)∶V(珍珠岩)=3∶2∶1)中培养30 d,培养条件为16 h 光照/8 h 黑暗,温度约为22 ℃,空气湿度为50%~60%,光量子通量密度约为110 μmol·m-2·s-1。而后转移至自然光下培养30 d,此时日平均光量子通量密度约为1 000 μmol·m-2·s-1。每个株系15 株苗,取功能叶为试验材料。
光质处理试验材料:将在生根培养基中培养30 d 左右的WT、A-3、A-10 和A-24 无菌苗转移至土壤基质中,分别在LED 红光、蓝光、红蓝光照射下培养30 d,培养条件为16 h 光照/8 h 黑暗,温度约为22 ℃,空气湿度为50%~60%。其中,LED 红光波长为610~650 nm,光量子通量密度为28 μmol·m-2·s-1;LED 蓝光波长为460~490 nm,光量子通量密度为83 μmol·m-2·s-1;红蓝光的光量子通量密度为53 μmol·m-2·s-1。每个株系15 株苗,取功能叶为试验材料。
试剂:无水乙醇、甲醇、盐酸、蒽酮、PBS 粉末、过氧化氢均购于国药集团化学试剂有限公司。无水葡萄糖购自上海阿拉丁生化科技股份有限公司,愈创木酚购自上海阿拉丁生化科技股份有限公司,RNA 提取试剂盒购自北京天根生化科技有限公司,反转录试剂盒和荧光染料购自北京宝日医生物技术有限公司。
1.2 方法
1.2.1 光强及光量子通量密度测定
光强及光量子通量密度测定分别应用得力照度计(DL333204,中国)和LI-COR 便携式光合作用测定系统(Li-6400,美国)进行测定。
1.2.2 花青素含量的测定
花青素的提取在Wang 等[12]的方法上进行改良:称取0.1 g样品,液氮研磨后加入1 mL 1%盐酸-甲醇溶液,32 ℃震荡5 h(100 r·min-1,避光),10 000 r·min-1离心5 min,稀释5 倍后测定530、657 nm 下的吸光值,每种测定重复3 次,则花色苷质量分数(ω(CA),mg·g-1)为:
式中:A为各波长下的吸光值,V为提取液体积(mL),D为稀释倍数,W为样品鲜质量(g)。
1.2.3 叶绿素含量的测定
叶绿素的提取在国庆[13]的方法上进行改良:称取0.1 g 样品,液氮研磨后加入1.8 mL 无水乙醇混匀,25 ℃浸提24 h(100 r·min-1,避光),10 000 r·min-1离心10 min,取200 μL 测定645、663 nm 处的吸光值,每种测定重复3 次,则叶绿素质量分数(ω(Chl),mg·g-1)为:
式中:A为各波长下的吸光值,V为提取液体积(mL),D为稀释倍数,W为样品鲜质量(g)。
1.2.4 可溶性糖含量的测定
标准曲线的绘制:称取0.1 g 无水葡萄糖溶于蒸馏水中,定容至100 mL,稀释10 倍(100 mg·L-1)备用;称取0.1 g 蒽酮溶于100 mL 80%浓硫酸,备用。取1mL 20、40、60、80、100 mg·L-1的葡萄糖溶液,各加入5 mL 蒽酮试剂,沸水水浴10 min,冷却后测定620 nm处的吸光值,绘制标准曲线[14]。
采用改良后的蒽酮比色法测定可溶性糖含量[14]:称取0.08 g 样品加入0.8 mL 去离子水,沸水浴20 min,冷却至室温后8 000 r·min-1离心3 min备用。取20.0 μL 添加980.0 μL 去离子水和5 mL蒽酮试剂,沸水浴10 min,冷却后测定620 nm 处的吸光值,则可溶性糖的质量分数(ω(Ss),%)为:
式中:C为标准曲线中查到的可溶性糖含量(μg),D为稀释倍数,W为样品鲜质量(g)。
1.2.5 过氧化物酶活性的测定
采用改良后的愈创木酚法测定过氧化物酶的活性[15]:称取0.2 g 样品,加入5 mL 预冷的PBS(0.01 mol·L-1,pH=7.8),旋涡振荡后4 ℃下12 000g离心10 min 备用。取400 μL 上清液依次加入400 μL 0.1 mol·L-1愈创木酚、400 μL 0.1 mol·L-1PBS 和400 μL 0.8% H2O2,充分混匀后30 ℃水浴10 min,取200 μL 测定470 nm 处的吸光值(A470),则超氧化物歧化酶(POD)(U·mg-1)为:
式中:D为稀释倍数,T为反应时间(min),W为样品鲜质量(g)。
1.2.6 总RNA的提取和基因表达量检测
提取野生型和转基因株系A-3 的总RNA,使用2%琼脂糖凝胶分离,检测样品完整性。取1 μg样品反转录成cDNA,稀释10 倍后,使用ABI7500实时荧光定量PCR 仪进行扩增。其中总RNA 的提取和反转录严格按照说明书进行,qRT-PCR 的体系、程序及计算参见国庆[13]的方法。qRT-PCR引物序列见表1。
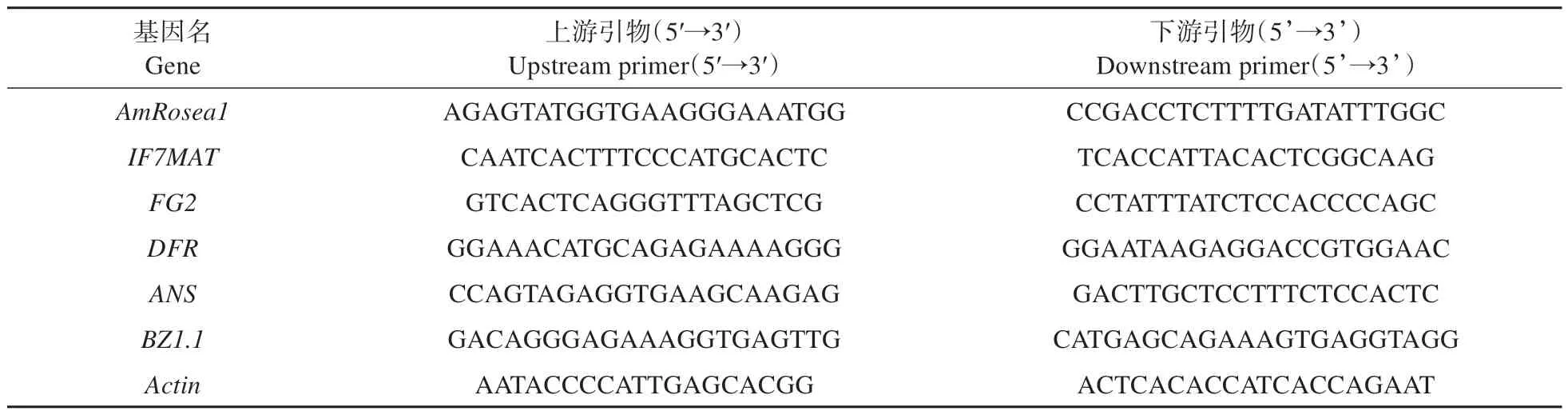
表1 qRT-PCR引物序列Table 1 qRT-PCR primer sequences
1.3 数据分析
采用Excel 和SPSS 16.0 对数据进行统计分析。使用邓肯(Duncan)法进行多重比较,所有数据采用平均值±标准差表示,不同字母和*代表差异达到显著水平(P<0.05),**代表差异达到极显著水平(P<0.01)。
2 结果与分析
2.1 不同光强下AmRosea1过表达84K杨生理特性分析
不同光强下AmRosea1过表达84K杨表型观察发现,与LED 光相比,自然光下的AmRosea1过表达84K杨植株呈现红色(图1)。

图1 不同光强下AmRosea1过表达84K杨表型A.LED光下野生型和转基因株系的表型;B.自然光下野生型和转基因株系的表型Fig.1 Phenotypes of AmRosea1 overexpression 84K poplar under different light intensity A.Phenotypes of wild type and transgenic lines under LED light;B.Phenotypes of wild type and transgenic lines under natural light
生理特性分析显示,无论是LED 光还是自然光条件,转基因株系A-3、A-10 和A-24 花青素含量均高于野生型WT,且自然光下的差异达到显著水平(P<0.05),其分别为LED 光的12.00、8.39、11.47倍(见图2A)。LED光下野生型和转基因株系的叶绿素含量没有明显差异,但是在自然光下,野生型和转基因株系的叶绿素含量降低,各株系间的差异未达到显著水平(见图2B)。POD活性和可溶性糖含量结果显示,与LED 光相比,自然光下3 个转基因株系POD 活性降低,可溶性糖含量升高,分别为LED 光的0.78、0.49、0.65 倍和1.44、1.68、1.44 倍(见图2C~D)。综上所述,光照强度的增强,使转基因株系叶片变红,花青素含量和可溶性糖含量明显增多,但叶绿素含量和POD活性明显降低。

图2 不同光强下AmRosea1过表达84K杨生理特性Fig.2 Physiological characteristics of AmRosea1 overexpression 84K poplar under different light intensity
2.2 不同光强下AmRosea1过表达84K杨基因表达分析
不同光强下AmRosea1过表达84K杨基因表达分析显示,LED 光下,转基因株系A-3 中AmRosea1、IF7MAT、FG2、DFR、ANS和BZ1.1基因的表达量均明显高于野生型WT,分别为WT 株系的351.8、4.2、14.8、3.38、1.36、20.8倍(见图3A~F)。
在自然光下,DFR基因表达量极显著低于野生型WT(P<0.01)(见图3),其他基因的表达量均极显著高于WT 株系(P<0.01),分别为WT 株系的404.60、4.29、77.70、3.37、101.10 倍,(图3:A~C,E~F)。同时,除DFR 基因外,自然光下的基因表达量均高于LED 光下。综上所述,光照强度的增强显著增强了转基因株系中AmRosea1、IF7MAT、FG2、ANS和BZ1.1基因的表达。
2.3 不同光质下AmRosea1过表达84K杨生理特性分析
本研究对A-24、A-10、A-3 转基因株系进行LED 红光、蓝光、红蓝光处理。均取同一部位的功能叶(第3片叶片)进行表型观察发现,LED红蓝光处理30 d后转基因株系叶片呈现红色(见图4)。
生理特性分析显示,无论LED 红光、蓝光、红蓝光处理10 d 还是30 d,转基因株系花青素含量均高于野生型株系,且除LED 红光处理30 d外,其他处理间差异均达到显著水平(P<0.05)。LED 红蓝光处理后30 d 后,转基因株系A-3、A-10 和A-24花青素含量升高最为明显,其分别为LED 红光处理的4.58、3.62、2.42 倍,为LED 蓝光处理的3.53、2.41、1.84 倍,为LED 红 蓝 光 处 理10 d 的3.80、2.56、1.94 倍(见图5A)。LED 红光、蓝光处理10 d的各转基因株系和野生型间叶绿素含量变化差异不显著,处理30 d 后各转基因株系和野生型叶绿素含量变化无明显规律,且处理10 d 和30 d 相比,各株系叶绿素含量也无明显变化;但LED 红蓝光处理30 d 后,转基因株系叶绿素的含量微量降低,分别为处理10 d 的0.83、0.90 和0.88 倍(见图5B)。POD 活性结果显示,与LED 红光、蓝光和红蓝光处理10 d 相比,处理30 d 后各株系POD 活性明显降低(LED 蓝光处理30 d的WT株系除外),且转基因株系的POD 活性均低于野生型株系,其中,LED 红蓝光处理30 d 后,各株系POD 活性下降最为明显(见图5C)。可溶性糖含量结果显示,与LED 红光、蓝光和红蓝光处理10 d 相比,处理30 d 后各株系可溶性糖含量明显降低,LED 红光和蓝光处理30 d 后,各转基因株系的可溶性糖含量均低于野生型株系,而LED 红蓝光处理30 d 后各转基因株系的可溶性糖含量高于野生型,与LED 红蓝光处理10 d 时表现出相反的趋势(见图5D)。综上所述,与LED 红光和蓝光相比,LED 红蓝光诱导下,转基因株系叶片变红,且其花青素含量升高,可溶性糖含量和POD 活性下降,叶绿素含量微量降低。
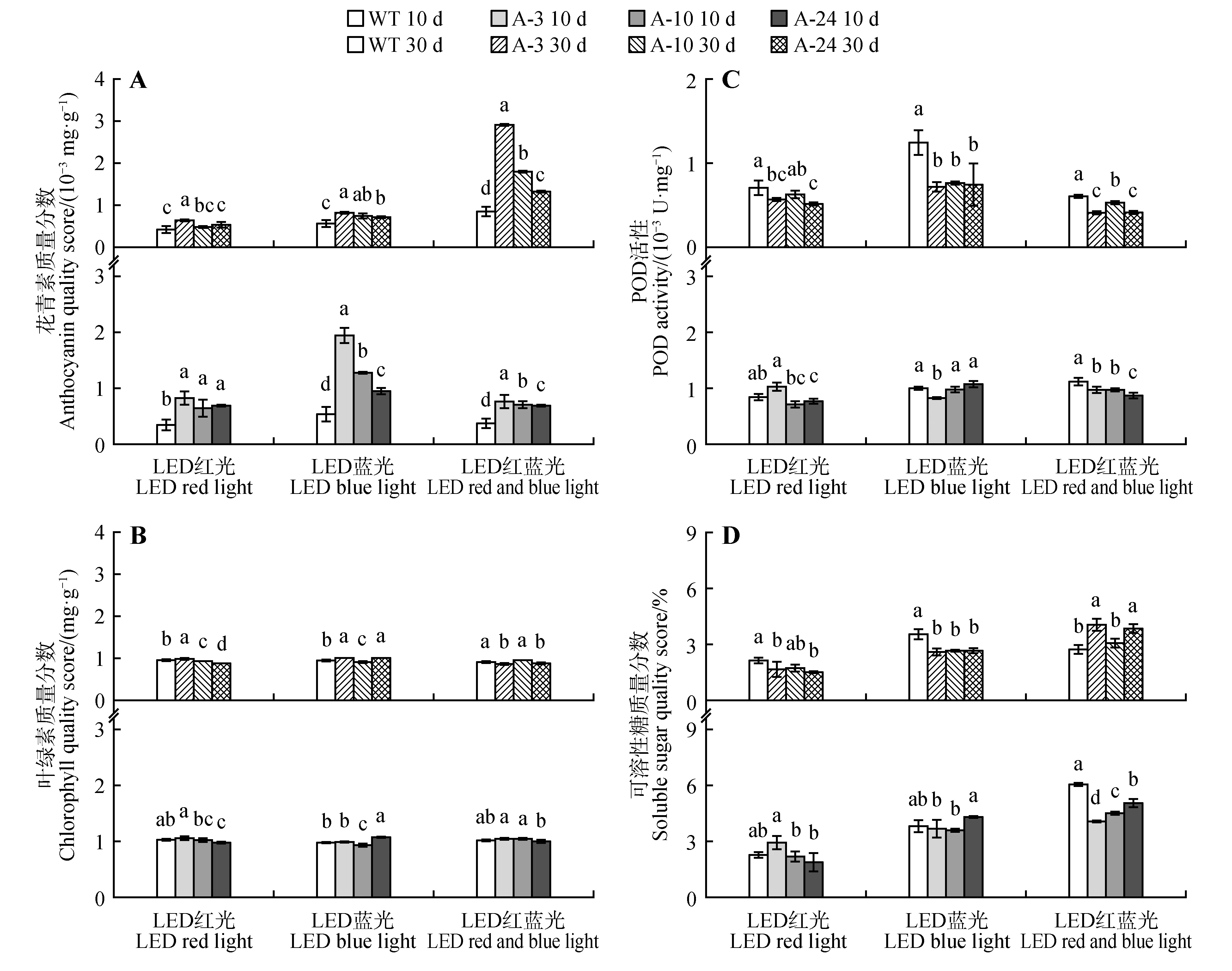
图5 不同光质下AmRosea1过表达84K杨生理特性次坐标轴指示培养30 d时各株系的变化Fig.5 Physiological characteristics of AmRosea1 overexpression 84K poplar under different light quality
2.4 不同光质下AmRosea1过表达84K杨基因表达分析
不同光质下AmRosea1过表达84K杨基因表达分析显示,LED 红光处理10 、30 d 后,转基因株系A-3 中AmRosea1、IF7MAT、FG2、DFR、ANS、和BZ1.1的基因表达量均高于野生型WT,处理10 d后A-3 中各基因表达量分别为WT 的1 219.70、3.51、122.15、2.29、1.67、33.26 倍;处理30 d 后A-3中各基因表达量分别为WT 株系的2 311.90、3.37、1 879.81、2.81、3.59、206.30 倍,但AmRosea1和IF7MAT的基因表达量低于处理10 d(见图6)。
LED 蓝光处理10 d 后,除ANS基因外(见图7E),A-3 中其他各基因的表达量均极显著高于WT 株 系(P<0.01),分 别 为WT 株 系 的748.19、8.33、50.46、8.01、652.91 倍。LED 蓝光处理30 d后,与WT 株系相比,A-3 株系中DFR基因表达量下调,为其0.66 倍(见图7D),其余各基因表达量均极显著高于WT 株系(P<0.01),分别为WT 株系的3059.52、1.44、219.0、4.10、630.86 倍(见图7:A~C,E~F)。
LED 红蓝光处理10 d 后,转基因株系A-3 中AmRosea1、IF7MAT、FG2和BZ1.1基因的表达量均高于WT 株系,分别为WT 株系的1 261.30、2.28、125.72、282.69 倍(见图8:A~C,F),而DFR和ANS基因的表达量则低于WT,分别为其0.05 倍和0.51倍(图8D~E)。LED 红蓝光处理30 d 后,除ANS基因表达量略低于WT 株系外(图8E),A-3株系中其余基因的表达量均高于WT株系,分别为WT株系的2 311.90、2.78、65.13、345.37、653.59 倍(图8A~D,F)。综上所述,LED 红光促进A-3 株系中FG2、DFR、ANS和BZ1.1基因的表达,抑制AmRosea1和IF7MAT基因 的表 达;LED 蓝 光 促进A-3 株 系 中AmRosea1、FG2、ANS和BZ1.1基因的表达,抑制IF7MAT和DFR基因的表达;LED 红蓝光则能促进A-3 株系中AmRosea1、IF7MAT、DFR、ANS和BZ1.1基因的表达,抑制了FG2基因的表达。
3 讨论
花青素是一类广泛存在植物中的水溶性色素物质,种类繁多,能赋予植物丰富多彩的颜色,并能提高植物抗氧化能力[16]。花青素生物合成通路是研究的较为清楚的植物次生代谢产物之一,通路中的终产物、中间产物、结构基因等已经很好地被阐述,其中的转录因子参与的调控关系和分子机制也不断被完善[17]。研究发现,低温、细胞分裂素、生长素、乙烯和茉莉酸等处理能促进花色素的合成,褪黑素则能抑制花青素的合成[18]。光照作为常见的环境因子,不仅为植物生长提供能量,也是调控植物花青素生物合成的重要因素之一。
光信号影响植物花青素的积累体现在光照强度上。强光能促进绿豆、小麦(Triticum aestivum)等作物合成花色苷,也能促进苹果等树木合成花色苷,进而引起植物颜色变化[3,5]。强光能促进红叶大头芥(Brassica juncea)花青素生物途径中DFR和ANS基因的表达[19]。本研究发现,自然光下激活AmRosea1过 表 达84K 杨 中AmRosea1、ANS和BZ1.1基因的表达,促进了转基因株系中花青素的生物合成,致转基因株系中花青素大量积累,植株叶片变红(图1B)。同时,自然光处理下IF7MAT和FG2基因也大量表达,这表明强光也同时激活了转基因株系的黄酮和异黄酮生物合成通路。叶绿素含量和可溶性糖含量的测定结果显示,花青素含量与叶绿素含量呈负相关,而与可溶性糖含量呈正相关,这些结果与大叶榉树(Zelkova schneideriana)的研究结果[20]一致,笔者推测,在强光的诱导下,花青素大量合成的同时伴随着叶绿素的不断分解,而可溶性糖作为花色苷合成的信号因子,对花青素的积累有明显的促进作用[21]。POD 是与植物次生代谢密切相关的一个重要的酶,能够有效清除植物体内堆积的活性氧[9]。目前已知,花青素作为植物体内的抗氧化的代谢物之一,其同样能够清除植物体内的活性氧。本研究发现,随着光强的升高,野生型株系POD 活性和花青素含量相差不大,但转基因株系中花青素含量大量提高,POD 活性明显下降,说明花青素的大量合成清除了植物体内产生的活性氧,降低了POD的作用,使POD活性下降[9]。
光信号影响植物花青素的积累也体现在光质上。蓝光能激活芹菜(Apium graveolens)和桔梗(Platycodon grandiflorum)DFR、ANS等基因表达,促进花青素合成与积累[22-23];在不同品系马铃薯(Solanum tuberosum)的研究中,红光提高了“黑金刚”的花青素含量,蓝光则降低了“黑美人”的花青素含量[24],这些结果表明光质对花青素的影响多与植物种类或基因型有关。本研究发现,仅有LED 红蓝光处理30 d 后的叶片存在明显的表型,且花青素的含量也高于LED 红光及蓝光的处理,说明LED 红蓝光处理增强了转基因株系的花青素含量,同时影响了可溶糖含量及POD 活性含量,分别呈现上升及下降的趋势,与光强试验的结果一致。此外,强光和红蓝光质下,叶绿素/花青素含量的比值较小,也是导致植株叶片颜色变化的主要原因[25]。在基因表达量上,LED 红蓝光处理诱导了AmRosea1、IF7MAT、DFR、ANS和BZ1.1基因的表达,结合3 种光质的处理结果,笔者推测,IF7MAT、BZ1.1基因对花青素的积累起积极的调控作用。
综上,本研究以野生型和AmRosea1过表达84K 杨为试验材料,探究了不同光强和光质处理下转基因株系的表型、生理特性和基因表达差异,证实了强光照和红蓝光能够促进AmRosea1过表达84K 杨花青素的积累并使植株叶片颜色变红,为深入揭示光信号激活AmRosea1过表达84K杨花青素生物合成通路的机制提供了理论依据。后续将通过ChIP-seq、酵母单杂等试验,探究不同光强和光质下AmRosea1下游靶基因的差异,解析光信号介导下AmRosea1 转录因子在84K 杨中的调控关系,进一步阐明光信号调控花青素生物合成的分子机制,为其他彩叶木本植物的创制奠定基础。
4 结论
光信号会激活AmRosea1过表达84K杨的花青素生物合成通路。自然光及红蓝光处理下,均能激活84K 杨花青素的生物合成,但由于自然光的光强及光通量密度都明显高于其他光质,说明红蓝光是花青素生物合成不可或缺的光质,光强是影响花青素生物合成的重要因素。

