逆境胁迫下山新杨PdbHMGs基因表达模式分析
王春瑶 雷晓锦 刘中原
(林木遗传育种国家重点实验室,东北林业大学,哈尔滨 150040)
1973 年,在牛胸腺细胞中第一次发现了1 种在聚丙烯酰胺凝胶电泳(PAGE)中泳动速度很快的蛋白——高迁移率族蛋白(high mobility group,HMG)[1]。HMG 蛋白根据其DNA 结构特点分成3 组:HMGA、HMGB 和HMGN[2]。其中,HMGB 存在数量最多,平均每10~15 个核小体中含有1 个HMGB 分子[3],HMGA 主要分布在早期胚胎组织中,HMGN广泛分布于细胞核[4]。
HMGB 是一类存在于真核生物中且包含1 个由70~80 个氨基酸组成的高度保守结构域(HMGbox)的功能蛋白。通常HMGB 可以通过修饰或改变染色质或DNA 的结构,使不同种类的蛋白质分子形成大分子复合物来调控基因转录,从而在动、植物中参与多种生物途径发挥不同生物学功能[5]。
已有报道发现,在动物中存在与肿瘤细胞的增殖和转移相关的HMGB基因。当小鼠HMGB1基因被敲除后,会导致其生命力急速衰退,在出生后不久就死亡,说明HMGB 蛋白在维持小鼠的生命活动中发挥重要作用[6]。与此同时,发现HMGB与肝癌的形成和发展有关,当小鼠HMGB1的表达量降低时,会抑制肝癌细胞的增殖能力[7]。
植物中,HMGB 蛋白已陆续在拟南芥(Arabidopsis thaliana)[8]、水稻(Oryza sativa)[9]、玉米(Zea mays)[10]、裂叶牵牛(Ipomoea nil)[10]、黄瓜(Cucumis sativus)[10]和豌豆(Pisum sativum)[11]等中被鉴定与分离,随着研究的不断深入,发现HMGB 是植物生命活动中必不可少的一类功能蛋白。如拟南芥AtHMGB15 可通过与花粉转录因子AGL66 和AGL104 发生作用,进而调控花粉管的生长发育[12]。在牵牛花中,PnHMG1基因的表达与光周期的变化息息相关,主要在牵牛花的开花过程中发挥作用[10]。此外,HMGB基因在植物抵御逆境胁迫的过程中同样扮演着关键的角色。如在拟南芥中,当受到干旱和盐胁迫时,AtHMGB2和AtHMGB3的 表 达 量 显 著下 调[13]。AtHMGB1和AtHMGB2的过表达都能使高盐环境下的种子萌发及生长受阻;在冷处理下,AtHMGB2、AtHMGB3和AtHMGB4的表达量显著上调[14]。在高温和干旱等非生物胁迫下,水稻OsHMGB3基因的表达被显著诱导,OsHMGB3的过表达极大地提高了水稻对渗透胁迫的抵抗能力[9]。在木本植物中仅对白桦(Betula platyphylla)进行了研究,如过表达BpHMG6能显著增强白桦对高盐环境的耐受性[15]。
林木具有保持水土、减轻温室效应和净化空气等生态功能,在保持陆地生态平衡中起着关键的作用。杨树是我国减少土地荒漠化,退耕还林的优良树种之一[16],而山新杨(Populus davidiana×P.bolleana)作为山杨(P.davidiana)与新疆杨(P.albavar.pyramidalis)的杂交后代,凭借生长迅速,适应能力强,抗逆性好,防风固沙等性状,成为了我国优良的速生造林树种[17-18]。本研究从山新杨中通过对其序列特征的分析鉴定了 7 条PdbHMGs基因,并对这7个基因逆境胁迫后的表达模式进行了分析,为研究该家族在非生物胁迫下的功能奠定基础。同时,为杨树抗逆基因工程育种提供理论依据。
1 材料与方法
1.1 植物材料及处理方法
选取长势一致、状态优良的山新杨组培苗,待其生长至5 cm 左右时移栽到V(泥炭土)∶V(蛭石)=3∶1 的混合基质中,花盆规格为11 cm×10 cm,环境条件为光照14 h/黑暗10 h,平均温度为(23±1)℃、相对湿度为60%~70%、光照强度为400 μmol·m-2·s-1的温室中培养。待株高约为10 cm 时进行胁迫处理。分别用200 mmol·L-1NaCl、20%PEG6000、150 μmol·L-1CdCl2和100 μmol·L-1ABA 进行根部浇灌处理,每个托盘中浇2 L处理液,每2天处理1次。以清水浇灌的山新杨苗为对照,每个处理重复3次。在处理3、6、9、12、24、48 h后,分别取地上部分叶和地下部分根,经液氮速冻后,保存在-80 ℃用于后续试验。
1.2 山新杨PdbHMGs基因生物信息学分析
在山新杨基因组中通过拟南芥同源比对找到7条PdbHMGs基因的氨基酸序列;利用在线软件GSDS2.0(http://gsds.gao-lab.org/)分析PdbHMGs基因的内含子-外显子结构[19];利用Protparam(http://web/expasy/org/protparam/)分析获得山新杨PdbHMGs基因编码蛋白的相对分子质量和理论等电点等[20]。使用Expasy-Protscale(http://web.expasy.org/cgi-bin/protscale/)预测PdbHMG 蛋白的亲水性[21]。通过在线 软 件CELLO(http://cello.life.nctu.edu.tw/)对PdbHMG蛋白进行亚细胞定位预测[22]。利用MEME(https://meme-suite.org/meme/tools/meme)在线软件分析了PdbHMG蛋白的保守基序,并通过TBtools进行可视化处理[23]。通过拟南芥信息资源数据库TAIR网站(http://www.arabidopsis.org/)[24]查找出17条拟南芥AtHMGs蛋白序列,白桦中报道有11条BpHMGs 蛋白[15],BpHMGs 蛋白序列下载自Phytozome(https://phytozome-next.jgi.doe.gov/,Betula platyphylla v1.1),通过MEGA 6.0将这17个AtHMGs蛋白序列和11个BpHMGs蛋白与山新杨PdbHMGs蛋白序列进行系统进化分析,使用邻接法Neighbor-Joining(NJ)构建进化树,Bootstrap参数设置为1 000[25]。利用NCBI 的Conserve Domains(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)预测PdbHMG蛋白的保守结构域[25],并运用BioEdit 软件将山新杨PdbHMGs蛋白进行多序列比对分析。
1.3 山新杨PdbHMGs基因启动子区顺式作用元件分析
在山新杨基因组中查找获得PdbHMG家族基因起始密码子上游约2 000 bp 的序列作为启动子区。利用Plantcare 网站(http://bioinformatics.psb.ugent.be/webtools/plantcare/html)进行顺式作用元件预测分析[26]。
1.4 实时荧光定量RT-PCR
使用CTAB 法提取不同胁迫处理下山新杨叶和根的总RNA。取1 μg 总RNA 进行反转录,反转录反应体系和操作参照李亚博[27]的方法。将所有反转录产物cDNA 用作实时荧光定量RT-PCR 反应模板。选择内参基因Pdbactin(基因登录号:ON357379)作为对照,定量引物序列如下(表1)。使用伯乐公司生产的OpticonMonitor 2 荧光定量PCR 仪进行qRT-PCR 实验,qRT-PCR 的反应体系及程序同李亚博[27]。为确保实验结果的重现性,qRT-PCR 进行3次重复。利用2-△△Ct方法[28]对基因的相对表达量进行分析,图中所有基因的表达水平都进行了log2转化。

表1 实时荧光定量RT-PCR引物序列Table 1 The primer sequences of real-time quantitative RT-PCR
2 结果与分析
2.1 山新杨PdbHMGs基因的获得
通过拟南芥同源查找得到7 条山新杨PdbHMGs基因(命名为PdbHMG1~7),进一步序列比对发现这7 个基因具有完整的开放读码框(ORF)。开放读码框长度为456~2 004 bp,编码的氨基酸数量在151~667。预测蛋白相对分子质量为16.72~75.54 kDa,理论等电点(pI)为5.35~9.36。亚细胞定位的预测结果显示7 个PdbHMGs 蛋白除PbdHMG6 预测定位于细胞质,其余6 个蛋白均定位在细胞核(表2)。分析PdbHMGs基因的外显子-内含子结构,发现7 个PdbHMGs基因都包含多个内含子。其中,PdbHMG6包含的内含子数最多(18 个),其余几个PdbHMGs基因包含的内含子数在5~7 个(图1)。对PdbHMG 蛋白的亲疏水性进行了预测分析,由图2 可知,所有PdbHMG 蛋白均为亲水性蛋白。
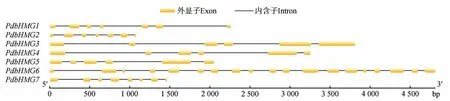
图1 山新杨PdbHMGs家族基因内含子-外显子结构Fig.1 Exon-intron structure of PdbHMGs genes
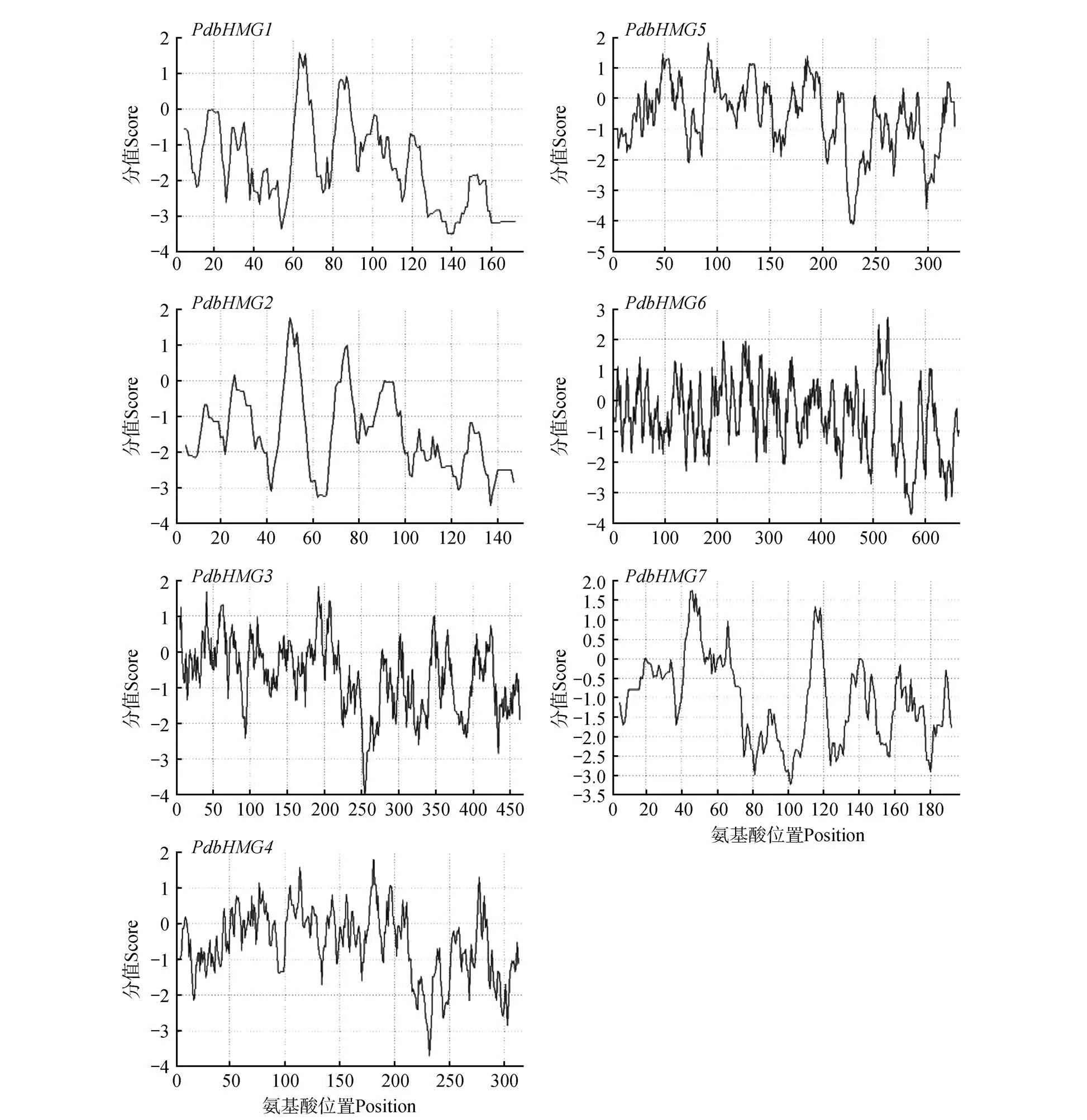
图2 山新杨PdbHMG蛋白亲水性Fig.2 Hydrophilic analysis of PdbHMG proteins
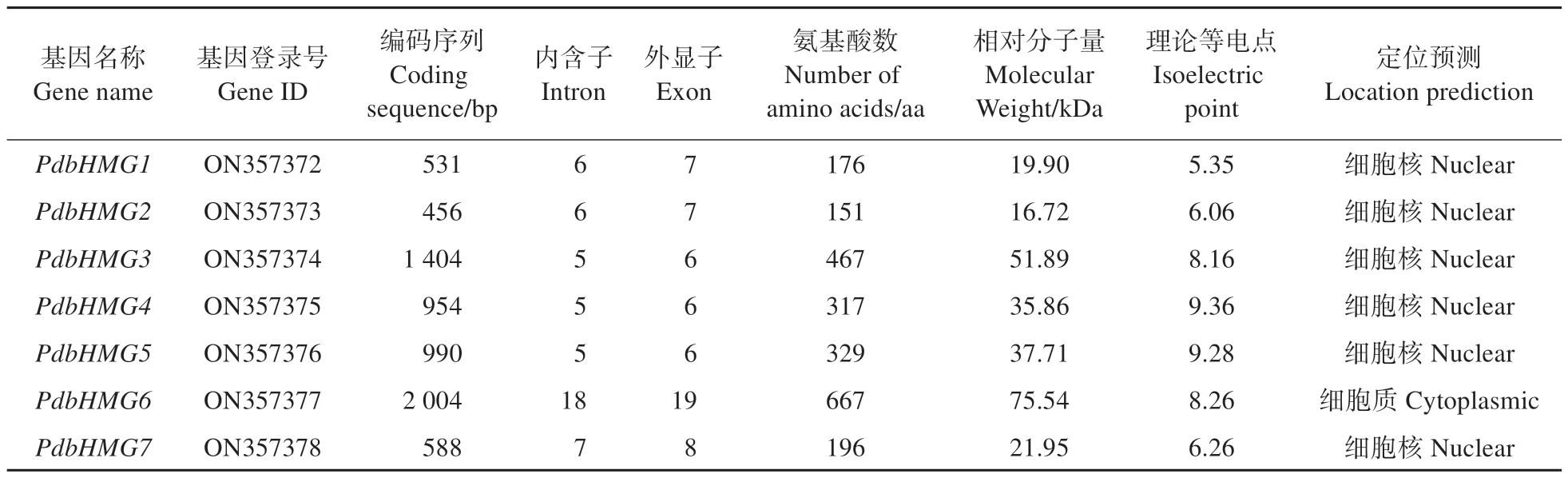
表2 山新杨7个PdbHMGs基因序列特征Table 2 Sequence characteristics of 7 PdbHMGs in Populus davidiana×P. bolleana
2.2 PdbHMG 蛋白多序列比对和系统进化树分析
拟南芥AtHMGs 分为HMGA 和HMGB 2 个亚家族,所有山新杨PbdHMGs基因均与拟南芥的HMGB亲缘关系更近,均聚在HMGB亚家族(图3)。保守结构域分析和多序列比对结果显示,所有PbdHMG 蛋白均含有1 个HMG-box 保守结构域(图4),其中PdbHMG1和PdbHMG2相似度更高(图5)。
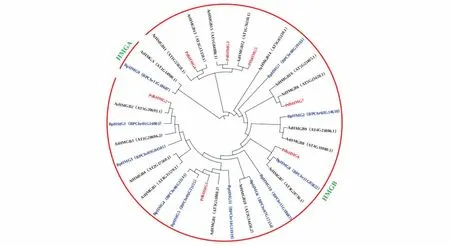
图3 山新杨PdbHMGs与拟南芥AtHMGs、白桦BpHMGs成员的系统进化关系Fig.3 Phylogenetic relationship among PdbHMGs,AtHMGs with BpHMGs

图4 山新杨PdbHMGs蛋白保守结构域Fig.4 Conserved domain of PdbHMGs protein

图5 PdbHMGs蛋白HMG-box结构域Fig.5 HMG-box domain of PdbHMGs protein
利用在线网站MEME[23]对山新杨PdbHMG 家族蛋白的保守基序进行分析。结果显示,7个PdbHMG 蛋白的HMG-box 保守结构域均包含Motif1 和Motif2。此外,PdbHMG3、PdbHMG4 和PdbHMG5除包含Motif1 和Motif2 外,还包含Motif 3、4、6、8,且Motif 位置分布相似,推测PdbHMG家族基因编码的蛋白在具有保守性的同时,也会在功能上存在多样性(图6)。
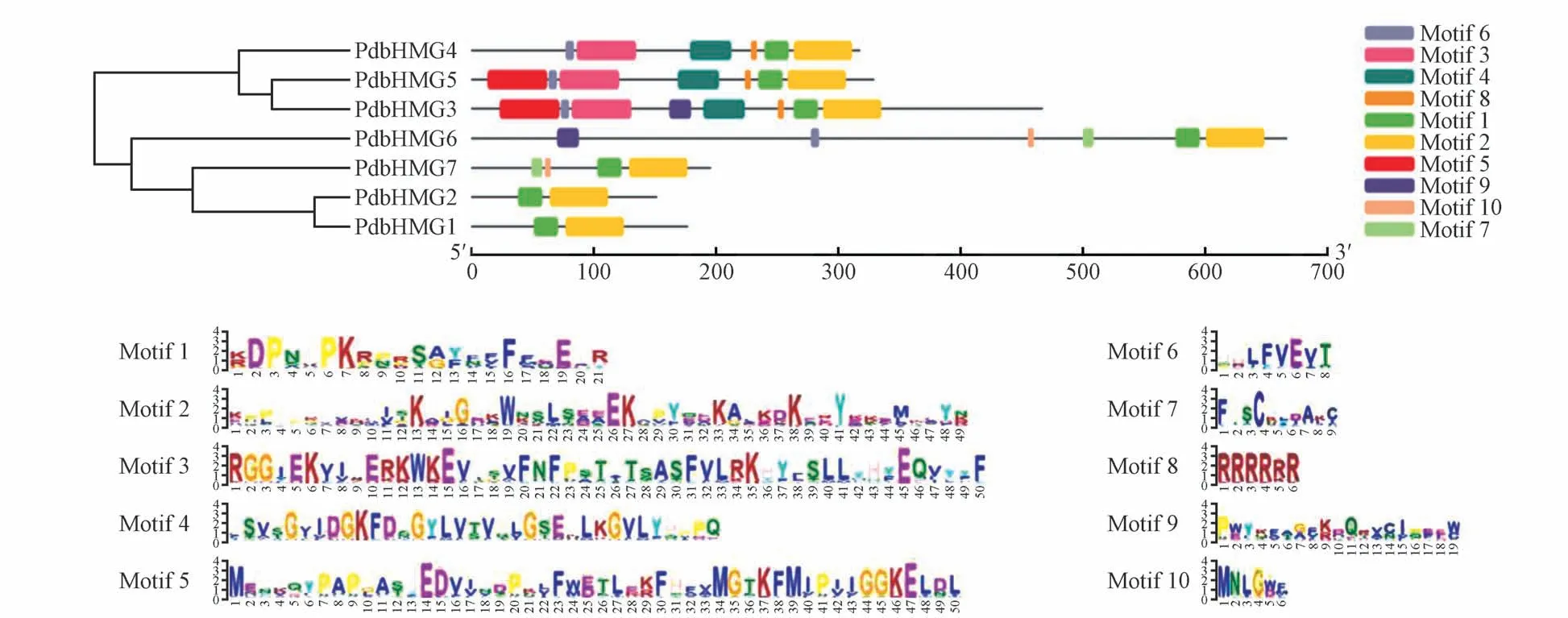
图6 PdbHMG家族蛋白保守基序分析Motif 1~10用不同的颜色表示,Motif 1~10序列展示在下方Fig.6 The protein conserved motif analysis of PdbHMG family Motif 1-10 indicated by different colors.The sequences of the motifs 1-10 were shown below
2.3 山新杨PdbHMGs基因启动子特征分析
通过Plantcare数据库,分析了PdbHMGs基因启动子区的顺式作用元件[26]。结果发现,在PdbHMGs的启动子区包含了大量的响应植物激素和非生物胁迫的元件。包括与脱落酸、生长素、水杨酸、茉莉酸甲酯、赤霉素和乙烯相关的激素响应元件;以及与非生物胁迫响应相关的胁迫响应元件、损伤反应元件、厌氧诱导元件和MYB干旱诱导性结合位点(表3)。上述结果表明,PdbHMGs可能在植物生长发育及对逆境胁迫的应答过程中发挥关键作用。
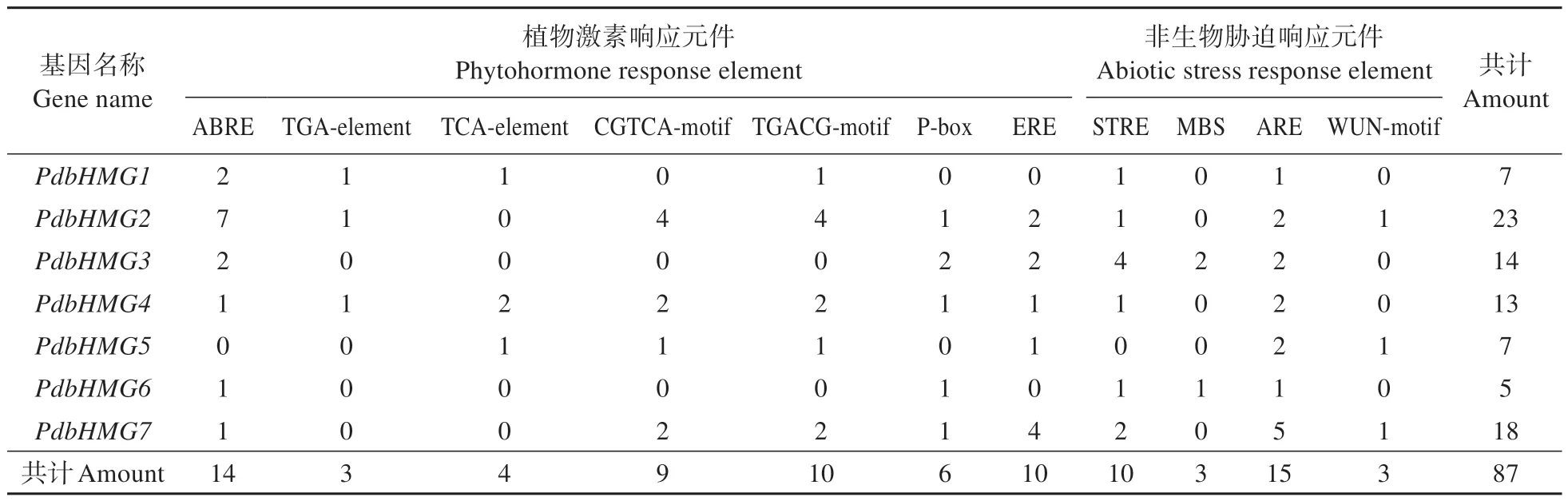
表3 PdbHMGs基因启动子区顺式作用元件Table 3 Analysis of cis acting elements in promoter region of PdbHMGs
2.4 山新杨PdbHMGs基因应答逆境胁迫表达模式分析
为了解PdbHMG1~7基因是否能对非生物胁迫做出应答,分别用NaCl、PEG6000、CdCl2和ABA 处理山新杨,利用qRT-PCR 分析根和叶中7 个PdbHMGs基因的表达模式。
2.4.1 NaCl 处理下山新杨PdbHMGs基因表达模式分析
在根中,PdbHMG3、PdbHMG5的表达在所有时间点均显著上调,其他基因在大部分时间点表现为下调表达趋势,但PdbHMG2在12 h 时表达明显上调(210.47倍)。PdbHMG7在12 h时表达也被明显诱导,为对照的29.87 倍,其他时间点表达量显著下调。PdbHMG1和PdbHMG6在4 个胁迫时间点表达显著下调,在其他时间点表达显著上调或无显著变化。PdbHMG4在除3 h 外的其他胁迫时间点表达显著下调或无显著变化(<2倍)(图7a)。
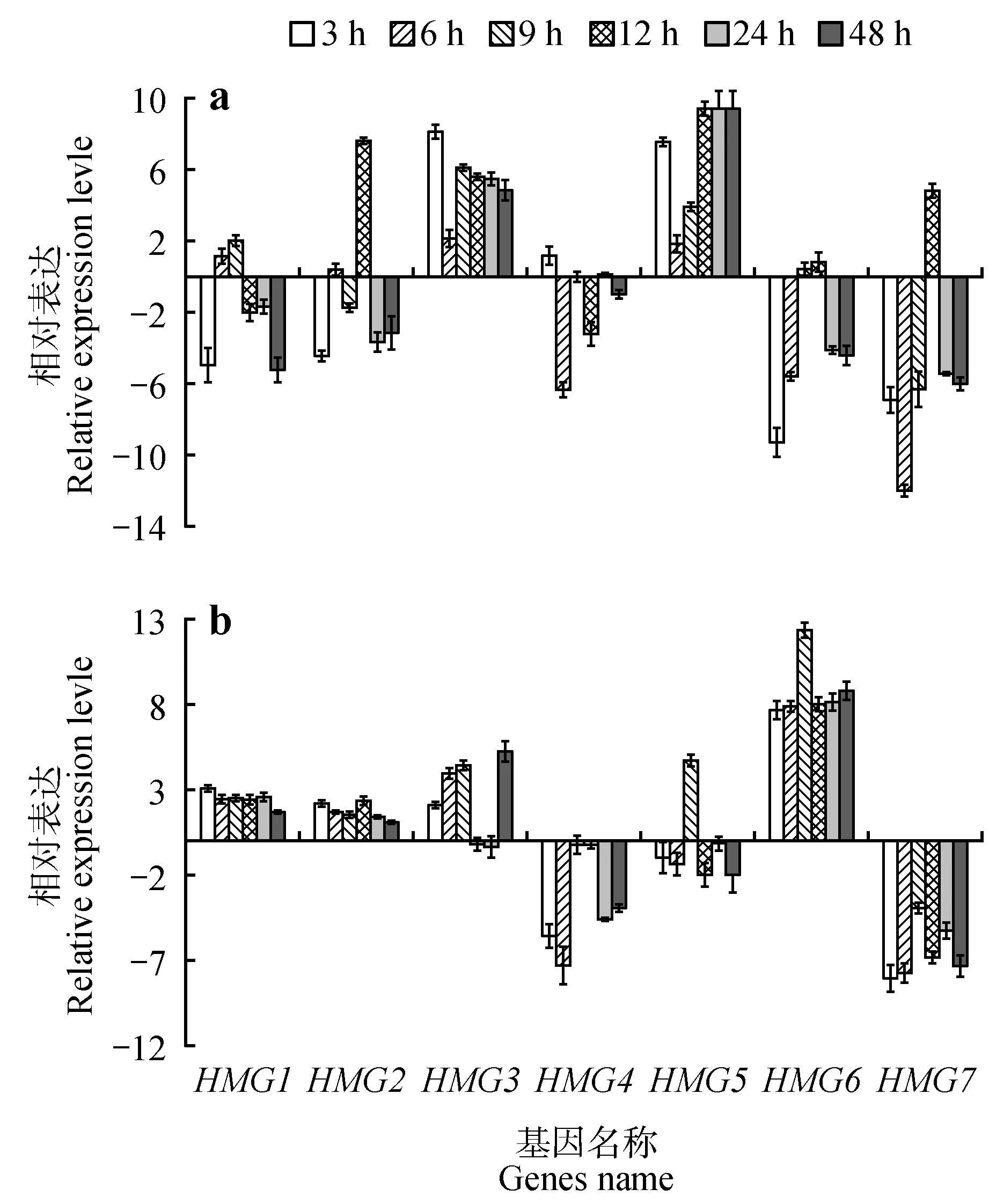
图7 NaCl胁迫处理下山新杨PdbHMGs基因表达模式a.根;b.叶;图中所有基因的表达水平都进行了log2转化Fig.7 Expression analysis of PdbHMGs under NaCl stress.a.Roots;b.Leaves;All relative transcription levels of genes were log2 transformed
在叶中,大部分的PdbHMGs基因,包括PdbHMG1、PdbHMG2、PdbHMG3和PdbHMG6的表达在所有胁迫时间点上均有不同程度的上调或无显著变化。而PdbHMG4和PdbHMG7的表达则表现在全部时间点显著下调或无明显变化。PdbHMG5的表达在9 h 时显著上调,为对照的26.02 倍,在其他时间点呈下调表达或无显著变化(图7b)。
2.4.2 PEG6000处理下山新杨PdbHMGs基因表达模式分析
在 根 中,PdbHMG1、PdbHMG3、PdbHMG4、PdbHMG5在大部分胁迫时间点显著上调,但PdbHMG4在48 h 表达显著下调,仅为对照的2.06%,PdbHMG1和PdbHMG2在胁迫12 h 时被明显下调,分别为对照的17.29%和1.47%,PdbHMG3在胁迫9 h 时被明显下调,为对照的8.55%。而PdbHMG6和PdbHMG7则在全部时间点表达量显著降低或无明显变化(图8a)。
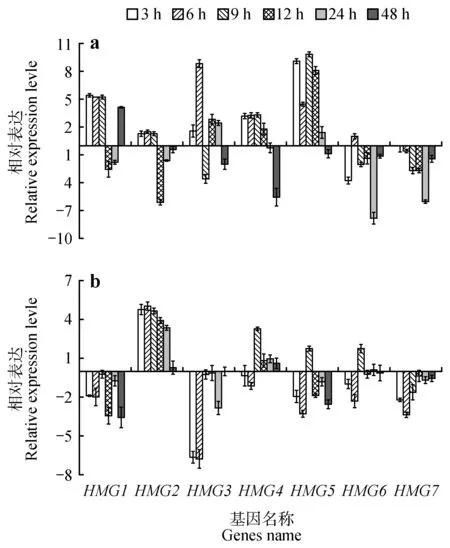
图8 PEG6000胁迫处理下山新杨PdbHMGs基因表达模式a.根;b.叶Fig.8 Expression analysis of PdbHMGs under PEG6000.a.Roots;b.Leaves
在叶中,PdbHMG2的表达,除48 h表达量变化不明显外,其他胁迫时间点均显著上调,最高表达水平出现在胁迫初期(6 h),达到对照的33.63 倍。PdbHMG4、PdbHMG6在6 h 时显著下调(分别为对照的46.22%、20.31%),在9 h 时被显著诱导(分别为对照的9.98 倍、3.52 倍),其他时间的表达量无明显变化。而其他基因在大部分时间点表现为下调表达趋势,但PdbHMG5在9 h 时被显著诱导,为对照的3.42倍(图8b)。
2.4.3 CdCl2处理下山新杨PdbHMGs基因表达模式分析
在根中,PdbHMG1和PdbHMG7的表达在大部分的胁迫时间点显著下调或无显著变化(除PdbHMG1在24 h 显 著 上 调,PdbHMG7在12 h 显 著 上调)。其他基因主要表现为上调表达趋势。特别的是,PdbHMG3、PdbHMG5在胁迫9 h 表达显著下调,分别为对照的21.14%、29.80%。PdbHMG2在胁迫中期表达显著上调,其他时间点表达量变化小。PdbHMG6大部分胁迫时间点显著上调或无显著变化且在胁迫初期(3~6 h)就被明显诱导(图9a)。
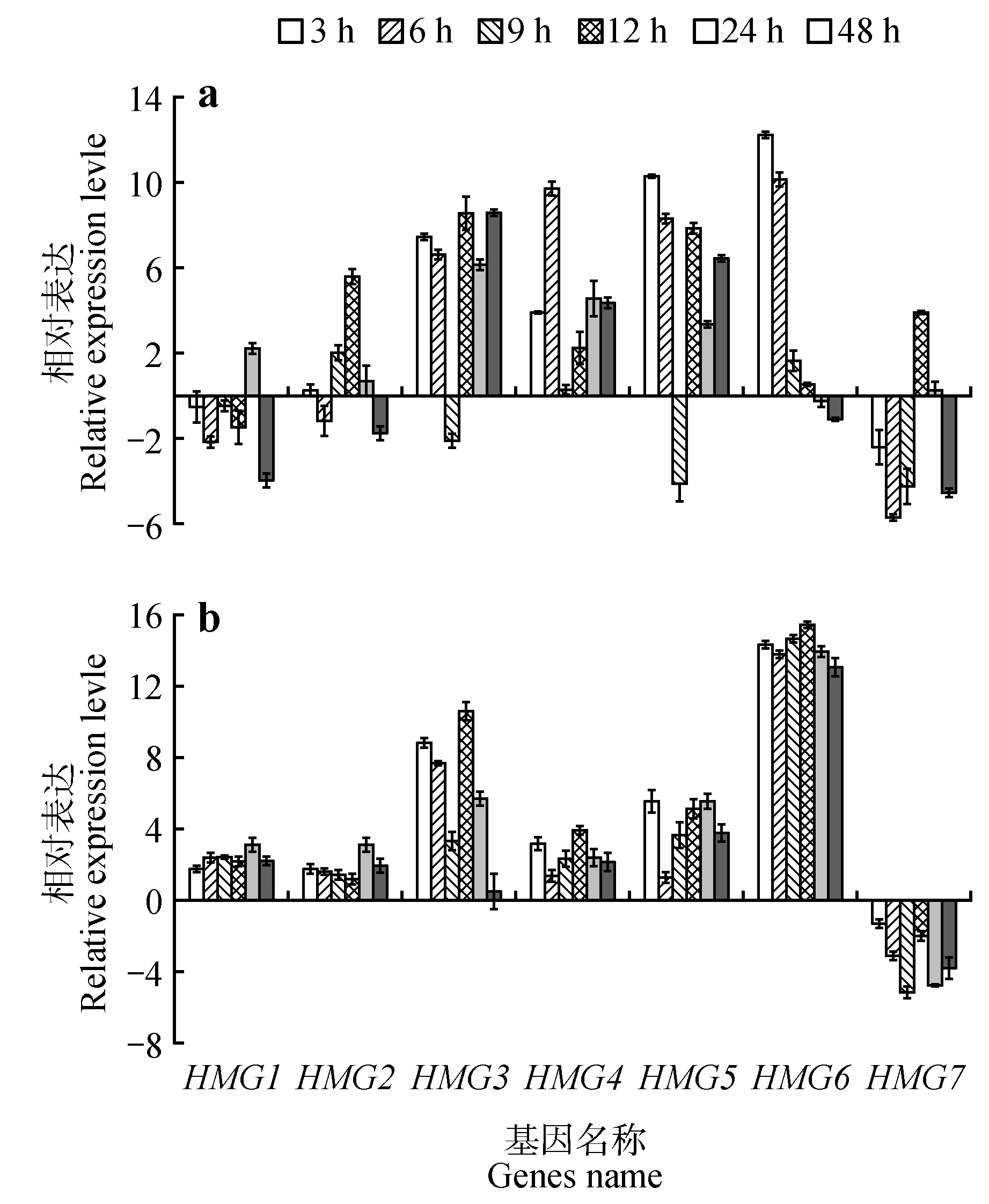
图9 CdCl2胁迫处理下山新杨PdbHMGs基因表达模式a.根;b.叶Fig.9 Expression analysis of PdbHMGs under CdCl2.a.Roots;b.Leaves
有趣的是,在叶中,除PdbHMG3在胁迫48 h时的表达无明显变化外,PdbHMG1~6基因的表达均被镉胁迫明显诱导呈上调表达趋势。而PdbHMG7在所有时间点的表达均呈现下调趋势,在9 h时达到最低水平,为对照的2.70%(图9b)。
2.4.4 ABA 处理下山新杨PdbHMGs基因表达模式分析
在根中,7 个PdbHMG基因的表达分为3 种明显不同的模式。第1 种,由PdbHMG1和PdbHMG5组成,其表达主要表现为上调,其中,PdbHMG1在所有时间点均被显著诱导,12 h 的表达量达到最高,为对照的176.07 倍。PdbHMG5的表达量在3个胁迫时间点明显升高,在12 h达到最高表达水平(为对照的7.06 倍)。而第2 种表达模式主要是下调表达,如PdbHMG4、PdbHMG6和PdbHMG7的表达大部分时间点呈现显著下调趋势,PdbHMG3的表达在3个胁迫时间点也被明显下调,在48 h时表达量最低,为对照的6.49%。第3种是PdbHMG2基因,其表达在所研究的6个时间点都无显著变化(图10a)。
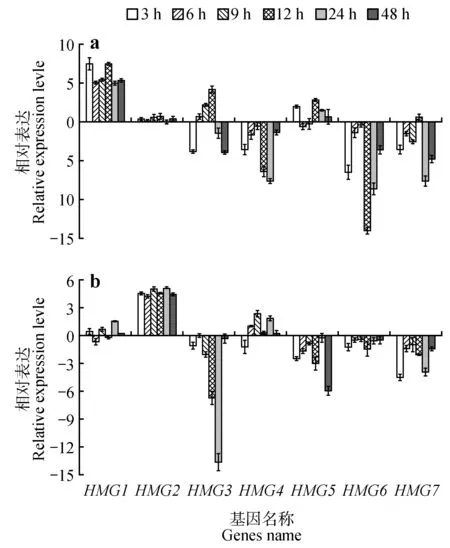
图10 ABA处理下山新杨PdbHMGs基因表达模式a.根;b.叶Fig.10 Expression analysis of PdbHMGs in response to ABA.a.Roots;b.Leaves
在叶中,PdbHMG2在全部胁迫时间点都被显著诱导,其中24 h 表达量最高(为对照的35.38倍)。而其他基因的表达均与之不同,PdbHMG3、PdbHMG5、PdbHMG6和PdbHMG7在全部胁迫时间点显著下调或无明显变化。PdbHMG1的表达除在24 h 被显著诱导,其他时间的表达无明显变化。PdbHMG4在除胁迫3 h时的表达量明显下调,其他时间的表达呈上调或无明显变化(图10b)。
3 讨论
本研究在山新杨基因组中通过拟南芥同源查找获得了7 条PdbHMGs基因,与拟南芥和白桦HMG 蛋白进化分析结果显示山新杨7条PdbHMGs基因全属于HMGB 亚家族。以往研究发现,HMGB 能够参与转录调控及DNA 合成相关的生物学过程[29]。植物HMGB 蛋白在植物的生命过程中具有至关重要的作用。在正常条件下,玉米ZmHMGB1在烟草(Nicotiana tabacum)中的异位表达能影响烟草幼苗的根部生长发育[30]。将黄瓜HMGB基因转入拟南芥中,会使一部分萌发响应基因的表达受到影响[31]。在拟南芥中,AtHMGB12和AtHMGB15只在种子中表达,说明这两个基因可能在种子的萌发和生长过程中发挥关键作用[8],山新杨PdbHMG5和PdbHMG3与拟南芥 中AtHMGB12和AtHMGB15的同源性较高,聚在同一分支,因此推测PdbHMG5和PdbHMG3也可能具有相似的功能。AtHMGB13仅在果荚中表达,说明该基因在花分化成果荚的生理过程中具有重要作用[8],PdbHMG4与AtHMGB13的同源性较高,由此推测PdbHMG4可能也具有相似的功能。与野生型相比,atssrp1/spt16突变体的花青素合成量减少,说明AtSSRP1(AtHMGB7)可能参与了植物花青素的合成过程[32],而PdbHMG6与AtHMGB7的同源性较高,由此推测PdbHMG6可能也参与了山新杨的花青素合成过程。
此外,植物HMGB 蛋白还参与到植物抵抗逆境胁迫的生理过程中。如在NaCl 胁迫下,白桦BpHMG6茎中的表达量在所有研究时间点均显著上调;进一步研究发现,过表达BpHMG6白桦增强了对活性氧的清除能力和盐胁迫下保护酶的活性,减少了细胞的损伤和死亡,表明BpHMG6可能与白桦的耐盐性有关[15]。对启动子顺式作用元件的分析发现,PdbHMGs各成员均含有与植物激素和逆境胁迫相关的元件,如胁迫响应元件(STRE)、脱落酸响应元件(ABRE)等,由此推测PdbHMGs可能在植物抵御非生物胁迫的过程中发挥作用。在非生物胁迫和激素处理后,对PdbHMGs基因在山新杨根和叶中的表达模式进行了分析。结果显示,PdbHMG1~7均能在至少一个器官中对盐、干旱、重金属以及ABA胁迫处理做出响应。
PdbHMG1在NaCl 和CdCl2胁迫下,在叶中的表达被显著诱导,表明该基因可能在叶应对盐和重金属胁迫中发挥作用。在高盐、干旱、激素和重金属4 种胁迫下,PdbHMG2在叶中的表达被明显诱导,说明该基因可能在叶中参与多种胁迫应答过 程。PdbHMG1、PdbHMG2分 别与AtHMGB1和AtHMGB2的同源性最高。在NaCl 胁迫下,过表达AtHMGB1的拟南芥种子的萌发受到阻碍[33]。盐和干旱处理下,过表达AtHMGB2与野生型相比表现萌发及发育迟缓现象,说明AtHMGB2在胁迫条件下在拟南芥的早期生长发育阶段发挥作用[14,33]。
NaCl、PEG6000、ABA 和CdCl2处理后,PdbHMG7在叶中的表达均呈现下调趋势,表明其也可能参与这4 种胁迫应答。在高盐和ABA 胁迫下,根中PdbHMG6在大部分胁迫时间点的表达显著下调,由此推测其发挥功能的器官可能是根,PdbHMG6可能参与根中ABA 信号途径相关的盐胁迫应答。PdbHMG6基因能否调控ABA依赖的抗逆相关基因的表达仍有待进一步研究。在今后的研究中,可通过转基因的方法对山新杨PdbHMGs基因在非生物胁迫应答过程中发挥的具体功能进行研究与分析。

