TRPV1受体T704位点突变对其糖基化及功能的影响
其乐木格,吴 超,程雪莹,孙美艳,张 野,汪庆童,何淑芳
(1. 安徽医科大学第二附属医院麻醉与围术期医学科,麻醉与围术期医学安徽普通高校重点实验室,安徽 合肥 230601;2. 安徽医科大学临床药理研究所,抗炎免疫药物教育部重点实验室,安徽 合肥 230032)
瞬时受体电位香草酸亚型 1(transient receptor potential vanilloid 1,TRPV1)是一种非选择性阳离子通道,尤其对钙离子有高渗透性,在辣椒素、热刺激(>43 ℃)、酸性pH和内源性代谢物质等伤害性刺激下被激活[1],是镇痛药物研发的关键靶向分子。TRPV1通道C-端的TRP结构域中,T704位点是重要的磷酸化位点之一,影响TRPV1对伤害性刺激的敏感性[2]。本研究利用F11细胞,通过构建和转染大鼠TRPV1定点突变质粒 TRPV1T704A与TRPV1T704E,探讨TRPV1受体T704位点突变对 TRPV1蛋白表达、糖基化修饰、膜转运和细胞钙内流的影响。
1 材料与方法
1.1 细胞系F11细胞(ECACC,08062601)。
1.2 试剂与设备Lipofectamine 2000(11668030,Invitrogen),辣椒素(HY-10448,MCE),Fura-2AM(ab120873,Abcam),内切糖苷酶(P0702S,NEB),肽-N-糖苷酶F(P0704S,NEB),激光共聚焦显微镜(蔡司),钙离子成像系统(MetaFluor)。
1.3 质粒的构建委托丰晖生物构建rTRPV1WT、rTRPV1T704A和rTRPV1T704E质粒。
1.4 分组与处理F11细胞用含10%胎牛血清、1%青链霉素溶液的高糖培养基,于37 ℃培养箱培养[3]。将F11细胞随机分为Vector组、WT组、T704A组和T704E组,次日Lipofectamine 2000进行转染。
1.5 去糖基化酶处理与Western blot各组蛋白加入去糖基化酶Endo H(500 units)或PNGase F(333.33 units),37 ℃孵育1 h,Western blot检测。加入一抗 Myc-Tag或GAPDH 4 ℃孵育。二抗采用山羊抗兔 IgG室温孵育,ECL显影。
1.6 免疫荧光染色细胞爬片固定封闭。室温孵育一抗Myc-tag和PDI,室温避光孵育二抗。封片并激光共聚焦显微镜观察。
1.7 钙离子成像F11细胞经5 μmol·L-1Fura-2AM处理后恒速灌流37 ℃含钙HBSS。基线稳定后,给予1 μmol·L-1辣椒素[4]持续刺激30 s。
2 结果
2.1 质粒DNA测序TRPV1WT、TRPV1T704A和TRPV1T704E基因的704位点分别为苏氨酸T(ACC)、丙氨酸A(GCC)和谷氨酸E(GAG)。
2.2 T704位点突变影响TRPV1蛋白糖基化除在95 Ku左右存在明显目的条带外,WT组和T704A组在100 Ku处分别显示微弱和明显条带,表明TRPV1蛋白分别存在少量和大量糖基化;相反,T704E组几乎无糖基化条带。通过计算上层和下层蛋白条带灰度值的比值,发现T704A组比值明显高于WT组(P=0.000 8),而T704E组比值明显低于WT组(P=0.040 1)。各组蛋白与去糖基化酶孵育后,WT组和T704A组上层条带不能被Endo H酶去除,但几乎完全被PNGase F酶去除,说明100 Ku处条带主要是后内质网形式糖基化TRPV1蛋白。
2.3 T704位点突变影响TRPV1蛋白膜转运Vector组细胞无TRPV1阳性荧光信号;WT组TRPV1在F11细胞中较均匀分布,与PDI共表达;T704A组TRPV1主要表达于质膜,很少与PDI共标;相反,T704E组细胞中TRPV1主要停留在内质网中,与PDI高度共表达。
2.4 T704位点突变影响辣椒素诱导的Ca2+内流Vector组细胞对1 μmol·L-1辣椒素刺激无反应,其余3组均有不同程度的反应。就340/380比值的峰值而言,T704A组明显高于WT组(P<0.000 1),而T704E组明显低于WT组(P=0.021 5)。曲线下面积AUC反映辣椒素刺激下细胞钙内流总量,T704A组和T704E组细胞AUC数值分别明显大于和小于WT组(P<0.000 1,P=0.010 5),见Tab 1。
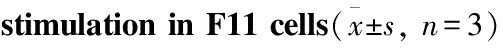
Tab 1 Calcium influx in response to capsaicin
3 讨论
本研究将野生型大鼠TRPV1 704位点的苏氨酸定点突变为不可磷酸化的丙氨酸即T704A[5],另外构建T704E突变模拟持续磷酸化状态。Endo H酶只能剪切内质网形式的高甘露糖型N-连接糖,而PNGase F酶对后内质网形式的高甘露糖型及复杂型N-连接糖均有剪切作用[6]。Western blot结果提示,T704A突变促进TRPV1蛋白发生糖基化。TRPV1经过糖基化修饰后成为成熟蛋白运输至质膜发挥生物学作用[7],免疫荧光结果进一步证实,T704A突变引起大量成熟TRPV1蛋白转运至质膜。相反,T704E突变导致TRPV1蛋白几乎完全滞留在内质网内。发生糖基化的成熟TRPV1蛋白转运至质膜表面后,可增加细胞对辣椒素的反应性,而未成熟的非糖基化TRPV1蛋白则停留在内质网内,对辣椒素的敏感性明显降低,这与本研究中的钙成像结果一致。
综上,T704位点突变影响F11细胞内TRPV1蛋白表达、糖基化和膜转运,进而影响辣椒素诱导的钙内流,提示T704位点可能成为特异性干预TRPV1活性和功能的重要靶点。

