肺器官芯片的构建及应用
刘 含,孙美好,李建生
(河南中医药大学,呼吸疾病中医药防治省部共建协同创新中心,河南省中医药防治呼吸病重点实验室,河南 郑州 450016)
呼吸系统疾病是影响公众健康的重大问题之一,其患病率、死亡率呈逐年上升趋势,已引起广泛重视[1]。常见的呼吸系统疾病有新型冠状病毒感染(corona virus disease 2019,COVID-19)、慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)、特发性肺纤维化(idiopathic pulmonary fibrosis,IPF)、肺癌(lung cancer,LCA)、肺动脉血栓栓塞(pulmonary thromboembolism,PTE)及哮喘(bronchial asthma,BA)等,相关临床与基础研究亟待加强,以建立有效的治疗方法并揭示作用机制。
目前,有关呼吸系统疾病的研究多依赖于动物实验和传统的二维(2D)细胞培养技术,但这些技术仍存在一定的局限性(Fig 1)。动物实验中,动物的个体差异以及实验环境的不同均可能会导致实验结果的不可重复[2],且动物与人类存在种属差异,多数动物模型仅能模拟出疾病的某些特征;此外,动物实验成本高、成功率低、周期长及复杂的动物伦理等问题限制了其发展(Fig 1A)。传统的体外2D细胞培养缺乏人体组织和器官固有的复杂内环境特征(如组织结构、机械特性和功能特性等),不仅会影响细胞形态、基因表达、因子分泌、生理功能及细胞的增殖分化等行为(Fig 1B),对细胞内机械信号如流体剪切力、基质硬度等物理刺激及3D超微结构等的转导也有较强的干预作用[3]。因此,目前亟需能更好地模拟出人体生理或病理发展进程的新的体外模型,以用于探索疾病机理及其防治措施的研究。
器官芯片是一门多学科交叉的新兴技术,可在体外精准地模拟人体器官的结构和功能,它以微流控芯片为载体,借助水凝胶等生物材料于体外模拟细胞生存的三维微环境,并精确调控不同细胞的生长条件,实现细胞共培养,为研究细胞间相互作用等提供可靠平台,对生命医学及生物产业的发展具有长远意义。与2D细胞培养技术和动物实验相比,器官芯片具备高效率、分析快、模块化、便携性等优势[4](Fig 1C),能更加准确地模拟人体对药物或外界不同刺激所产生的反应。现已开发出多种类型的器官芯片并广泛应用于生物医学等多个领域,如肺、肠、心脏、肾、肝、血管和血脑屏障等。
肺器官芯片主要借助生物材料及微流控技术,体外重构肺部细胞的在体微环境及微结构,模拟肺部生理功能和病理过程,为肺部疾病的病理研究及防治提供可靠平台。基于此,本文综述现有肺器官芯片的制备及应用,分析现有模型中所存在的问题,并结合学科交叉进一步探讨其未来发展方向,以期为后续肺器官芯片的开发及呼吸系统疾病的防治提供参考。
1 肺器官芯片相关制备技术
器官芯片主要是通过体外构建器官的基本功能单元来模拟在体器官的结构和功能,使其成为病理生理学研究的体外平台。人体器官的基本单元尺寸较小,如肺泡的平均直径约为200 μm,为模拟肺泡的功能结构,所构建的体外组织模型也应在微米级别。器官芯片技术首先利用微纳加工等方法在不同基底材料上制作出微尺度的芯片结构,随后在芯片微结构中植入不同种类的细胞或不同材料包裹的细胞团等构建出具有不同功能的模型。常用的芯片制备材料有水凝胶、聚二甲基硅氧烷(polydimethylsiloxane,PDMS)、聚甲基丙烯酸甲酯(polymethyl Methacrylate,PMMA)、聚对二甲苯、玻璃、硅、纸等。在制备过程中,常根据选用的材料、芯片的结构和功能等采用不同的技术手段,如软光刻法、热塑法、3D打印技术、激光刻蚀法、微接触压印法和机械加工法等(Fig 2)。本文以肺器官芯片为例着重介绍以下几种常用的芯片制备方法。
2.5 肺水肿芯片PE是指由于肺淋巴系统静脉循环功能异常,引起肺内组织液从毛细血管向外渗漏,积聚在肺泡、肺间质和细支气管内,造成局部水肿,进而导致肺部气体交换功能障碍的病理现象。Huh等[16]在肺芯片上重构了肺泡-毛细血管的功能界面(Fig 3E),对肺水肿的诱发因素进行了探究。首先将临床常规用量的白介素-2(IL-2)注入芯片微血管通道,观察到液体开始从芯片的微血管通道流向肺泡通道,直至充满整个肺泡通道,成功在体外重现了由IL-2毒性引发的PE的发生过程(Tab 1)。且在此过程中发现单独的呼吸运动不会对肺泡-毛细血管屏障造成损伤,但在与IL-2的协同作用下,细胞间的连接被破坏,肺泡-毛细血管通透性增加,屏障功能受损,肺内组织液发生渗漏[17]。该芯片模型不仅能够再现PE的病理过程,也为血管紧张素(angiotensin-1,Ang-1)、瞬时受体电位离子通道4(transient receptor potential vanilloid 4,TRPV-4)抑制剂和GSK2193874等新药的研发提供了可靠的检测平台。
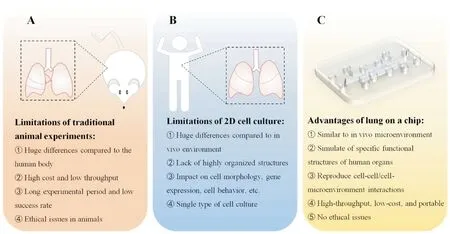
Fig 1 Characteristics of animal experiments,two-dimensional cell culture and lung-on-a-chip
1.1 软光刻法软光刻是指利用不同材料模板,通过光刻图案法制备纳米尺度的多层微结构,通常采用菲林掩膜,所制备的芯片结构属于开口结构,该技术耗时短、工艺简单,目前已广泛用于与水凝胶材料相结合的器官芯片的制作。Huh等[5]使用软光刻技术将PDMS浇注在模具上,随后固化、剥离并与玻璃基底键合以制备肺器官芯片模型。如Fig 2A所示,该模型由上下微通道组成,被10 μm厚的柔性PDMS多孔薄膜(被胶原蛋白和纤连蛋白修饰表面)隔开,芯片上层是由人肺泡上皮细胞组成的气体通道,下层是由人肺泡毛细血管内皮细胞组成的液体通道,两种细胞共培养时可形成与人肺泡-毛细血管界面相似的气液屏障界面。对薄膜两侧的真空腔施加周期性的作用力,可使柔性PDMS膜进行规律性的机械拉伸,模拟呼吸运动时肺泡内外壁的收缩状态。Sellgren等[6]使用软光刻技术加工制备了一个人体气道芯片模型。该芯片由气道上皮细胞、肺成纤维细胞和毛细血管内皮细胞组成,这些细胞分别位于纳米多孔膜分隔的三个垂直且可单独控制的腔室中。该气道芯片展示了原代气道上皮细胞的共培养模式,且模拟了被分隔开的不同种类细胞间的相互作用。
2.3 特发性肺纤维化芯片IPF属于弥漫性间质性肺疾病,发病原因不明,好发于成人、病变局限肺脏,以进行性呼吸困难、肺功能下降为特征,该病病理机制复杂,目前尚无有效的防治方法。Felder等[13]借助微流控芯片于体外构建了IPF肺泡微损伤模型(Fig 3D),发现弱酸环境能破坏肺泡上皮屏障的完整性,这可能是导致IPF发生的重要原因之一(Tab 1)。Sellgren等[6]借助原代人肺细胞构建了一个含间质成分(单层肺成纤维细胞)的纤维化体外模型,该芯片采用三通道结构,作者首先将上皮细胞植入上腔内,培养10 d后将成纤维细胞接种至中央腔室,培养1 d,最后将血管内皮细胞引入芯片下腔,模拟了完整的气液界面,并测定了芯片上细胞黏膜的分化程度及其所模拟的屏障功能。该模型通过在芯片中引入肺成纤维细胞表明了在肺纤维化芯片中引入肺间质的可能性,同时为深入研究成纤维细胞表型转化机制提供了新平台。
1.2 热塑法热塑法是制备结构复杂、独立、闭合的微流控芯片的常用方法之一。该技术通过加热加压的方式使模型表面紧密接触,利用分子间作用力使其发生键合,形成含微流道的闭合结构。热塑法简单便捷,但加工过程中的高温环境可能会导致微流控芯片产生热变形,且键合强度较低,容易开裂,亦可能导致后续实验结果产生误差。Humayun等[7]借助热塑技术采用先分部制作,再胶粘键合封装的方法制备了肺气道芯片(Fig 2B),该芯片由气道上皮细胞、平滑肌细胞以及悬浮的水凝胶层组成,模拟了气道上皮细胞和平滑肌细胞之间的相互作用,且其中的水凝胶层可拆卸,以用于进一步探索病理机制或进行药理实验,为肺气道疾病的研究提供了支持。
当前我国计算机技术与过去相比已经有了明显的变化,无形之中也加快了我国进入知识信息时代的进程。电子计算机技术与网络信息技术的广泛使用不仅降低了机关事业单位的工作成本,而且也很大程度的提升了工作的效率与质量,实现了时间的合理运用。所以,把网络信息技术与电子计算技术运用到机关事业单位的管理会计系统中是非常有必要的,但需要有专业的机构人员来进行培训,从而实现管理会计的现代化与专业化,实现我国机关事业单位的可持续发展。
Huh等[16]在构建的PTE芯片中测试了Ang-1在防治IL-2导致的血管渗漏中的作用,发现Ang-1与IL-2联合用药可以完全阻断IL-2诱导的血管渗漏,且Ang-1能够减少机械应力所造成的细胞间隙。Benam等[12]及Jain等[18]通过验证了PM2(TRPV)在人体内的抗血栓作用,PM2是PAR-1抑制剂,通过阻止PAR-1激活血小板,降低血栓及炎症反应的发生,为临床肺动脉血栓的抗炎治疗提供了新思路。Hassel等[14]利用NSCLC芯片探究了呼吸运动对肿瘤细胞生长扩散的影响,分析了不同的酪氨酸激酶抑制剂(TKIs)在不同的微环境下对肿瘤细胞繁殖的抑制作用及相关机制。此外,肺器官芯片还能够结合流体剪切力、动态机械应力等模拟肺的呼吸功能,为细胞提供动态3D微环境。在肺的血管渗漏过程中[21],肺的异常呼吸激活TRPV4,引起肺泡-毛细血管屏障的通透性增加,导致肺内血管渗漏。在循环机械应变存在的情况下,GSK2193874(TRPV4通道抑制剂)能够显著抑制IL-2诱导的血管通透性增加。肺器官芯片凭借其高通量、低成本和一体化等优势已广泛用于药物的疗效评价等领域,促进了新药研发及药物进入早期临床试验阶段的进程。
2 常见肺器官芯片
肺器官芯片是基于器官芯片技术,结合肺部疾病的病理特征及肺部特征性功能开发出的体外模型,能模拟肺泡(Fig 3A)、肺泡-毛细血管屏障(Fig 3B)、小气道及气道肌肉组织(Fig 3C)等结构,用以探索呼吸系统疾病的发病机制和防治方法。本文将结合常见的呼吸系统疾病来介绍不同肺器官芯片模型的构建及应用。
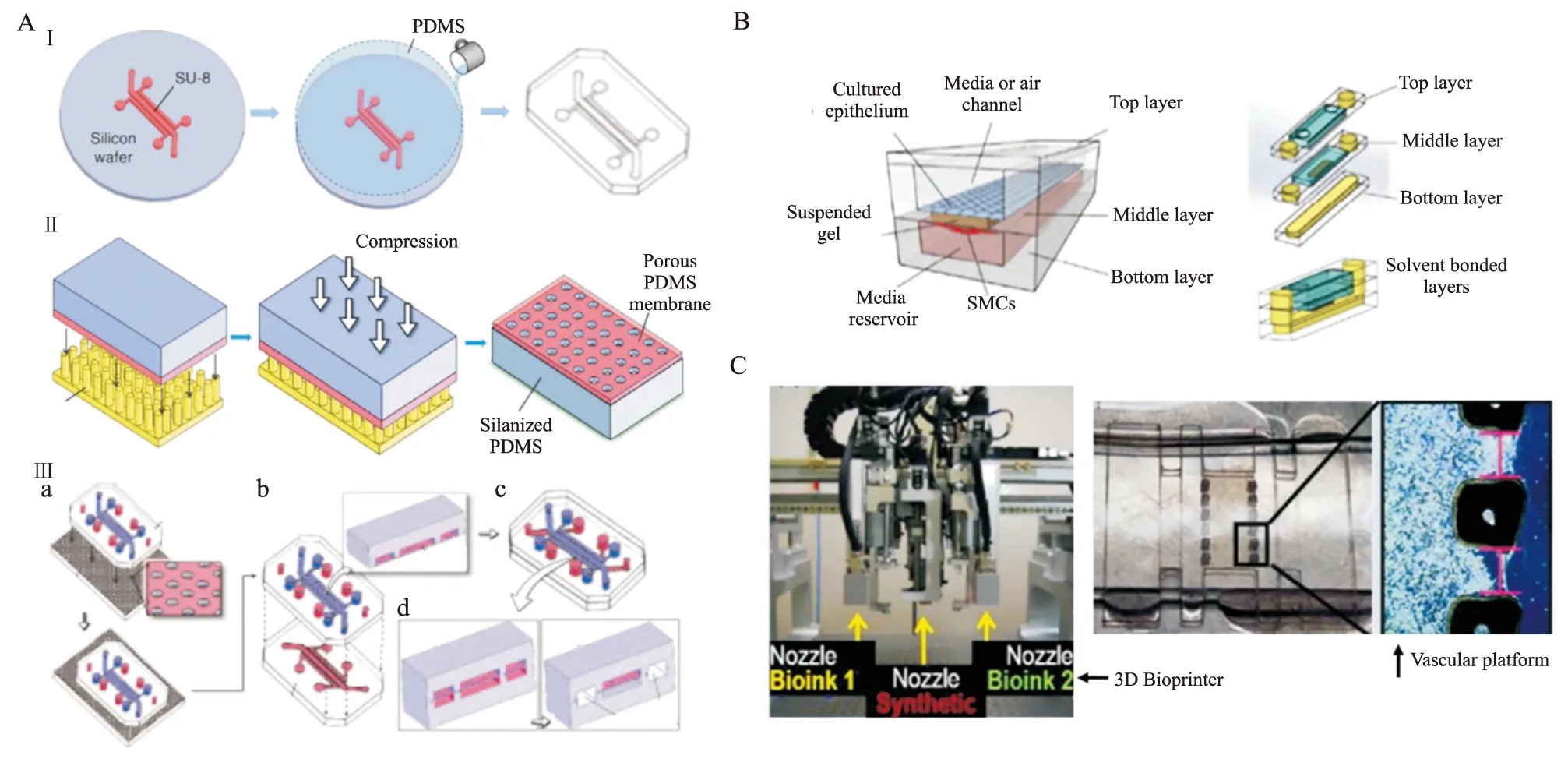
Fig 2 Preparation technology of lung-on-chips
2.1 新型冠状病毒感染芯片COVID-19自暴发以来,严重威胁人类健康和全球经济。新冠病毒具有高传染性、高隐蔽性和易变异性等特征,不仅损害肺脏,还可以对人体的免疫系统及其他器官造成不同程度的损伤[9],因此亟需有效的抗病毒药物及疫苗。肺器官芯片的出现为COVID-19防治研究提供了体外模型。秦建华团队[10]借助器官芯片技术构建了人体肺泡模型(Fig 3D),可在体外模拟出由严重急性呼吸综合征冠状病毒2型(severe acute respiratory syndrome coronavirus 2,SARS-CoV-2)诱导的肺损伤和免疫反应(Tab 1)。该芯片由上层肺泡腔和下层血管腔组成,中间由ECM涂层包裹的多孔薄膜隔开,作者将SARS-CoV-2病毒引入上皮通道,将人类免疫细胞引入血管通道,实现人体肺泡上皮细胞、微血管内皮细胞及免疫细胞的共培养,模拟COVID-19的发生发展过程。研究发现,SARS-CoV-2主要在上皮细胞层中发生增殖和感染,且上皮细胞对病毒的敏感性高于内皮细胞;另外,两种细胞对SARS-CoV-2产生的免疫应答反应也不同,上皮细胞做出了先天性免疫应答(如INF-I等信号通路的激活),而内皮细胞中JAK-STAT信号通路被激活,分泌的细胞因子促使免疫细胞聚集在感染部位,进而引发肺部的炎症反应。此外,Zarkoob等[11]在胶原蛋白和弹性蛋白构建的肺泡-毛细血管气血屏障模型中引入了SARS-CoV-2病毒和流感病毒,用以探究二者的感染率及感染模式(Tab 1)。同时,作者使用不同的抗病毒药物进行测试,证明了该芯片作为病毒感染的检测平台及抗病毒药物筛选平台的可靠性。
2.2 慢性阻塞性肺疾病芯片COPD是临床常见的气道慢性炎症性疾病,发病机制复杂,对患者生命安全造成重大威胁,且当前临床上治疗COPD的药物(如糖皮质激素、β2-肾上腺受体激动剂及吸入性抗病毒剂等)均存在一定的局限性,不能有效阻止疾病进程和肺功能的下降。肺器官芯片通过对肺泡上皮细胞和血管内皮细胞进行共培养,能于体外再现抗炎药物抑制COPD炎症反应的具体过程(Tab 1)。Benam等[12]借助COPD患者和健康人群的肺气道上皮细胞分别构建了病理性和健康的肺小气道芯片模型(Fig 3F),采用聚肌苷酸胞苷酸poly(I:C)和脂多糖内毒素(LPS)分别刺激健康或COPD小气道芯片,模拟体内的病毒感染过程,发现与对照组相比,COPD模型中能观察到较多的巨噬细胞集落刺激因子(M-CSF)和白介素-8(IL-8),这两种因子均在COPD患者的气道炎症发生过程发挥了重要作用,并且发现poly(I:C)能够促进两个模型中趋化因子IP-10和重组人趋化因子CCL5的分泌,这些数据都为临床研究COPD的防治提供了重要的参考。
Researchers have sought to understand why all H. pylori infected people do not develop gastric cancer.

Tab 1 Summary of organ chips for respiratory diseases
2.4 肺癌芯片LCA是目前对人群健康和生命威胁最大的恶性肿瘤之一,根据其组织病理学特点,可将其划分为小细胞肺癌和非小细胞肺癌(non-small cell lung cancer,NSCLC)。Hassel等[14]构建的NSCLC肺癌模型,在研究不同微环境中癌细胞的增殖、分化及转移等行为的同时,观察到呼吸运动不仅影响癌细胞的转移及对血管通道的入侵(Tab 1)(Fig 3E),其带来的周期性机械拉升能够显著抑制肿瘤细胞的生长。与此同时,作者发现NSCLC肿瘤细胞在人肺泡芯片中的增殖速度比在气道芯片中快,此结果与患者体内癌变的进程相似,为癌症的防治研究提供有力支持。此外,Yang等[15]利用静电纺丝技术,制备了聚乳酸-羟基乙酸共聚物(poly lactic-co-glycolic acid,PLGA)纳米纤维薄膜,并以此作为器官芯片中细胞生长的支架材料,在对人非小细胞癌细胞(A549)、人胚肺成纤维细胞(HFL1)和人脐静脉内皮细胞进行共培养时,发现A549能够引起内皮细胞的凋亡,进而导致肿瘤细胞侵袭,这一装置便携、高效,可作为后续开展肺癌相关的个性化医疗等领域研究的新平台。
案例1:“农田”。思考:如果植物全都枯死,请用能量流动的原理来解释最先受到影响的是哪些生物?其他生物会受到影响吗?
此外,研究人员还借助该芯片分析了蛋白酶激活受体-1(protease activated receptors-1,PAR-1)对内皮细胞活化和血栓形成过程中的抑制作用,为临床研究PTE的形成和防治方法提供了研究思路。
沥青路面坑槽破损部分经过开槽成型后,其坑槽壁面与坑底表面石料直接裸露在空气中,若直接填入冷补料,将导致冷补料与旧路面材料之间黏结力不足,从而形成壁面缝隙,影响修补路面的抗水损害能力[4]。因此,坑槽在开挖与清扫结束后应喷洒适量的改性乳化沥青作为黏结层,以提高新旧料界面的黏结力。
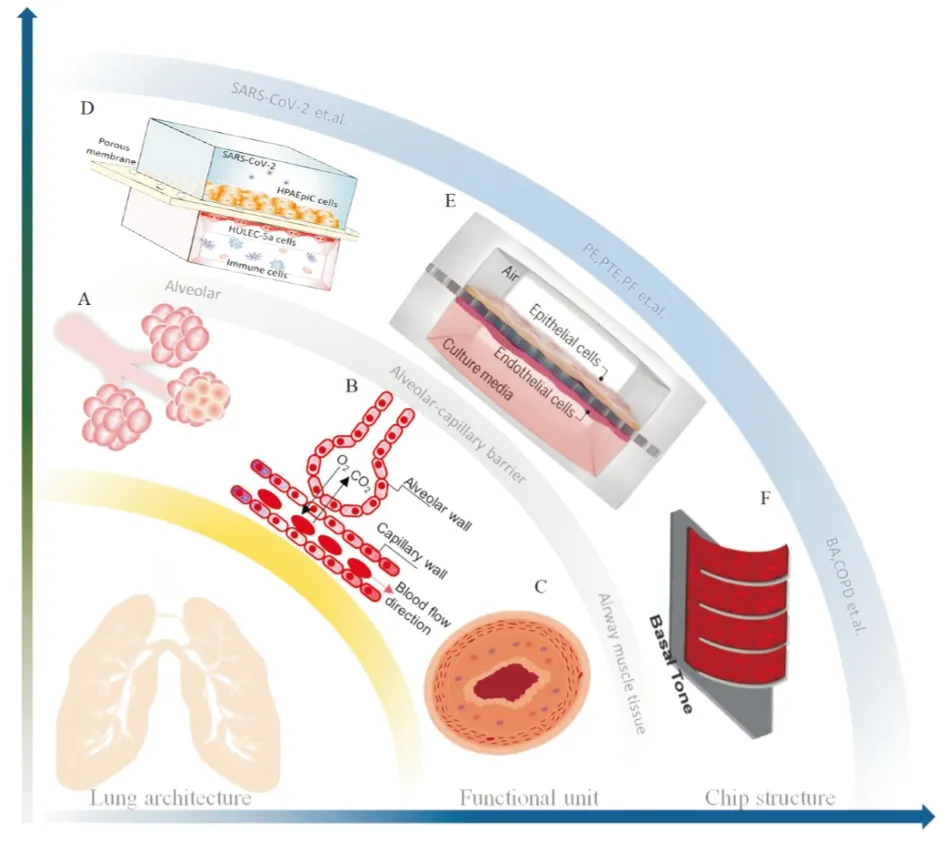
Fig 3 Common lung-on-chips
2.6 肺动脉血栓栓塞芯片PTE是指来自静脉系统或右心的血栓阻塞于肺动脉或其分支,引起以肺循环和呼吸功能障碍为特征的疾病,是临床常见的肺动脉栓塞之一。Jain等[18]将人原代肺泡上皮细胞引入芯片上层通道,同时将人血管内皮细胞贴附于下层血管通道的4个表面以模拟3D微血管通道,建立起研究血栓及其炎症反应的体外芯片发现(Tab 1),在由LPS诱导的急性肺损伤的血栓形成过程中,LPS并不能直接激活内皮细胞,而是刺激上皮细胞分泌促炎因子,激活血管内皮细胞,促使血管内部产生炎症反应生成血栓。
2.7 支气管哮喘芯片现代医学普遍认为BA是由于基因和环境共同过敏性气道炎症反应,且目前尚无根治方法,只能在一定程度上缓解症状。肺芯片通过在体外模拟人体炎症反应过程(Fig 3F),为BA的发病机制及防治方法的研究带来了新的方向(Tab 1)。Huh等[6]通过在芯片的肺泡通道中引入促炎介质(肿瘤坏死因子TNF-α、IL-8或大肠杆菌等)激活内皮细胞,促进细胞间黏附因子-1(intercellular adhesion molecule-1,ICAM-1)的分泌,使中性粒细胞大量集聚在炎症部位,再现了肺部的先天性免疫应答过程并且发现。Benam等[12]凭借的肺小气道芯片模型发现,白介素-13(IL-13)可直接作用于气道上皮细胞,诱发气道炎症反应,导致杯状细胞增生,气道黏液高分泌,气道纤维化及气道高反应性,且后续可借助该结构对BA的发病机制及疗效评价进行深入研究。此外,Nesmith等[19]通过在柔性薄膜上植入支气管平滑肌细胞构建了人体气道肌肉组织芯片模型,模拟了BA中支气管的扩张和收缩,将平滑肌细胞暴露于IL-13下激活胆碱能激动剂,以引起芯片上肌肉层的收缩和柔性薄膜的弯曲,并验证了临床使用的毒蕈碱拮抗剂和β受体激动剂能有效缓解支气管哮喘引起的气道肌肉紧张,成为新药检测的高通量、便携、可靠的测试平台。
第十三次:1997年“中华人民共和国国内贸易部军用粮票”(“贰拾伍仟克”“伍拾仟克”“贰佰伍拾仟克”“伍佰仟克”版)。
3 肺器官芯片的应用
作为融合生物材料、分子化学、生物物理等多学科交叉为一体的仿生微系统,肺器官芯片在模拟肺部微环境的同时,还能将多种刺激因子如纳米颗粒、吸入性药物等直接引入芯片,进行毒性测试和药物筛选,且通过培养不同患者群体的细胞能够制备个性化的医疗芯片(Fig 4)。肺器官芯片的低成本、便携性、高仿生性及可调控性等优势使其广泛应用于呼吸系统疾病各领域。
Xu等[20]建立了一个三通道肺芯片模型,使用不同浓度(0~800 mg·L-1)的PM2.5培养基对芯片进行培养,模拟PM2.5侵袭肺部过程,研究发现,低浓度的PM2.5所造成的肺毒性有限,但高浓度的PM2.5(>200 mg·L-1)能够显著增加上皮、内皮细胞中活性氧(reactive oxygen species,ROS)的生成、凋亡及炎症反应,并进一步研究了暴露于PM2.5下免疫细胞和微组织之间的相互作用。Huh等[5]将含有二氧化硅颗粒的溶液直接覆盖至芯片的上皮细胞层,模拟肺吸入空气中的纳米粒子的状态,同时施加周期性的机械应力模拟肺的呼吸运动,通过检测ICAM-1的表达等研究二氧化硅纳米粒子的毒性及其引发的肺部炎症。Zhang等[21]探究了不同浓度纳米颗粒(TiO2-NPs和ZnO-NPs)对肺上皮细胞和内皮细胞的毒性,提示纳米粒子可能通过影响人体内氧化应激导致细胞异常凋亡及屏障受损,并通过观察细胞形态、紧密连接蛋白的表达、ROS的生成以及内皮细胞的凋亡等证明纳米粒子对上皮、内皮细胞表现出剂量依赖性的毒性。
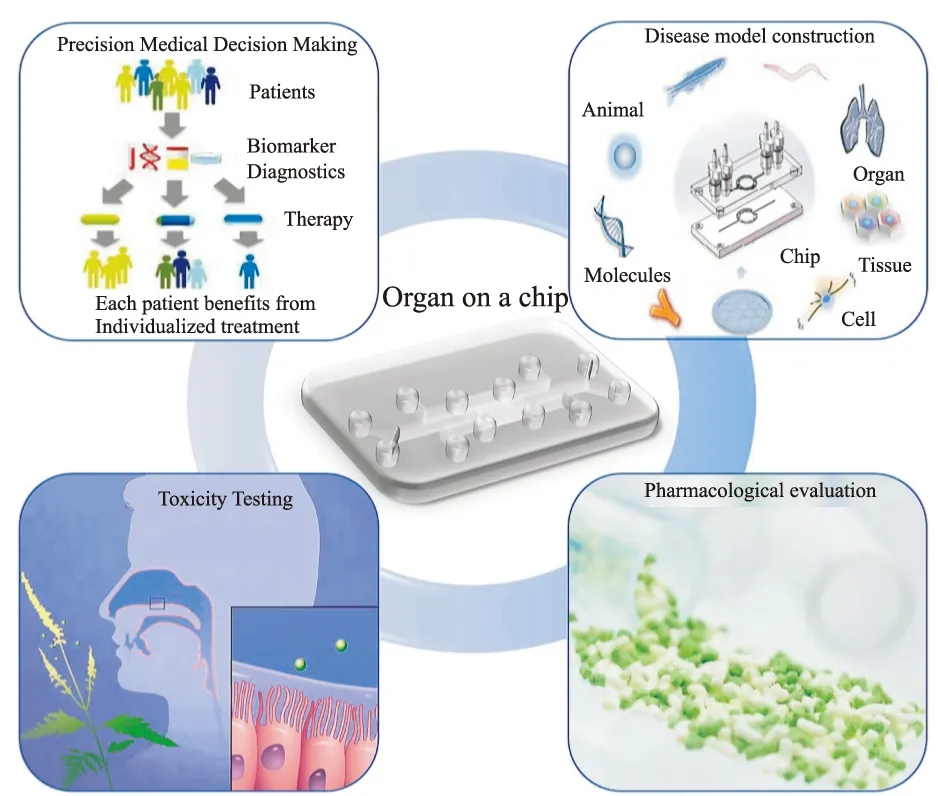
Fig 4 Application of lung-on-chips(precision medicine,disease model construction,toxicity detection and pharmacodynamical evaluation picture materials all come from network)
3.1 毒性检测肺作为气体交换的主要场所,常受到各种吸入性颗粒(如PM2.5、香烟烟雾和空气中气溶胶颗粒等)的毒性侵扰。肺器官芯片能将吸入性物质毒性的发生、发展过程与肺部的损伤、应答过程整合在微芯片系统上,实现系统性的毒理学检测。目前,肺器官芯片在针对PM2.5、空气中的纳米颗粒、香烟烟雾等多种吸入性颗粒的毒理学检测中已取得显著成果,成为评估生态环境中多种物质对肺造成的毒性作用新平台。
改革开放进入“深水区”,面对越来越难啃的“硬骨头”,以习近平同志为核心的党中央,带领全国人民涉险滩、攻难关,坚定不移将改革开放进行到底。正如今年10月,习近平在广东考察调研时向世界宣示:中国改革开放永不停步!下一个40年的中国,定当有让世界刮目相看的新成就!
随着GPS技术在我国房产行业中的广泛应用,我国房产企业的测绘管理工作已经基本实现信息化管理,信息管理的整体水平正在不断提高。而随着人们住房需求的不断提高,信息化管理系统成为解决问题的主要途径,传统的房产管理方式已经难以满足社会发展的需求。因此,技术人员必须建立完善的房产信息管理体系,建立房产管理的数据库,并将GPS技术有效地应用于房产测绘中的各个环节,提高自动化管理水平,促进我国房产测绘事业的全面发展。
3.2 药效药理评价目前药物的药效药理评价主要通过借助2D细胞实验和动物实验构建不同的疾病模型,测试给药前后的变化,来验证药物的有效性。但这种传统的手段投入高、风险大、周期长,还存在伦理、动物福利等问题,并且临床实验效果并不理想。肺芯片既能模拟肺细胞的微环境、再现肺的特征性功能结构,又能实现高通量、高效率、高灵敏且直观可控的检测模式,已成为药效药理检测的新平台。
1.3 3D打印技术3D打印技术是一种一体化成型的方法,采用逐层打印的方式,无需借助模具,只需将设计好的模型数据导入至计算机软件,随后连接3D打印机即可打印出多种3D微结构。该技术操作简单、精度高、成本低、一体化成型等特点,能够制备出较复杂的3D结构,较大程度地模拟在体细胞微环境,在器官芯片等领域有着广阔的应用前景。常见的3D打印技术有微挤压打印、熔融沉积成型、光固化成型、喷墨打印等。Park等[8]借助该技术制备了包含血管网络的肺气道芯片模型(Fig 2C),使用脱细胞的细胞外基质作为生物墨水进行3D打印,将聚己内酯(polycaprolactone,PCL)、肺成纤维细胞(lung fibroblasts,LFs)、血管内皮细胞(ECs)和PDMS整合在血管芯片上,该芯片整体由PCL材料打印,包括一个ECs中央腔室和两侧的LFs生物墨水腔室,中间用100 μm高的PCL柱隔开,芯片表面(除去微通道内部)涂PDMS涂层,与上层气道芯片相连,构成了一个能与血管网络进行功能性连接的肺气道芯片模型。
3.3 精准医疗决策精准医疗是指基于患者的临床诊疗信息,利用基因检测、组学、生物工程等技术,实现精准到分子水平的诊断,为患者制定出个性化的疾病防治方案。器官芯片能够对患者个人或群体的组学数据、健康数据和临床数据等进行挖掘,建立起个性化的疾病模型,明确药物对人体的敏感性,制定以患者需求为导向的防治手段。
肺器官芯片可以在微系统上培养特定患者群体的细胞或组织样本,建立特定模型研究疾病并对药物进行测试。Xu等[22]开发了一种基于微流控芯片的体外3D细胞共培养模型,通过培养不同来源的肺癌细胞系或原代细胞,测定它们对不同抗癌药物的敏感性,进而精确筛选出与合适的剂量、剂型及单一或联合用药的方案,便于临床医务人员能根据患者病情制定最佳治疗方案,达到疗程短、精度高、疗效好等效果。肺芯片制造简单、检测速度快、成本低,还能够适用于不同的肺癌细胞系或原发性癌细胞,为临床肺癌方案的筛选提供保障,目前已用于筛选优化肺癌的化疗策略,减轻癌症患者的痛苦等,未来有望逐步建立呼吸系统疾病的个性化防治平台,成为临床疾病防治策略研究的有力工具。
4 不足与展望
近年来,肺器官芯片已成为世界范围内医学研究的热点,并取得了不错的成绩。然而,由于肺部结构的复杂,肺芯片在模型设计、材料选择、仿生性能等方面仍存在诸多挑战。
首先,目前肺器官芯片主要集中在对肺泡、细支气管及肺泡-毛细血管屏障等功能单位的模拟,而呼吸系统疾病的发生并不仅仅局限于这些部位,基于上呼吸道如鼻、咽、喉等其他部位的疾病模型仍有待研发。第二,芯片制备常用材料的PDMS,某些特性(如疏水性、对小分子材料具有高吸收率等)可能会对实验产生影响,致使实验结果产生误差[23],因此要综合考虑生物兼容性、渗透性及制作工艺等选择不同的材料,如PMMA、聚苯乙烯等,降低材料本身对实验的影响。第三,芯片系统中培养基的体积远高于人体内组织液的体积,细胞的分泌物和代谢产物被不断稀释。第四,细胞在芯片系统中的铺展情况也会对细胞行为造成影响[24];第五,类器官作为近年来新兴的体外模型之一,是基于3D体外细胞培养系统建立的、由人体干细胞或器官祖细胞发育而来的与来源组织或器官高度相似的体外细胞模型,能模拟出组织的关键结构和功能,但类器官也存在一定的局限性,如缺乏血管网络、结缔组织和免疫细胞等微环境。基于此,类器官可与器官芯片相结合,借助微流控技术调控干细胞的分化及自组装,以克服类器官内营养物质输送困难等问题开发类器官芯片[25],可为临床上不可逆的肺损伤疾病的有效治疗提供新的思路。最后,单纯地依靠分子生物学等实验结果已不能满足快速发展的肺器官芯片领域,与先进的生物传感器、动态检测平台的联合将成为器官芯片未来发展的重要趋势。
肺器官芯片作为一种开创性的体外3D仿生模型,不仅成功构建了多种呼吸系统疾病的病理模型,精准模拟了细胞间的相互作用,再现了疾病的病理过程,还推动了毒性测试、药物研发、精准医疗等领域的发展。然而,如何实现肺芯片的标准化高通量制造、如何利用该技术实现完整的肺器官模拟而不只是特定结构的模拟以及如何将肺器官芯片与人体其他器官芯片建立联系等都是未来发展需要重点探索的方向。

