吸入胰岛素通过NLRP3炎症小体改善散发性阿尔茨海默病小鼠的认知功能
陶舒琪,范雯媛,郑昊宁,王 通,陈燕春,周 进,丁小娣,周风华,郭章玉
(1. 潍坊医学院基础医学院临床病理系,2. 山东省神经疾病与再生修复重点实验室,山东 潍坊 261053;3. 潍坊市人民医院神经外科,山东 潍坊 261000;潍坊医学院 4.基础医学院组织学与胚胎学教研室、5.药学院,山东 潍坊 261053)
阿尔茨海默病(Alzheimer’s disease, AD)作为最常见的神经退行性病变,其病因及发病机制尚未完全阐明。近年来研究发现,持续过度的炎症反应在AD等退行性疾病发病机制中发挥着至关重要的作用[1-2]。而小胶质细胞作为脑内的免疫效应细胞,是神经炎症最重要的介导者[3]。活化的小胶质细胞产生各种细胞因子导致神经元变性甚至死亡[2]。NLRP3炎症小体作为中枢神经系统最具特征的炎性小体,在小胶质细胞的表达量最高,并与AD的炎症反应有密切关系[4-5]。因此,作为炎症反应的重要参与者,靶向NLRP3炎症小体可能为AD治疗开辟新的途径。
研究表明,吸入胰岛素可以改善轻度认知功能障碍和AD患者的认知功能[6]。课题组前期研究也发现,吸入胰岛素可以改善APP/PS1转基因小鼠的学习和记忆能力[7],但这种保护作用的具体机制仍有待阐明。本研究采用链脲佐菌素(streptozotocin, STZ)侧脑室注射的散发性AD(sporadic AD, sAD)小鼠模型以及脂多糖(lipopolysaccharide, LPS)刺激BV2细胞活化的神经炎症模型,探讨胰岛素对sAD小鼠模型认知功能以及小胶质细胞内NLRP3炎症通路的影响。
1 材料与方法
1.1 实验动物及细胞36只SPF级C57BL/6 J雄性小鼠,12周龄,体质量(24~28) g,购自济南朋悦实验动物繁育有限公司,动物许可证编号:SCXK(鲁)2019-0003。饲养于恒温恒湿环境,并维持12 h明/暗周期,自由饮水与摄食。实验过程均符合动物伦理要求。BV2细胞来源于C57BL/6 J小鼠小胶质细胞,由美国哈佛大学王欣实验室馈赠。
1.2 主要试剂与仪器STZ(Sigma, S0130)、LPS(Solarbio, L8880)、DMEM高糖培养基(HyClone公司)、FBS(Gibco公司)、CD11b抗体(Cell Signaling Technology, 49420)、 Iba1抗体(Wako公司, 016-20001)、GFAP抗体(Cell Signaling Technology, 80788)、NLRP3抗体(Proteintech, 19771-1-AP)、ASC抗体(Proteintech,10500-1-AP)、Caspase-1抗体(Proteintech,22915-1-AP)、IL-1β抗体(Proteintech, 16806-1-AP)、HRP 标记的二抗(Proteintech)、Alexa fluor 488(Jackson ImmunoResearch Laboratoris)、脑立体定位仪(深圳瑞沃德)、Morris水迷宫(Panlab)、 冰冻切片机(Leica)、激光共聚焦显微镜(Leica)。
1.3 方法
1.3.1实验小鼠分组及处理 小鼠随机分为3组:对照组(Con),模型组(STZ-NS)和胰岛素治疗组(STZ-INS),每组12只。按参考文献[8]方法建立sAD小鼠模型。小鼠给予戊巴比妥钠(40 mg·kg-1)腹腔注射,头部固定于脑立体定位仪,暴露前囟,于前囟后0.3 mm,正中线右侧1.0 mm,距脑表面深度2.5 mm处,向右侧侧脑室缓慢注入3 μL STZ或等体积生理盐水,注射时间5 min,留针3 min,缓慢退针,消毒并缝合伤口。小鼠行STZ注射2周后,治疗组经鼻吸入胰岛素0.87 U·d-1,对照组和模型组吸入同体积生理盐水,给药4周后进行水迷宫实验。
1.3.2细胞培养及处理 按照参考文献[9]方法培养BV2细胞,将生长至对数期的BV2细胞以合适密度接种于6孔板。以不同浓度的胰岛素(0、1、10、100、500、1 000 nmol·L-1)预处理各组细胞1 h,然后给予LPS(1 mg·L-1)刺激BV2细胞,对照组给予正常培养基,24 h后收集细胞。所有细胞置于37 ℃、5% CO2培养箱孵育。
1.3.3水迷宫实验(Morris water maze,MWM) 给药4周后,采用MWM实验评价各组小鼠的空间学习与参考记忆能力。水迷宫水池直径1.2 m,平均分为4个象限,10 cm的平台随机固定于其中1个象限。前4 d,每只小鼠面向池壁从4个不同的入水点入水,记录小鼠60 s内找到水下平台的时间(逃避潜伏期)。第5天,移走平台。将小鼠从原平台象限的对侧放入水中。记录其在60 s内在原平台象限时间和进入该象限次数。
1.3.4免疫荧光 行为学结束后,小鼠腹腔注射戊巴比妥钠 (40 mg·kg-1) 麻醉,心脏灌注后取脑,取出脑组织依次进行后固定及蔗糖梯度脱水沉底后,OCT包埋行冰冻切片。取切片室温下晾片2 h,PBS清洗3次,3%Triton X-100 37 ℃孵育15 min,PBS清洗。10%羊血清封闭后滴加一抗Iba 1 (1 ∶100) ,4 ℃孵育过夜。PBS清洗后滴加Alexafluor 488标记的荧光二抗,室温孵育1 h。滴加DAPI染核,封片后于激光共聚焦显微镜下扫描观察。
1.3.5Western blot检测 提取各组小鼠海马组织、BV2细胞蛋白,BCA法检测蛋白浓度。根据分子量大小配制不同浓度凝胶,经SDS-PAGE电泳后进行转膜,后用5%脱脂牛奶封闭2 h。孵育一抗GFAP(1 ∶5 000)、CD11b(1 ∶1 000)、NLRP3(1 ∶1 000)、ASC(1 ∶1 000)、Caspase-1(1 ∶1 000)、IL-1β(1 ∶1 000)及GAPDH(1 ∶5 000),4 ℃过夜。HRP标记的二抗(1 ∶5 000)室温孵育2 h,滴加ECL显影液,采用化学发光成像系统Chemi DocTM显影。

2 结果
2.1 胰岛素对sAD小鼠认知功能的影响水迷宫结果显示,小鼠的游泳速度无明显差异(Fig 1A),表明胰岛素对小鼠的运动能力没有明显影响。3组小鼠的逃避潜伏期随天数变化逐渐缩短,并且模型组小鼠的逃避潜伏期较对照组明显延长,提示这些小鼠的学习能力受损(Fig 1B)。而治疗组与对照组相比没有明显差异,表明吸入胰岛素对sAD小鼠的学习能力有一定的改善作用(Fig 1B)。此外,模型组小鼠在原平台象限的时间和穿越原平台次数明显减少(Fig 1C,D),提示这些小鼠的空间记忆能力受损。吸入胰岛素能够明显增加sAD小鼠的停留时间和穿越次数(Fig 1C,D),表明吸入胰岛素可以改善sAD小鼠的空间记忆损害。
2.2 吸入胰岛素对小鼠海马CD11b和GFAP蛋白表达水平的影响为了研究吸入胰岛素对ICV-STZ小鼠脑内神经炎症的影响,我们用Western blot检测了CD11b(小胶质细胞的标记物)和GFAP(星形胶质细胞标记物)的表达水平。结果显示,与对照组相比,模型组小鼠海马内CD11b和GFAP表达明显升高,而胰岛素治疗可以降低CD11b和GFAP表达水平(Fig 2)。
2.3 吸入胰岛素对小鼠海马小胶质细胞活化的影响为了研究胰岛素对sAD小鼠脑内小胶质细胞活化的影响,我们采用免疫荧光实验检测了海马CA1、CA3及DG区Iba1的表达。结果显示,与对照组相比,模型组小鼠海马CA1、CA3及DG区小胶质细胞数量明显增加,而吸入胰岛素能够明显降低模型组小鼠海马各区小胶质细胞数量(Fig 3A-D)。
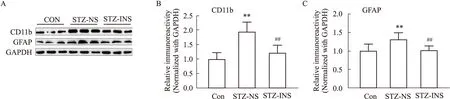
Fig 2 Effect of intranasal insulin on expression of CD11b and GFAP in hippocampus of mice
2.4 吸入胰岛素对小鼠海马NLRP3炎症小体通路相关蛋白表达的影响为了研究吸入胰岛素对sAD小鼠海马NLRP3炎症小体通路相关蛋白表达的影响,我们用Western blot检测了NLRP3、ASC、Caspase-1、IL-1β的表达。结果显示,与对照组相比,模型组小鼠海马内NLRP3、ASC、Caspase-1、IL-1β表达升高(Fig 4)。吸入胰岛素能够显著降低NLRP3、ASC、Caspase-1、IL-1β表达水平(Fig 4)。
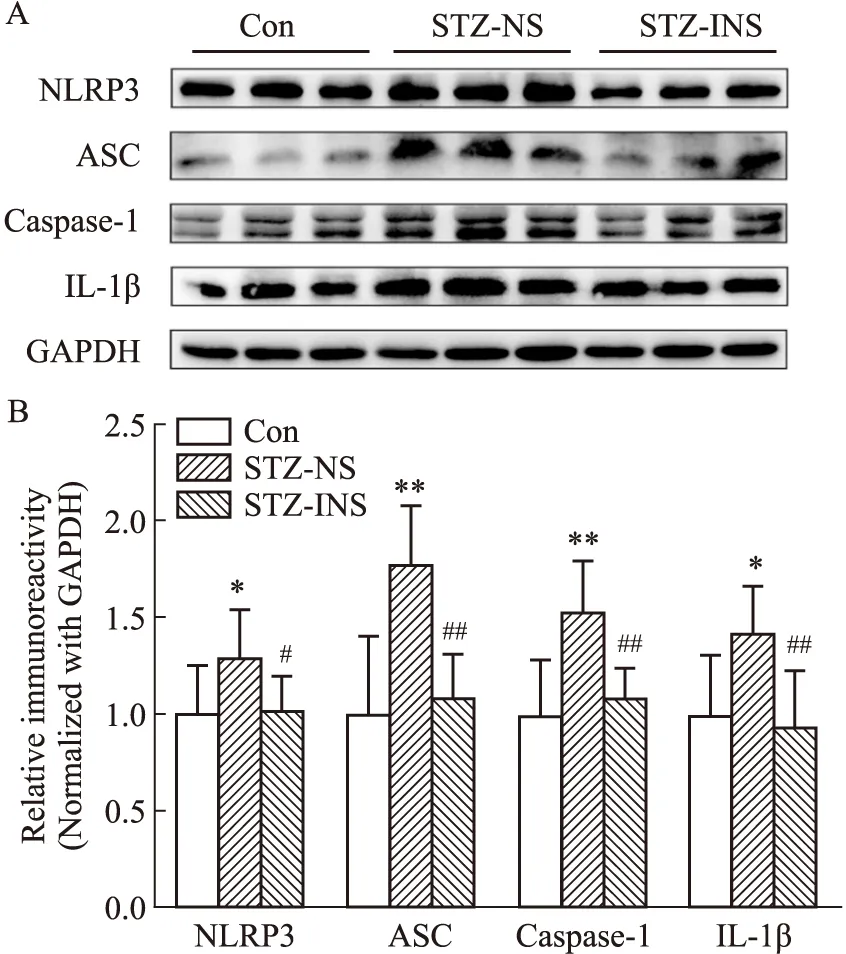
Fig 4 Effect of intranasal insulin on expression of NLRP3 inflammasome pathway related proteins in hippocampus of mice
2.5 胰岛素对BV2细胞NLRP3炎症小体通路相关蛋白表达的影响为了在体外实验进一步验证胰岛素对小胶质细胞NLRP3炎症小体的影响,我们以LPS刺激BV2细胞使其活化诱导神经炎症模型,观察不同浓度胰岛素预处理对活化的BV2细胞内NLRP3炎症小体通路相关蛋白表达的影响。Western blot结果显示,与对照组相比,LPS刺激后,BV2细胞内NLRP3、ASC、Caspase-1、IL-1β表达明显升高,而胰岛素(100 nmol·L-1)处理组可显著降低BV2细胞内NLRP3、ASC、Caspase-1、IL-1β表达水平(Fig 5)。
3 讨论
研究发现,AD患者脑内胰岛素信号通路调节异常[10]。因此,靶向胰岛素信号通路治疗AD成为近年来的研究热点[11]。本实验采用的吸入给药方式,可以使胰岛素通过嗅黏膜直接进入脑脊液,而对外周血糖和胰岛素水平几乎没有影响[6]。尽管已有临床实验证实,吸入胰岛素对AD患者认知功能的保护作用,但潜在的具体机制仍不清楚。本研究采用的ICV-STZ小鼠模型可表现为认知功能受损和AD样的病理改变,如神经炎症、脑代谢降低、胰岛素抵抗和tau蛋白过度磷酸化等,被认为是研究散发性AD发病机制及药物研发的重要动物模型之一[8]。我们的研究结果表明,ICV-STZ小鼠出现了学习能力和空间记忆损害;而吸入胰岛素后,ICV-STZ小鼠学习能力和空间记忆损害得到明显改善。我们前期发现吸入胰岛素也可以改善 APP/PS1转基因小鼠模型的认知功能[7],这也更加证明了胰岛素具有改善AD认知功能的保护作用。

Fig 5 Effect of insulin on expression of NLRP3 inflammasome pathway related proteins in BV2 cells
越来越多的研究表明,神经炎症在AD的发生发展过程中起着至关重要的作用。小胶质细胞和星形胶质细胞作为神经炎症重要的介导者,其活化和增生在AD病理发展进程中早于Aβ和神经原纤维缠结形成[12]。本实验发现,ICV-STZ小鼠脑内GFAP、CD11b和Iba1表达明显升高,说明STZ注射可导致小鼠脑内星形胶质细胞增生和小胶质细胞过度激活,而吸入胰岛素可以明显降低GFAP、CD11b和Iba1表达水平。这些结果表明,吸入胰岛素可有效抑制ICV-STZ小鼠脑内星形胶质细胞和小胶质细胞介导的神经炎症。
NLRP3炎症小体是由核苷酸结合寡聚化结构域样受体3(NLRP3)、凋亡相关斑点样蛋白(ASC)和半胱氨酸蛋白酶Caspase-1前体蛋白组成的大分子多蛋白复合体。损伤、刺激(如Aβ)等因素可以诱导NLRP3 结合ASC并招募 pro-caspase-1形成复合体。并依次活化Caspase-1和IL-1β,引发神经炎症级联反应,导致神经元死亡。NLRP3炎症小体激活在小胶质细胞激活中发挥核心作用。研究发现,NLRP3炎症小体可调控海马小胶质细胞表型转化从而参与小胶质细胞活化[13]。NLRP3炎症小体在Aβ 诱导的小胶质细胞增生和Aβ 病理中的重要作用已明确[14-15]。最近又有研究者发现,NLRP3炎症小体通路在tau转基因小鼠内源性和外源性tau病理播散过程中发挥重要作用[16]。由此可见,NLRP3炎症小体在AD相关神经炎症的发展过程中发挥着至关重要的作用。我们的研究发现ICV-STZ小鼠海马NLRP3、ASC、Caspase-1、IL-1β 表达明显升高,表明STZ可以使小鼠脑内NLRP3炎症小体激活。而吸入胰岛素可以明显降低NLRP3炎症小体通路相关蛋白表达水平,表明吸入胰岛素可抑制ICV-STZ小鼠脑内NLRP3炎症小体激活。研究表明,小胶质细胞的过度激活在认知障碍的发生发展中扮演重要角色,而NLRP3炎症小体激活在小胶质细胞活化中发挥核心作用[12]。因此,我们推测胰岛素可能是通过减轻NLRP3炎症小体介导的神经炎症改善散发性AD小鼠的认知功能。
Spielman等[17]为了观察胰岛素是否具有抗炎作用,将人胶质瘤来源的小胶质细胞加入IL-6, TNF-α和IL-1β的混合物,使用不同浓度的胰岛素处理发现,低浓度的胰岛素可表现为促炎作用;而高浓度的胰岛素表现为抗炎作用。而另一项研究发现胰岛素可显著减少LPS刺激的BV2细胞内NO,ROS、TNF-α和诱导性一氧化氮合酶(iNOS)的产生,并增加BV2细胞的吞噬活性[18]。因此,为了进一步明确胰岛素对小胶质细胞炎性改变的作用尤其是NLRP3炎症小体的影响,我们以LPS刺激BV2细胞使其活化诱导神经炎症模型,观察胰岛素预处理对活化的BV2细胞内NLRP3炎症小体通路相关蛋白表达的影响。结果显示,与对照组相比,LPS刺激后,BV2细胞内NLRP3、ASC、Caspase-1、IL-1β表达明显升高,而胰岛素(100 nmol·L-1)处理组BV2细胞内NLRP3、ASC、Caspase-1、IL-1β表达明显降低。而胰岛素浓度再提高时,对炎症小体相关蛋白的抑制作用减弱,这种现象可能是由于胰岛素受体(INSR)结合位点变得饱和,反过来可能导致受体位点之间的负协同效应。以上结果表明,适量浓度胰岛素可发挥抗炎作用。小胶质细胞可以表达胰岛素受体以及胰岛素样生长因子1受体,胰岛素与相关受体结合后激活下游信号通路从而发挥神经保护作用[11], 但胰岛素影响NLRP3炎症小体通路的具体机制仍需进一步研究。
综上所述,STZ可以导致小鼠认知功能下降,机制可能与NLRP3炎症小体介导的神经炎症有关。而胰岛素能够减轻NLRP3炎症小体介导的神经炎症,从而发挥神经保护作用,改善散发性AD小鼠的认知功能损害。本研究从神经炎症这一新的角度阐明胰岛素在AD治疗中的作用及机制,为AD治疗提供了理论依据。

