基于生物信息学的氧化苦参碱重定位及作用机制研究
——以多发性硬化症为例
孔德鑫,张明亮,陈毓龙,李伟霞,,王晓艳,,吴娅丽,杨柳青,张 辉,陈小菲,李寒冰,吴宿慧,唐进法,
(河南中医药大学 1.药学院、2.第一附属医院/河南省中药临床应用、评价与转化工程研究中心/河南省中药临床药学中医药重点实验室,河南 郑州 450000)
药物重定位,也称为“药物再利用或药物再循环”,是通过发现已批准上市药物或潜在候选药物中寻找新的适应症的策略。与传统的药物开发模式相比,已上市的药物建立了完善的工艺流程、成熟的药代动力学,明确的不良反应、各期临床数据,从而大大减少了药物的研发成本,并降低了药物研发失败的风险,故对已上市药物进行重定位作为药物开发的一种研发思路而备受关注[1]。如反应停(Thalidomide)曾用于妊娠反应,后发现对孕妇具有严重的致畸性而被禁用,经药物重定位后,发现其对红斑结节性麻风等多种疾病具有良好的治疗效果。随着高通量测序技术成本的降低和药物研发相关数据的不断积累,通过生物信息学技术寻找药物的新适应证或新用途,进而揭示潜在的治疗作用机制,成为药物重定位新的研究热点。目前已经有学者成功应用生物信息学技术对二甲双胍进行重定位,发现其还可以通过抑制角质形成细胞中的活性氧(reactive oxygen species,ROS)产生,抑制MAPK信号通路,减轻炎症反应来发挥治疗红斑痤疮的作用[2]。提示我们可以把这种方法应用在更多正在临床广泛应用或因严重不良反应已经撤市的药物重定位研究当中。
氧化苦参碱(oxymatrine,OMAT)具有四环喹嗪啶类结构的生物碱,是豆科植物苦参(SohoraflavescensAit.)和苦豆子(SophoraalopecuroidesL.)中的主要化学成分,已被临床医生成功应用慢性乙肝和癌症的治疗,具有良好的疗效[3],但其他方面的应用较少,难以全面评价OMAT的药理作用。本研究利用GEO数据库筛选OMAT可调控人或动物的差异表达基因,通过Coexpedia数据库和CMap数据库对OMAT进行重定位,寻找OMAT潜在的临床适应症,采用动物实验对重定位结果进行验证,并进行作用机制探索,以期为今后OMAT的实验研究及临床应用提供新的实验依据和方法借鉴。
1 材料与方法
1.1 试剂和仪器氧化苦参碱(A800927,Macklin公司);4%多聚甲醛(71040900,Biosharp生物科技公司);MOG35-55(MEVGWYRSPFRVVHLYRNGK,L2880,GenScript公司);百日咳毒素(#180,List Biological公司);弗氏不完全佐剂(#F5506,Sigma公司);结核分枝杆菌H37Ra(#231141,Difco公司);RNA提取试剂盒、逆转录试剂盒、2×SYBR Green qPCR Mix试剂均购自上海奕杉生物科技有限公司;引物(北京天一辉远生物科技有限公司);生理盐水(2112293201,石家庄四药有限公司);QuantStudio 6 Flex荧光定量PCR仪(applied-biosystems公司)。
1.2 实验动物SPF级C57BL/6雌性小鼠12只,8~10周龄,体质量18~20 g,购自北京斯贝福实验动物技术有限公司,合格证号:SCXK(京)20190010,所有动物的饲养及实验操作均符合实验动物福利及伦理要求。
1.3 生物信息学研究
1.3.1差异表达基因(differentially expressed genes,DEGs)的筛选 基于GEO数据库(https://www.ncbi.nlm.nih.gov/geo/),以“oxymatrine”为关键词检索其调控的相关基因表达数据信息,应用GEO在线分析工具GEO2R进行分析,以P<0.05,∣Log2FC∣≥1.5[FC表示差异倍数(fold change)]为筛选条件,所筛选出的基因被视为OMAT可调控的DEGs。
1.3.2DEGs的共表达分析和MESH注释 Coexpedia数据库(https://www.coexpedia.org/)是一个基因共表达的数据库,用于揭示基因共表达和医学主题词(Medical Subject Headings,MESH)之间的联系。将OMAT调控的DEGs上传至Coexpedia数据库,筛选相关的医学主题词。
1.3.3获取与OMAT基因表达谱相似的化合物 CMap数据库是一个由Broad Institute(布罗德研究所)开发,汇总不同的小分子化合物扰动不同类型细胞基因表达变化,从而联立小分子药物、基因表达相关的数据库数据库(https://clue.io/)。将OMAT干预后的DEGs上传到CMap数据库,匹配与OMAT基因表达谱相似的化合物,匹配的化合物通过得分(+100,-100)反映匹配化合物与OMAT干预后基因表达谱的相似性,得分越高,说明该化合物的基因表达谱与OMAT干预后基因表达谱越相似。选取得分前十的化合物视为OMAT类似化合物,结合Drugbank数据库(https://www.drugbank.ca/)和文献检索OMAT类似化合物的药理作用,进行后续分析。
1.3.4OMAT重定位及代表性适应症靶点的收集 结合MESH注释结果与CMap 匹配化合物的药理作用,对OMAT进行药物重定位,选取其中最具代表性的适应症进行后续研究,并基于GeneCards (https://www.genecards.org/)、DisGeNET (https://www.disgenet.org/)、OMIM(https://www.omim.org/)数据库,检索代表性适应症的靶点。进而取其与OMAT调控DEGs的交集靶点,获得OMAT调控代表性适应症的潜在靶点。
1.3.5蛋白质相互作用(protein-protem interaction,PPI)网络构建及核心靶点筛选 将整合后的交集靶点导入STRING数据库(https://cn.string-db.org/)分析,物种设定为“Homo Sapiens”并将结果通过 Cytoscape 3.9.0进行PPI网络图的构建,分析其网络拓扑参数,筛选出核心靶点。
1.3.6GO和KEGG富集分析 为进一步探究OMAT调控所选取的代表性适应症的潜在作用机制等,将“1.3.4”筛选的OMAT调控代表性适应症的潜在靶点上传至DAVID数据库(https://david.ncifcrf.gov/)进行基因功能分类(gene ontology,GO)和信号通路富集(kyoto encyclopedia of genes and genomes,KEGG)分析。GO分析包括细胞组成(cellular component,CC)、生物学过程(biological process,BP)、分子功能(molecular function,MF)。
1.4 动物实验验证
1.4.1造模和给药 实验自身免疫性脑脊髓炎(experimental autoimmune encephalomyelitis,EAE)的发病机制、临床表现与多发性硬化症(multiple sclerosis,MS)相似,是国际通用的MS模型,故选用EAE动物模型进行验证[4]。将12只小鼠分为2组:模型组(EAE组)、OMAT治疗组(EAE+OMAT组),每组6只。取无菌MOG35-55用0.1 mol·L-1的PBS稀释成2 g·L-1的溶液,与内含2 g·L-1灭活结核分枝杆菌的完全弗氏佐剂溶液按1 ∶1等体积混合,制成油包水乳液。50 mg·kg-1戊巴比妥溶液麻醉小鼠后,在其脊柱两侧分四点皮下注射0.2 mL抗原乳剂,并于免疫后d 0、d 2给每只小鼠腹腔注射200 ng百日咳毒素。EAE+OMAT组小鼠于免疫后d 10开始,每天1次灌胃20 mg·kg-1OMAT生理盐水溶液;EAE组小鼠则同时给予等量生理盐水溶液,均给药至免疫后d 19。
1.4.2神经功能学评分 自免疫当日起,每日观察并记录小鼠的神经功能学评分[5]0分,无明显症状;1分,尾部无力;2分,后肢无力;3分,后肢瘫痪;4分,前、后肢均瘫痪;5分,濒死或死亡。若小鼠的神经功能表现介于两个评分之间,以±0.5分计,评分≥1即视为发病,纳入后续研究。
1.4.3组织病理检查 实验小鼠于免疫后第19天,用生理盐水进行心脏灌流,取脑和脊髓,取出的脊髓组织液氮速冻后转移至-80 ℃冰箱冻存,脑组织固定于4%多聚甲醛24 h后,经石蜡包埋、切片、脱水,进行苏木精-伊红(HE)染色和勒克司坚牢蓝(LFB)染色以分别观察脑组织炎症浸润与髓鞘脱失程度,并进行相关评分[6]。炎性浸润评分标准:0分,无炎症细胞;1分,少量分散的炎症细胞;2分,血管周围炎症细胞浸润,呈袖套样;3分,大量血管袖套样病变。髓鞘脱失评分标准:0分,无髓鞘脱失;1分,罕见髓鞘脱失;2分,少量部位脱髓鞘;3分,大面积脱髓鞘。
1.4.4RT-PCR检测验证OMAT调控MS的核心靶点 将脊髓组织按照总RNA提取试剂盒说明提取总RNA,合成cDNA。以cDNA做模板,按2×SYBR Green qPCR Mix试剂说明,加入引物进行扩增(引物序列见Tab 1)。采用△△CT法分析CT值,以2-ΔΔCT表示各组基因的相对表达量。

Tab 1 Primers of PCR products of genes

2 结果
2.1 OMAT干预后的DEGs分析结果基于GEO数据库筛选得编号为GSE85871的OMAT调控MCF7 细胞的基因表达数据集,采用GEO中的在线分析工具GEO2R进行分析,筛选得到DEGs共619个,其中明显下调的DEGs有274个;明显上调的DEGs有345个,据所筛选出的DEGs作火山图,见Fig 1。
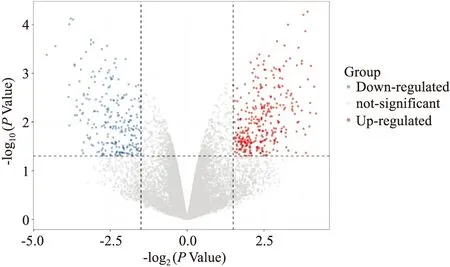
Fig 1 Volcano plot of DEGs
2.2 OMAT干预后DEGs的共表达结果通过Coexpedia查询OMAT干预后的DEGs的共表达网络和MESH注释结果。MESH注释得到243个条目,Score代表各基因之间共表达关系大小。筛选Score前10的疾病主题词,见Tab 2,因OMAT临床已经用于多种癌症和肝炎,故肿瘤和肝炎相关主题词不纳入后续研究。主要包括呼吸系统疾病(希佩尔-林道综合症、哮喘)、炎症相关疾病(关节炎、肠炎)和自身免疫性疾病(系统性红斑狼疮、MS)。
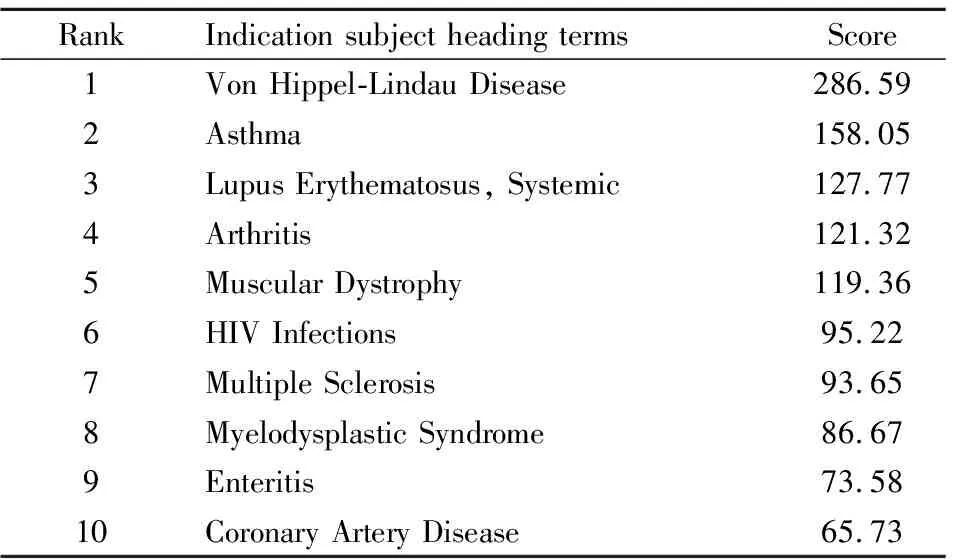
Tab 2 Analysis of annotations in co-expression networks
2.3 CMap匹配结果和药物重定位以GSE85871相同的细胞MCF7为对象,匹配得到2 398个与OMAT具有一定相似性的小分子化合物。选取得分前十的化合物视为OMAT类似化合物,见Tab 3,并结合Drugbank数据库(https://www.drugbank.ca/)和文献检索OMAT类似化合物的药理作用,发现OMAT类似化合物的药理作用主要涉及心血管、神经、免疫等多个系统,包括MS、肝炎、关节炎、心血管疾病、肿瘤等多种疾病。
综合分析DEGs注释得到的疾病主题词和OMAT类似化合物所对应的适应症,发现均聚焦到MS、哮喘、关节炎等疾病,推测OMAT可能具有这些疾病的潜在治疗作用。而在OMAT类似化合物中,具有治疗MS药理作用的化合物出现频次最高。因此,以MS为例进行后续研究。
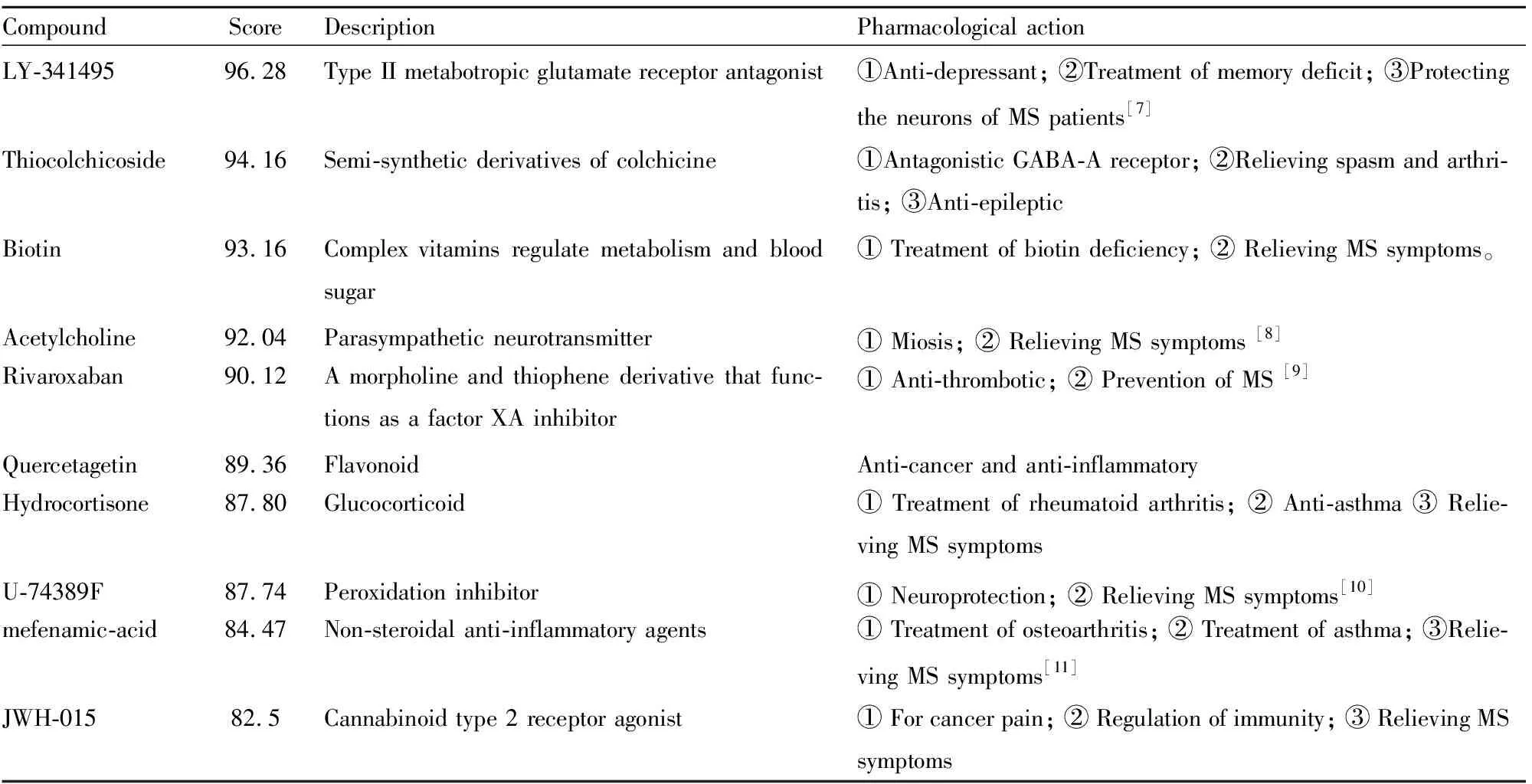
Tab 3 Top 10 molecule compounds with high similarity to OMAT gene expression profiles

Fig 2 Analysis of interaction between OMAT and MS
2.4 OMAT治疗MS交集靶点筛选以“Multiple Sclerosis”,“Relapsing-remitting Multiple Sclerosis”,“Progressive Multiple Sclerosis”为关键词在GeneCards、OMIM、DisgeNet数据库中收集MS相关靶点,Genecards数据库共收集到144 423个相关靶点,选“Relevance score”前1 000的靶点进行研究,而DisgeNet数据库中“Gda score”越高与疾病相关性越强,选择Gda score>0.1的靶点进行研究。共得到MS相关靶点1 267个,与OMAT调控的DEGs取交集,得到54个潜在的OMAT调控MS的基因靶点,见Fig 2A。
2.5 OMAT治疗MS交集靶点的PPI网络在STRING数据库对交集的靶点进行蛋白互作分析,利用Cytoscape 3.9.0构建PPI网络图,见Fig 2 B。对网络进行分析,选取Degree值≥13(中位值)的靶点作为核心靶点,依次为FGF2、IL4、ICAM1、CD86、CCL4、LEP、IL2RA。这些靶点涉及炎症反应和中枢神经系统等方面,提示,OMAT可能通过作用这些靶点来发挥治疗MS的作用机制。
2.6 OMAT治疗MS交集靶点富集分析结果GO分析结果表明,BP主要涉及ERK1和ERK2的调节、免疫应答、细胞凋亡等;CC主要涉及质膜、细胞质等;MF主要涉及蛋白质结合、细胞因子活性等,结果见Fig 3。KEGG信号通路富集结果表明,交集靶点主要富集到JAK-STAT、钙离子、Ras等多条信号传导通路,结果见Fig 4。推测OMAT治疗MS的作用可能与以上功能过程和信号传导通路相关。
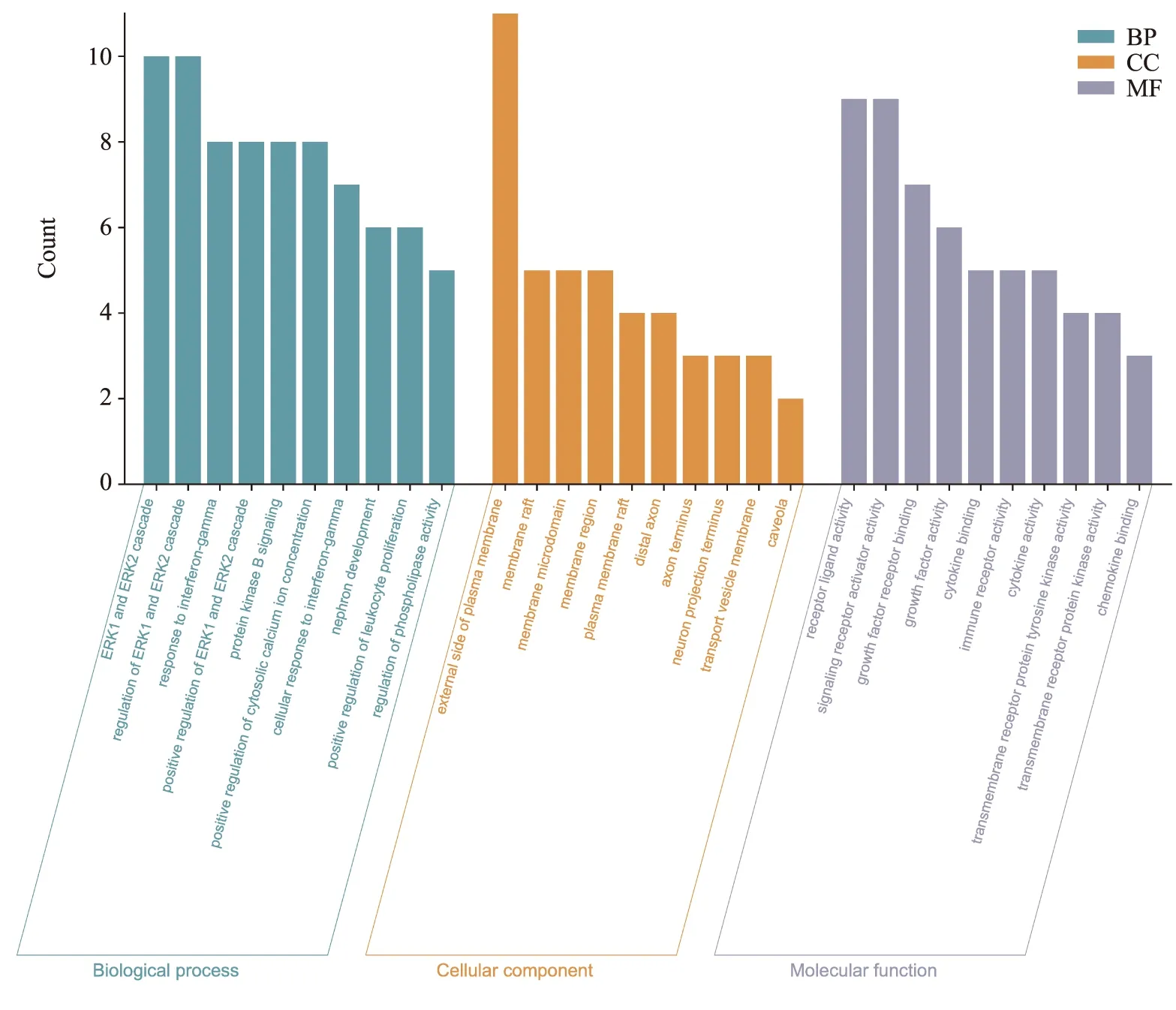
Fig 3 Results of gene function GO enrichment analysis
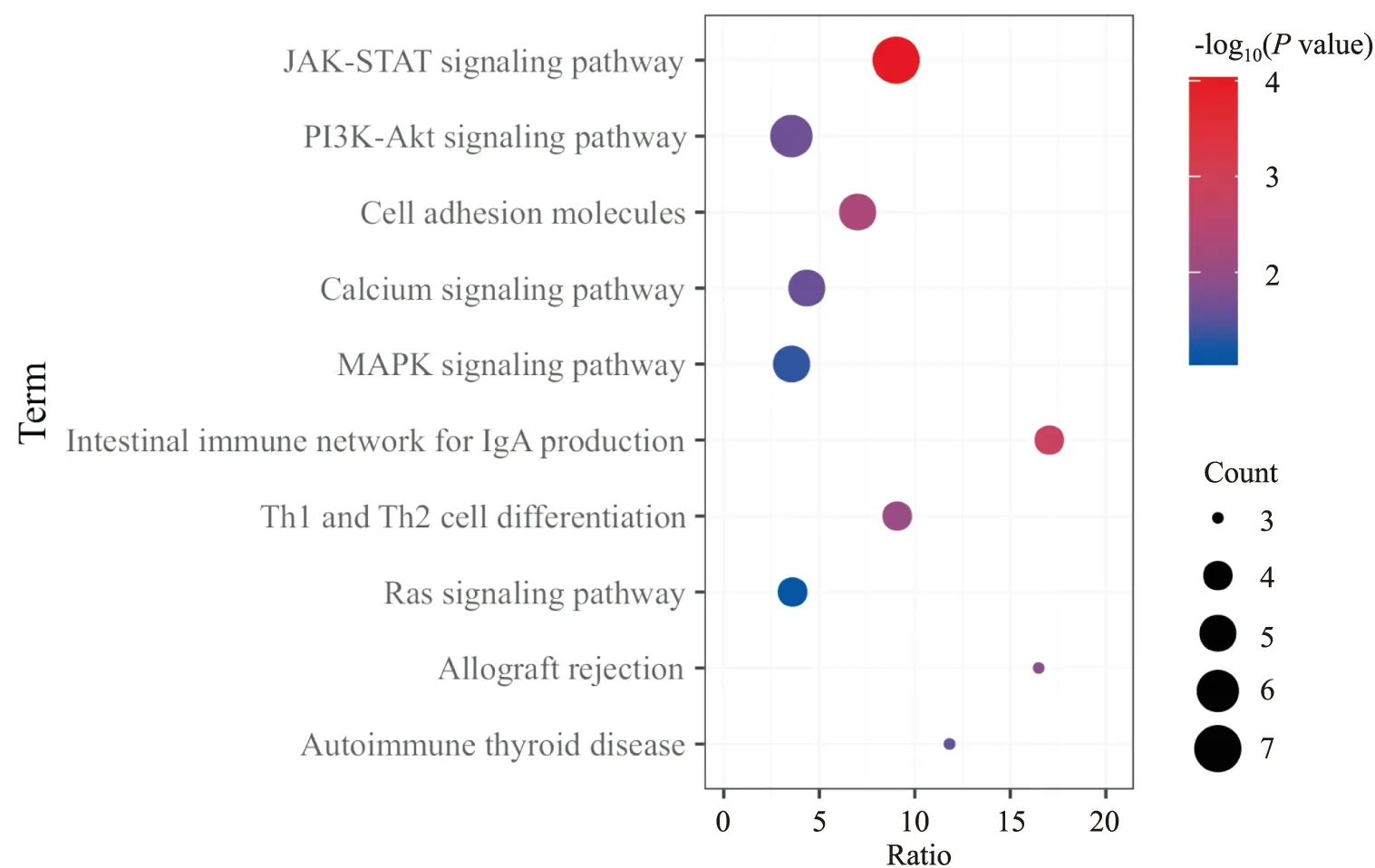
Fig 4 Results of gene function KEGG enrichment analysis
2.7 动物实验验证
2.7.1OMAT对EAE小鼠神经功能评分的影响 EAE组小鼠于d 9相继开始发病,d 11起出现明显的发病症状,在d 19达到峰值。OMAT+EAE组小鼠于d 10相继开始发病,d 14起出现明显的发病症状。相比EAE组小鼠,EAE+OMAT组小鼠平均神经功能学评分明显降低(P<0.01),见Fig 5。
2.7.2OMAT对EAE小鼠病理组织的影响 与EAE组小鼠比较,EAE+OMAT组小鼠脑组织炎症浸润程度明显减轻(P<0.01);髓鞘脱失评分结果表明,EAE+OMAT组小鼠比EAE组小鼠脑中髓鞘脱失程度明显减轻(P<0.01),见Fig 6。
2.7.3OMAT对EAE小鼠脊髓中mRNA表达的影响 与EAE组小鼠相比,EAE+OMAT组小鼠脊髓的Fgfr2、Rras2、Raf1、Camk2a、Calm1的mRNA表达水平明显降低(所有P<0.05),Fgf2的mRNA表达水平明显升高(P<0.05),见Fig 7。
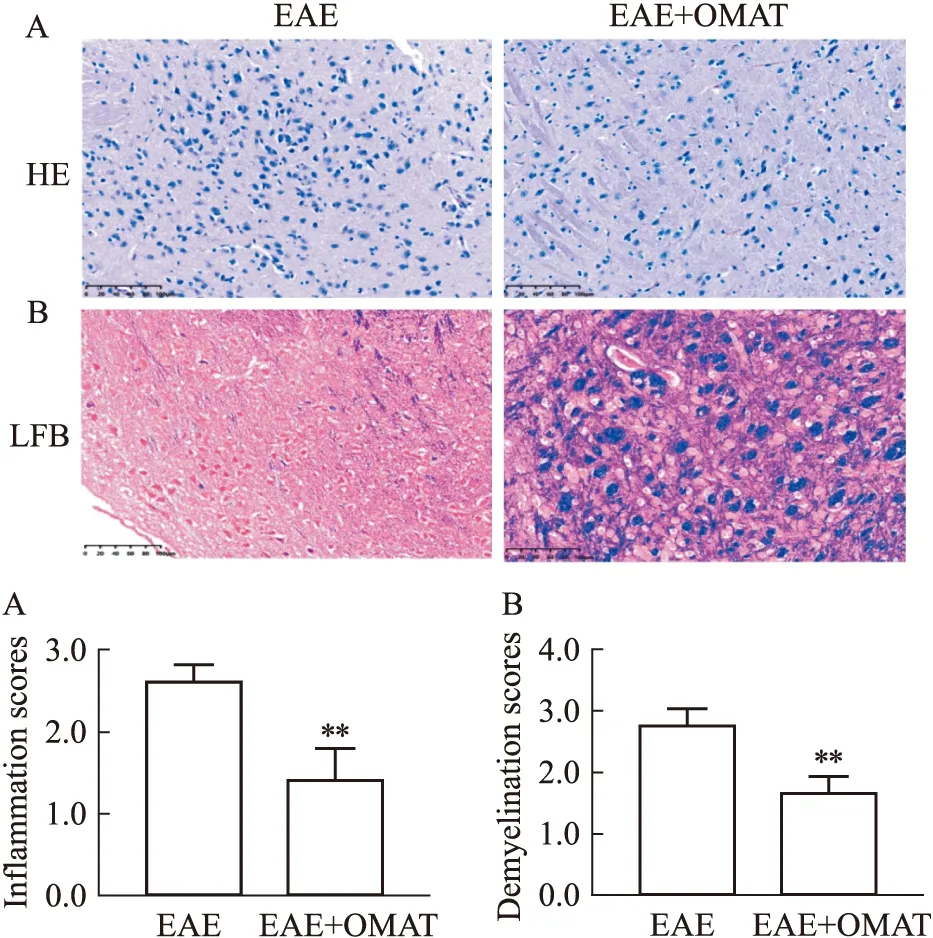
Fig 6 HE (A) and LFB staining (B) in mouse brain
3 讨论
与传统的药物研发策略相比,基于已上市药物的重定位不仅可以减少研发成本、节省研究周期,并能够扩大药物的应用范围,因此通过重定位扩大药物的应用范围备受关注[1]。OMAT作为临床上广泛应用于肝炎和癌症的天然生物碱,具有价格适宜、不良反应少的优点[3]。本研究利用药物重定位策略,发现 OMAT 具有潜在治疗MS、关节炎等疾病的药理作用,并以MS为例进行后续研究。
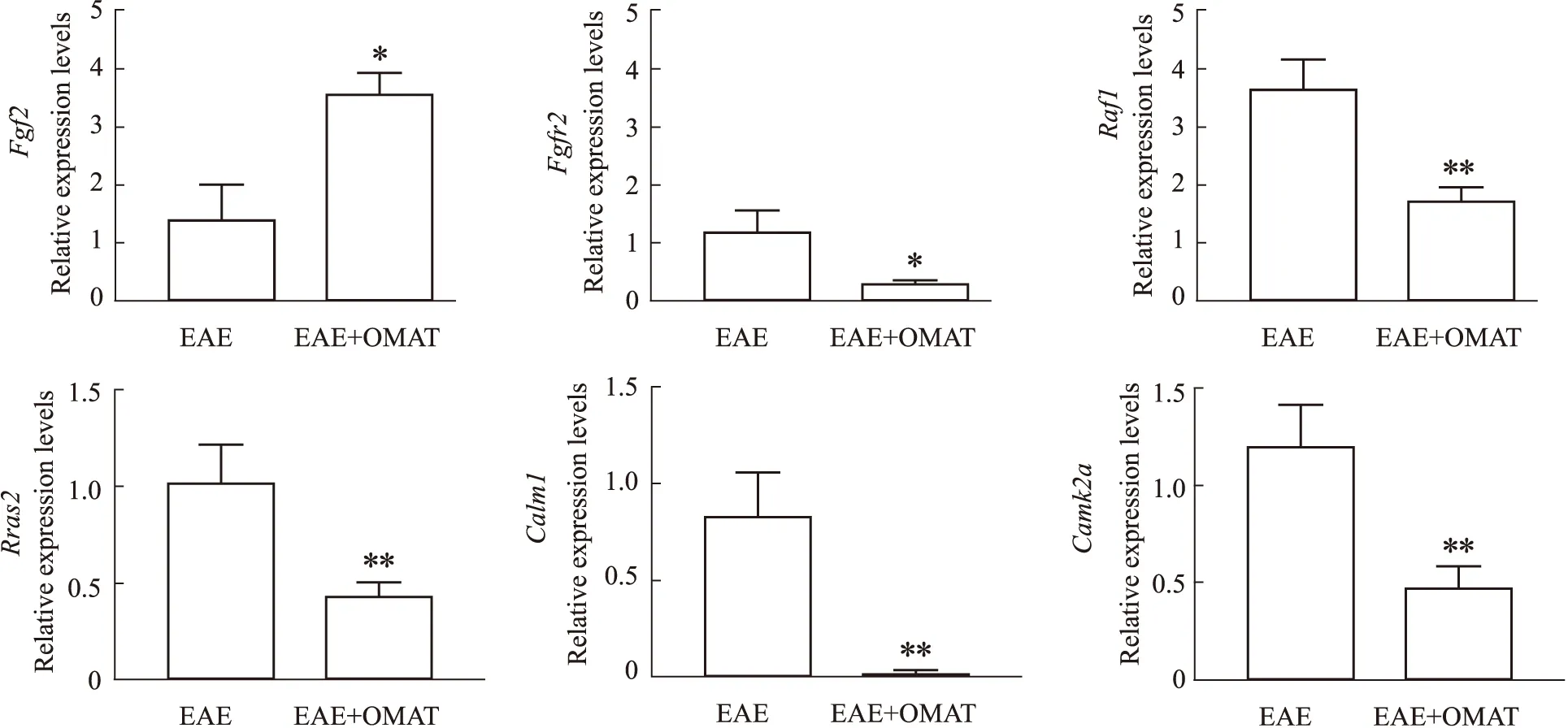
Fig 7 The mRNA levels of target genes in spinal cord tissues of mice in each
在分析CMap数据库中筛选得到的与OMAT基因表达谱相似的小分子化合物中,糖皮质激素类化合物(hydrocortisone)可以通过抗炎和免疫抑制的作用治疗MS等自身免疫性炎症性疾病;作用于中枢作用的化合物(LY-341495、acetylcholine、U-74389F、JWH-015)可以通过调控中枢神经的信号传递,从而改善MS引起的中枢神经损伤[7-9]。抗炎类化合物(mefenamic-acid、quercetagetin)通过调节免疫,抑制关节炎的炎症反应,并对EAE小鼠具有神经保护作用[10]。抗血栓形成类化合物(rivaroxaban)通过抑制XA因子,抑制血栓形成,对于心血管疾病具有预防作用[11]。根据上述这些与OMAT基因表达谱相似的小分子的药理作用及适应症,推测OMAT除了用于肝炎和癌症的治疗外,还有望对MS和关节炎起到一定治疗的作用。本研究发现相似性得分前10的小分子化合物中有8种小分子均具有调控MS的作用。因此,选择MS代表性的适应症进行后续研究。MS是一种以免疫细胞浸润、髓鞘脱失为主要病理特征的中枢神经系统自身免疫性疾病,具有易复发和致残率高的特点[12]。本研究采用国际公认的MS动物模型 (EAE)来验证OMAT是否对MS具有治疗作用,结果发现OMAT明显减轻了EAE小鼠发病程度,且中枢神经系统炎症细胞浸润、髓鞘脱失程度明显减轻,证实了基于药物重定位策略寻找OMAT的新适应症具有一定的可行性。
研究表明,ICAM1可以参与T淋巴细胞与血脑屏障的血管内皮细胞结合,介导T淋巴细胞转入中枢神经,从而加重MS的免疫浸润[13]。IL4可以调节中枢神经中免疫细胞的分化,促进免疫调节因子的分泌,参与免疫调节的过程,从而改善MS患者的发病情况[14]。而Fgf2是成纤维细胞生长因子家族的重要一员,在脱髓鞘和再髓鞘化过程中具有重要作用。一方面,Fgf2可以促进少突胶质前体细胞的增殖和分化,促进髓鞘的形成过程,且敲除Fgf2的EAE小鼠脊髓的神经纤维变性和轴突丢失程度明显增加,再髓鞘化轴突的数量明显减少。但另一方面,Fgf2可以通过与受体Fgfr2相互作用,激活Wnt信号通路来干扰髓鞘形成,但阻断Wnt信号通路后则完全消除了Fgf2对髓鞘形成的抑制作用[15]。提示我们Fgf2可能对髓鞘再生过程中具有双向调节作用。而在PPI分析中也同样筛选出了Fgf2、IL4、ICAM1等核心靶点。且动物实验也证实了OMAT 确可明显下调Fgfr2的表达,并明显上调Fgf2表达。对于OMAT 对ICAM1与IL4的调节作用,焦霞等[16]研究发现,OMAT可通过下调ICAM1的表达,上调IL4的表达,从而减轻哮喘小鼠的发病程度总结以上研究可知,OMAT可能通过调控Fgf2、IL4、ICAM1、Fgfr2等靶点发挥治疗MS的作用。
KEGG通路富集结果显示,OMAT治疗MS的核心通路主要涉及Ras信号通路和钙离子信号通路等。Ras信号通路参与细胞的增殖、分化、炎症反应及凋亡等生理过程,是自身免疫病中炎症反应的重要通路,Ras蛋白在Ras通路起信号开关作用,当Ras蛋白激活后,将Raf1蛋白募集到细胞上使其磷酸化,进而调控下游ERK通路,刺激免疫细胞释放多种炎性因子,从而参与MS的自身免疫反应[17]。钙离子信号通路在神经元细胞间神经递质的传递、细胞凋亡等过程起到重要作用,当神经胶质细胞在受到刺激后,释放过量的兴奋性氨基酸,造成兴奋性氨基酸在髓鞘中过度堆积,从而激活钙离子信号通路中的CALM1和CAMK2a靶点,促使Ca2+大量内流,细胞内Ca2+浓度超载,导致细胞损伤,最终导致中枢神经的损伤[18]。本研究证实,OMAT确可明显下调Ras信号通路的关键靶点Rras2、Raf1和钙离子信号通路的关键靶点Camk2a、Calm1的表达,提示OMAT可能通过调控Ras和钙离子信号通路的关键靶点发挥治疗MS的作用。
综上所述,本研究通过生物信息学探讨了一种对OMAT的药理作用进行重定位的方法,结合动物实验分析OMAT可能为治疗MS的潜在药物,并分析OMAT可能的作用靶点及通路,该研究将有助于充实OMAT治疗MS的相关研究,为OMAT的临床应用提供更多实验依据。

