红景天苷调控AMPK/Drp1信号通路对急性脑出血大鼠的神经功能的保护机制
陈瑞娟,郑永先,汤 旺,关小容
(1. 中南大学湘雅医学院附属海口医院,海南 海口 570208;2. 中南大学湘雅二医院老年医学科,湖南 长沙 410000)
脑出血(intracerebral hemorrhage, ICH)是一种常见的严重脑血管疾病,约占所有中风的15%~20%,ICH是一种死亡率和发病率很高的疾病[1]。当ICH患者脑血管突然破裂后,血肿的形成和邻近组织的机械损伤会导致颅内压急剧升高,该损伤被认为是脑原发性损伤[2]。临床上针对ICH后原发性脑损伤进行手术切除血肿很少会影响患者神经功能恢复[3],但红细胞碎片和血液成分会引发ICH后继发性脑损伤,导致炎症反应、氧化应激、神经元凋亡、线粒体功能障碍和血脑屏障(blood brain barrier,BBB)破坏,进而严重影响患者神经功能[4]。近几十年来,大多数实验研究都集中在ICH继发性损伤的机制上,以寻找新的ICH治疗靶点[5]。在许多研究中都观察到了ICH发生过程中伴随着神经细胞凋亡[6],同时研究也证实神经元细胞凋亡是ICH的细胞基础,也可能是ICH治疗或控制的新靶点。近年来研究认为氧化应激产生的大量活性氧(reactive oxygen species,ROS)和炎症反应产生的炎症因子与ICH密切相关,可诱导神经细胞凋亡[7]。
AMP激活蛋白激酶(AMPK)信号是线粒体分裂的调节因子之一。在能量缺乏的状态下,AMPK的激活导致动力蛋白相关蛋白1(Drp1)在线粒体的定位增加,并进一步诱导线粒体分裂[8],由于AMPK在调节生长和代谢重编程中起着关键作用,它是能量稳态的中枢调节器[9]。已有研究表明,AMPK与线粒体功能有着密切的联系,并影响着细胞凋亡[10]。更重要的是,AMPK介导的信号通路在各种心血管疾病中都有参与,并且作为介导神经元凋亡的重要角色被人们广泛关注[11]。
红景天苷(salidroside,Sal)治疗的神经系统疾病有很多,如神经系统障碍、短暂性大脑中动脉闭塞(MCAO)模型和全脑缺血/再灌注(I/R)损伤,Sal已被证实具有抑制细胞凋亡的保护作用[12-13]。然而Sal是否能改善ICH后的神经损伤,甚至保护ICH中某些病理因素引起的损伤,目前尚不清楚。醒脑静具有醒脑开窍通络的作用,其主要成分包括栀子、冰片、郁金、麝香,已有研究证实醒脑静对急性ICH神经损伤有一定的治疗作用,因此我们选其作为阳性治疗药物。本研究拟通过构建大鼠急性ICH神经损伤模型,观察Sal对急性ICH大鼠的神经功能影响及可能的作用机制,以期为Sal在急性ICH神经损伤治疗中提供可靠的理论依据。
1 材料与方法
1.1 实验材料
1.1.1动物 成年雄性SD大鼠共60只购自湘雅医学院动物实验中心(动物许可证号:44007200065141)。饲养环境:室温25 ℃左右,相对湿度50%~60%,饲料由海南医学院实验动物中心提供,动物可自由饮水摄食。本项目动物相关实验均遵循动物实验伦理要求。
1.1.2药物与试剂 Sal购自南京道斯夫(批号:110818,规格:20 mg,HPLC≥99%);AICAR购自美国MCE公司(规格:0.5 mg·g-1)醒脑静注射液购自无锡济民可信山河药业公司(批号151107,10 mL/支);IL-6、TNF-α、IL-1β ELISA试剂盒均购自碧云天生物技术公司;BCA蛋白浓度检测试剂盒购自大连美仑生物科技有限公司;MitoSOX Red试剂盒购自南京建成生物技术有限公司;GAPDH一抗(CRISPRPL01)、HRP标记的山羊抗鼠IgG(M5774)、山羊抗兔IgG(HPA008791)购自美国Sigma公司;Bcl-2(15071S)、Bax(41162S)、cleaved caspase-3(9661S)、AMPK(9158S)、Drp1(8570S)抗体购自美国Cell Signaling Technology公司。
1.1.3实验仪器 多功能酶标仪(德国Leica公司);凝胶成像系统(美国Bio-Rad公司);电泳设备(美国Beckma公司);电子分析天平(上海勤翔科技有限公司);麻醉机(上海勤翔科技有限公司);SC-2546 低温高速离心机(美国Thermo Fisher公司);倒置荧光显微镜(日本奥林巴斯Olympus有限公司)。
1.2 实验方法
1.2.1急性ICH神经损伤大鼠模型构建和实验分组 参考改良 Rosenberg 法构建大鼠急性ICH模型[14]。大鼠麻醉前禁食12 h,腹腔注射3%戊巴比妥钠(30 mg·kg-1)进行麻醉,眼球取血40 μL以备后续实验。将大鼠的头部进行固定,使用手术刀沿大鼠头部中线纵向切开皮肤,取前囟点右侧中线旁开3 mm、后1 mm处,而后使用钻头开一个0.5 mm小孔,使用微量注射仪将自体血注入大鼠尾状核部位,注射完毕后进行缝合。选取造模成功大鼠进行后续实验。将大鼠按照随机原则分为假手术组(Sham)、模型组(Model)、Sal低、中、高(50、100、200 mg·kg-1)、AMPK激动剂组(AICAR),阳性药组(醒脑静注射液),每组各10只。于造模结束1 h后腹腔注射各剂量Sal,连续1周,AMPK激动剂组腹腔注射AICAR(200 mg·kg-1),阳性药组尾静脉注射醒脑静注射液(10 mg·kg-1)。
1.2.2大鼠神经功能评分 Garcia试验用于评价造模和各组大鼠神经功能缺损。Garcia评分法分数区间为3-18分,动物的神经行为学状况和分数呈正相关。由两位研究者参与实验,采用双盲法对各组小鼠进行评分和记录,评分标准见Tab 1。
1.2.3大鼠脑含水量检测 造模结束后处死大鼠,迅速切除大脑,然后分离左右脑半球和小脑半球。将大脑的不同部分快速称量(湿重),然后放入烤箱中,在100 ℃下烘烤24 h,再称量(干重)。含水量的计算公式为:(湿重-干重)/湿重×100%。

Tab 1 Neurological function score scale
1.2.4MitoSOX Red检测ROS水平 使用MitoSOX Red Kit (Invitrogen, USA)测量线粒体超氧化物的产生。按照试剂盒的步骤,首先将脑组织的线粒体分离出来,20 μg线粒体在50 μL呼吸缓冲液中装入96孔板。100 μL冰冷呼吸缓冲液中加入2 μL MitoSOX、5 μL antiycin A和4 μL ADP。在装入Microplate Reader之前,在指定的孔中加入50 μmol·L-1salermide或1 μmol·L-1FeTCCP。在355 nm和590 nm处测量荧光强度的基础水平,每隔5 min测量荧光强度。
1.2.5脑组织中ATP含量检测 使用ATP检测试剂盒检测脑组织中ATP含量的变化,首先向组织中加入约100~200 μL的裂解液,然后使用玻璃匀浆漏斗进行匀浆。裂解结束后使用低温离心机 4 ℃ 12 000 r·min-1离心10 min,离心结束后弃沉淀取上清液,按ATP含量检测试剂盒说明配制ATP检测工作液,加100 μL的ATP检测工作液到待测孔板中,再加上20 μL不同组的上清液,最后使用化学发光仪(Luminometer)测定RLU值。
1.2.6脑组织中IL-6、TNF-α、IL-1β检测 造模结束后,将大鼠断头处死,无菌操作取出大鼠的脑组织,使用预冷的PBS冲洗除去残余血液,在冰上使用滤纸拭去残留的PBS,然后将脑组织放置于液氮罐中保存备用。实验时取组织块准确称其质量,使用眼科手术剪快速剪碎组织块,按比例加入预冷的PBS,随后将剪碎的组织放置于组织匀浆器充分匀浆,12 000 r·min-1离心10 min,离心结束后取上清,按试剂盒说明步骤进行相关炎症因子水平检测。
1.2.7TUNEL染色检测脑组织神经细胞凋亡 从液氮罐中取出大鼠脑组织,使用多聚甲醛固定液进行固定,冰冻切片,将切片依次浸泡于二甲苯、无水乙醇、不同浓度梯度的乙醇中各5 min,PBS洗涤3次。加入蛋白酶K 溶液50 μL,置于37 ℃孵育30 min,PBS冲洗3次;滴加柠檬酸三钠50 μL,室温孵育4 min,PBS冲洗3 次;按照TUNEL试剂盒染色步骤进行染色,滴加TUNEL反应液37 ℃避光孵育60 min,PBS冲洗3次;加入POD转换液,置于37 ℃孵育30 min,PBS冲洗3次,DAB显色试剂盒显色,PBS冲洗3次;放入苏木精溶液中复染60 s,流水冲洗掉多余染液;放入1%盐酸酒精溶液中进行分化,分化结束后再次流水冲洗;封片。结束后使用倒置荧光显微镜观察拍照。
1.2.8Western blot检测Bcl-2、Bax、cleaved caspase-3、AMPK、Drp1蛋白表达水平 BCA蛋白浓度检测试剂盒检测总蛋白浓度。通过15%SDS-PAGE分离蛋白质,并在200 mA和1 h条件下,将蛋白质转移至PVDF膜。将膜在含有5%脱脂奶粉的TBST溶液中于室温封闭1 h左右。将膜与Bcl-2、Bax、cleaved caspase-3、AMPK、Drp1抗体在4 ℃孵育过夜。用TBST缓冲液洗涤PVDF膜3次,每次10 min,在室温下与山羊抗兔IgG一起孵育1 h。β-actin用作内参。最后,用ChemiQ4600min化学发光成像系统成像,ImageJ测定蛋白条带的灰度值。

2 结果
2.1 各组大鼠神经功能比较实验结果显示,与Sham组相比,Model组大鼠的神经系统评分明显降低,出现明显脑水肿,神经功能下降;与Model组相比,Sal各剂量组、阳性药组和AICAR组大鼠的神经系统评分明显升高,脑水肿情况减轻,神经功能得到保护(Tab 2)。
2.2 各组大鼠脑组织ROS水平检测情况与Sham组相比,Model组大鼠的脑组织ROS水平明显升高(P<0.05);与Model组相比,Sal各剂量组、阳性药组和AICAR组大鼠的脑组织ROS水平明显降低(P<0.05)(Fig 1)。
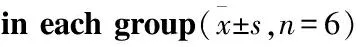
Tab 2 Neurological function scores of rats

Fig 1 Brain water content of rats in each
2.3 各组大鼠脑组织中ATP含量检测情况与Sham组相比,Model组大鼠的脑组织ATP含量明显降低(P<0.05);与Model组相比,Sal各剂量组、阳性药组和AICAR组大鼠的脑组织ATP含量明显升高(P<0.05)(Fig 2)。
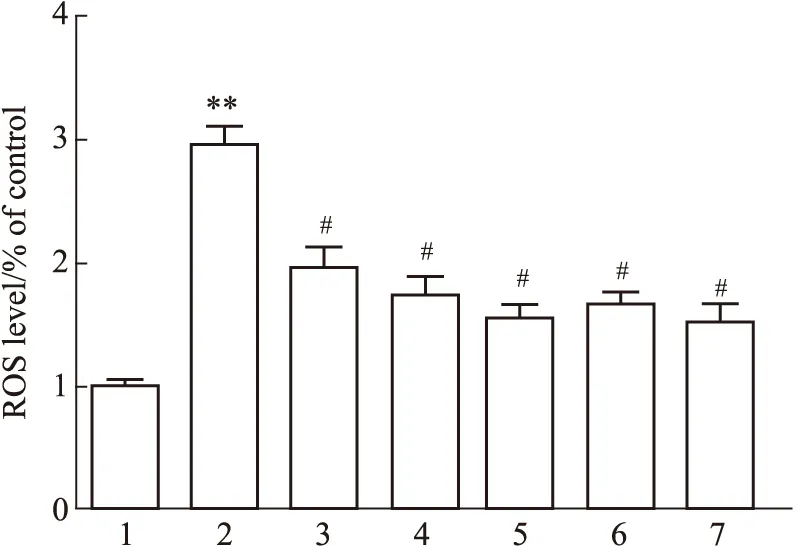
Fig 2 Comparison of ROS levels in brain tissue of rats
2.4 ELISA实验检测IL-6、TNF-α、IL-1β水平与Sham组相比,Model组大鼠的脑组织IL-6、TNF-α、IL-1β水平明显升高;与Model组相比,Sal各剂量组、阳性药组和AICAR组大鼠的脑组织IL-6、TNF-α、IL-1β水平明显降低(Fig 3)。
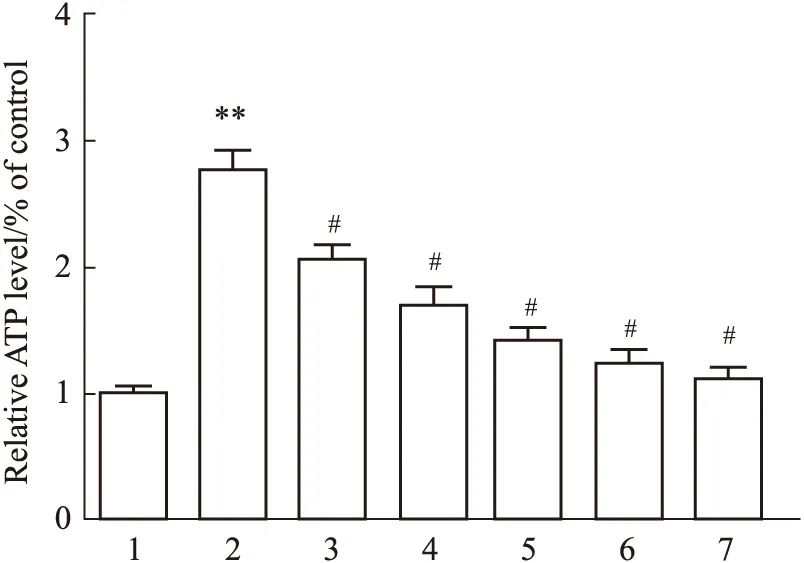
Fig 3 Comparison of ATP levels in brain tissue of rats
2.5 TUNEL染色检测各组神经细胞凋亡结果与Sham组相比,Model组大鼠的脑组织神经细胞凋亡明显增多(P<0.01);与Model组相比,Sal各剂量组和AICAR组大鼠的脑组织神经细胞凋亡明显减少(Fig 4)。
Fig 4 Comparison of IL-6, TNF-α and IL-1β levels
2.6 各组大鼠脑组织内相关蛋白表达变化与Sham组相比,Model组Bcl-2、p-AMPK/AMPK表达明显下调,Bax、cleaved caspase-3、p-Drp1/Drp1蛋白表达明显上调;与Model组相比,Sal各剂量治疗组、阳性药组和AICAR组Bcl-2、p-AMPK/AMPK蛋白表达明显上调,Bax、cleaved caspase-3、p-Drp1/Drp1蛋白表达明显下调(Fig 5)。
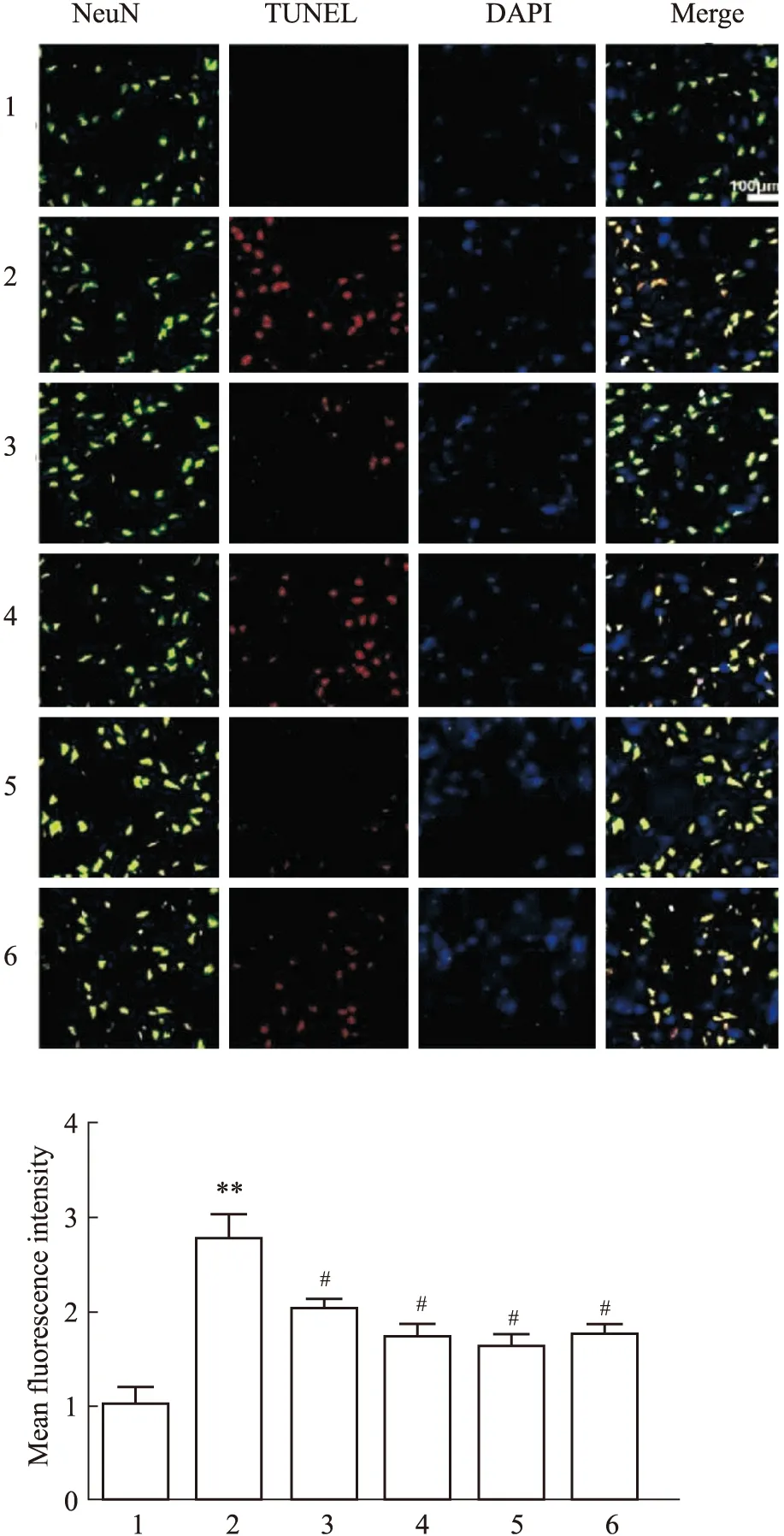
Fig 5 Comparison of neural cell apoptosis in brain tissue
3 讨论
继发性脑损伤主要是由于炎症引起,可加重血肿附近的脑水肿。ICH后的脑水肿可导致不良后果,如严重的神经功能缺损、疝出,甚至死亡[15]。机体在清除血肿过程中会激活小胶质细胞,然而过度激活也会释放炎症因子、趋化因子、蛋白酶、ROS、血红素加氧酶等多种毒性因子,对脑组织产生神经毒性[16]。已有研究表明,在ICH发生过程中有过量的ROS产生[17],过量的ROS会破坏细胞内氧化还原平衡进而造成神经细胞损伤,同时ROS的过量产生会导致NLRP3炎症小体大量激活,特别是mtROS的产生,反过来大量的NLRP3激活又会增加mtROS水平,进而导致细胞凋亡。
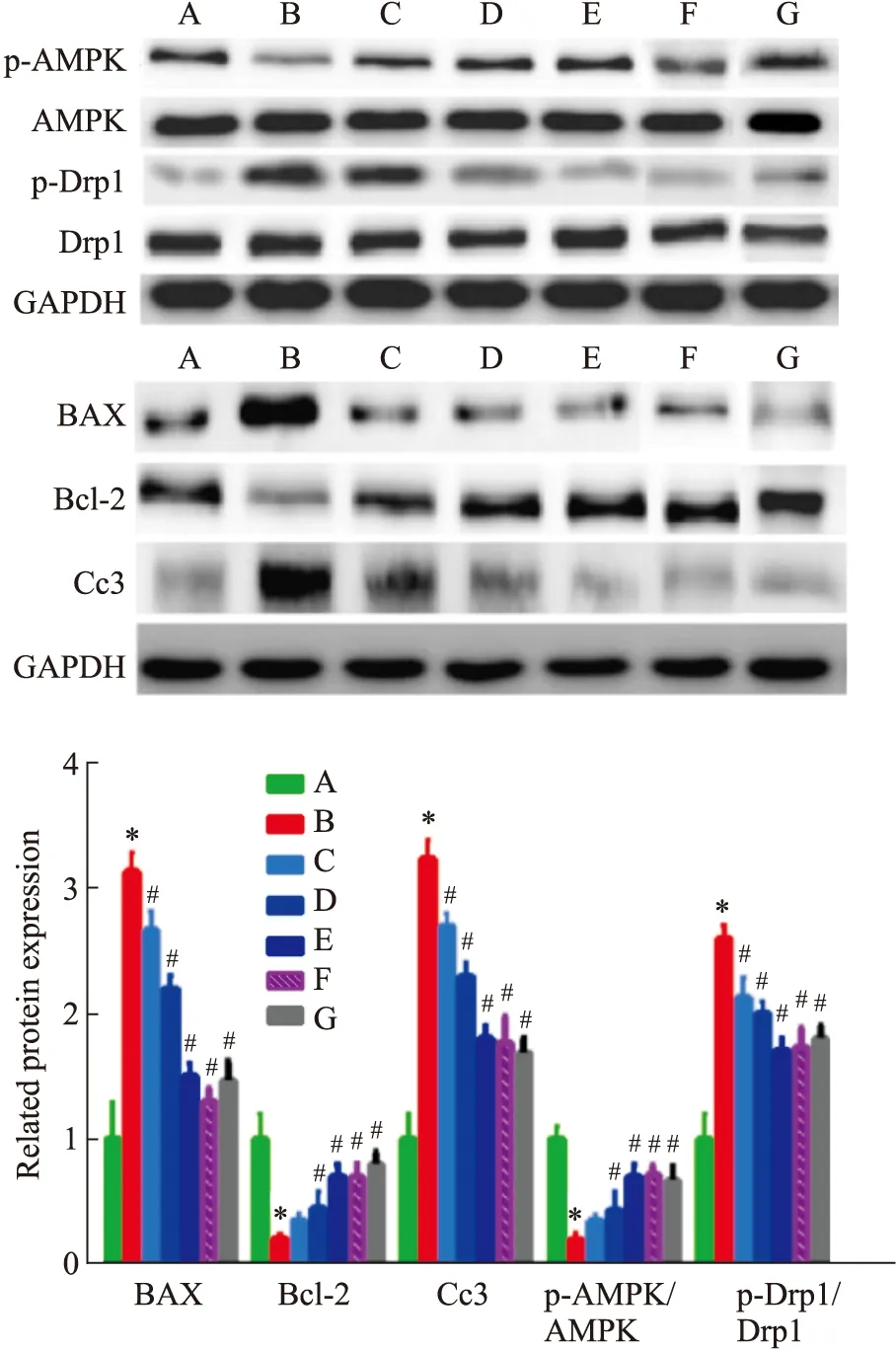
Fig 6 Comparison of related protein expression in brain
Drp1通过调控多种下游蛋白改变线粒体膜极化从而调节mtROS水平,进而对线粒体内稳态和NLRP3炎症小体激活产生显著影响[17]。同时也有研究证实,AMPK活化有抑制Drp1的作用。在ICH期间,皮质神经元中p-AMPK的表达以时间依赖性的方式减少,结合AMPK与Drp1的相互作用,表明Drp1可能是ICH后的关键抗氧化因子。作为调控细胞凋亡的经典信号通路,Bcl-2/Bax/cleaved caspase-3凋亡信号通路也与包括神经系统疾病在内的许多疾病有关,同时研究表明Bcl-2/Bax蛋白在线粒体功能障碍介导的凋亡通路中均起到了重要作用。
在本次研究中,我们选用了Sal作为治疗药物,Sal提取于红景天,红景天是景天科植物,具有广泛的药理作用。首先我们通过神经系统评分和脑水肿检测实验证实了Sal具有明显改善神经功能的作用,ICH发生后我们使用Sal进行治疗,实验结果发现大鼠脑水肿和神经细胞凋亡情况明显减轻,随后我们对Sal的作用机制进行了进一步探究。我们通过MitoSOX Red和ELISA实验检测了大鼠脑组织内的ROS水平和相关炎症因子指标,实验结果发现ICH发生后脑组织内ROS和IL-6、TNF-α、IL-1β水平显著增高,但我们使用Sal治疗后,能够明显逆转ICH造成的氧化损伤和炎症损伤以及ATP含量减少,TUNEL染色结果也显示Sal能够有效的抑制ICH导致的大鼠神经细胞凋亡。随后我们发现ICH发生后大鼠神经细胞中的Bax、cleaved caspase-3、p-Drp1/Drp1高表达和Bcl-2、p-AMPK的低表达,Sal治疗后可以逆转。AMPK是调控能量稳态的重要激酶,在抗氧化应激中发挥了抗凋亡的作用。在抑制Drp1活化后,可以减少或ROS水平的变化,并减少线粒体不正常分裂,防止线粒体损伤。在本研究中,ICH后24 h左右,p-Drp1蛋白表达明显下调,而Sal处理显著降低了p-Drp1/Drp1蛋白表达水平,并对氧化损伤和炎症因子释放具有抑制作用。
综上所述,Sal能够有效保护急性ICH大鼠导致的神经功能损伤,其作用机制可能与调控AMPK/Drp1信号通路有关,本研究为急性ICH神经功能损伤早期临床治疗提供了理论依据。

