美拉德反应改善兰茂牛肝菌酶解液风味
杨宁,张微思,罗晓莉,周锫,何容,吴素蕊,张沙沙*
(1.云南省食用菌产业发展研究院,云南 昆明 650221;2.中华全国供销合作总社昆明食用菌研究所,云南 昆明 650221)
云南省是野生食用菌资源大省,无论是资源数量,还是产量、产值均居全国第一[1]。其中,牛肝菌是大宗食用菌,是四大名菌之一,产量和出口量均较高,2021年牛肝菌出口7 223.3 t,主要出口德国、意大利、法国等。兰茂牛肝菌(Lanmaoa asiatica)被当地人称为“红葱”、“见手青”,由于其含有丰富的挥发性和非挥发性风味物质[2-3],因此被公认为最美味的牛肝菌之一。另外,兰茂牛肝菌富含多糖、萜类,可调节人体免疫力,具有抗氧化、抗辐射、抗癌等功效[4-5]。但是兰茂牛肝菌尚不能人工栽培,季节性强,主要以鲜食为主,加工产品较少,尤其是精深加工产品寥寥无几,产品附加值低,不能满足市场需求,且兰茂牛肝菌在贮运加工过程中有大量残次菇、泥脚料被丢弃,浪费了大量资源。
美拉德反应(Maillard reaction,MR)是氨基酸、肽等氨基化合物与果糖、葡萄糖等还原糖之间发生复杂的反应,一般发生在食品加工过程中[6-8],能改善食品的风味,提升食品品质,还对食品货架期的延长和稳定性的提升有贡献[9-10]。刘培基等[10]利用美拉德反应改善香菇酶解液风味,发现美拉德反应后酶解液中的有机酸和氨基酸种类及含量也发现了明显变化;反应后生成的挥发性风味物质主要为乙醇、环己酮,可以带来香甜气息。高然等[11]利用美拉德反应制备美味牛肝菌风味基料,发现酶解液发生美拉德反应后呈棕色,具有浓郁的美味牛肝菌香气、海鲜及烧烤风味。高娟等[12]利用美拉德反应制备羊肚菌酶解液肉味调味基料,发现美拉德反应后羊肚菌酶解液的鲜味、咸味传感器响应强度增大,苦涩味、氨、硫化氢等不良挥发性风味传感器响应强度降低。MR 形成的风味很大程度上取决于还原糖、氨基酸种类和添加量,以及反应条件(温度、时间和pH 值),还原糖的种类对美拉德反应产物(Maillard reaction products,MRPs)的风味影响较小,主要是影响反应速率,而氨基酸的种类对MPRs 风味的影响较大[13]。
本研究采用兰茂牛肝菌残次菇制备兰茂牛肝菌酶解液,通过单因素和响应面试验,筛选还原糖和氨基酸的种类、添加量和反应条件,并确定最佳工艺参数,并分析在此工艺条件下,美拉德反应对兰茂牛肝菌酶解液产物中游离氨基酸和呈味氨基酸变化的影响,以期为兰茂牛肝菌贮运过程中的副产物综合利用提供理论基础。
1 材料与方法
1.1 材料与试剂
兰茂牛肝菌干品:市售;中性蛋白酶(5×104U/g)、木瓜蛋白酶(3×104U/g):南宁庞博生物工程有限公司;风味蛋白酶(5×104U/g):沧州夏盛酶生物技术有限公司。葡萄糖、木糖、甘露醇、乳糖、低聚半乳糖、果糖、L-半胱氨酸、L-谷氨酸、赖氨酸、组氨酸、精氨酸(均为食品级):河北华阳生物科技有限公司;醋酸(食品级):千禾味业食品股份有限公司;食用碱:安琪酵母股份有限公司。0.05 mol/L 氢氧化钠溶液(分析纯):坛墨质检科技股份有限公司;36%~38%甲醛溶液(分析纯):西陇科学股份有限公司。
1.2 仪器与设备
酶联免疫分析仪(FlexA-200):杭州奥盛仪器有限公司;电热鼓风恒温干燥箱(WGLL-625BE):天津市泰斯特仪器有限公司;自动电位滴定仪(ET18)、pH计(FE28):梅特勒-托利多仪器(上海)有限公司;恒温水浴锅(HH-6):上海力辰仪器科技有限公司;台式大容量高速冷冻离心机(HR/T20MM):上海安亭科学仪器厂;超微粉碎机(TYM-30L):济南天宇专用设备有限公司。
1.3 方法
1.3.1 兰茂牛肝菌酶解液制备
称取一定量兰茂牛肝菌超微粉,根据前期研究确定的兰茂牛肝菌复合酶解工艺,添加0.60%中性蛋白酶、0.90%风味蛋白酶、0.47%木瓜蛋白酶,料液比为1 ∶20(g/mL),调节pH 值为7.0,在50 ℃条件下酶解1.5 h。酶解结束后100 ℃灭酶5 min,冷却至60 ℃时进行离心(4 000 r/min、15 min)。分离上清液得到兰茂牛肝菌酶解液备用。
1.3.2 兰茂牛肝菌酶解液美拉德反应条件
1.3.2.1 单因素试验
取制备好的兰茂牛肝菌酶解上清液30.00 g,固定还原糖添加量4%、氨基酸为2% L-谷氨酸,调整初始pH 值为7.0,反应温度为110 ℃,时间为80 min,考察还原糖种类(葡萄糖、木糖、甘露醇、乳糖、低聚半乳糖、果糖)对MRPs 的褐变度A420nm和低分子量香味中间体物质含量A280nm的影响。
固定还原糖为果糖,氨基酸为2% L-谷氨酸,调整初始pH 值为7.0,反应温度为110 ℃,时间为80 min,考察果糖添加量(2%、4%、6%、8%、10%)对MRPs 的褐变度A420nm和低分子量香味中间体物质含量A280nm的影响。
固定果糖添加量为4%,氨基酸添加量为2.00%,调整初始pH 值为7.0,反应温度为110 ℃,时间为80 min,考察不同的氨基酸(L-半胱氨酸、L-谷氨酸、赖氨酸、组氨酸、精氨酸)对MRPs 的褐变度A420nm和低分子量香味中间体物质含量A280nm的影响。
固定果糖添加量为4%,氨基酸为L-谷氨酸,调整初始pH 值为7.0,反应温度为110 ℃,时间为80 min,考察L-谷氨酸添加量(1.0%、1.5%、2.0%、2.5%、3.0%)对MRPs 的褐变度A420nm和低分子量香味中间体物质含量A280nm的影响。
固定果糖添加量为4%、L-谷氨酸添加量为2.0%,考察不同反应温度(80、90、100、110、120 ℃)、不同反应时间(40、60、80、100、120 min)、不同初始pH 值(6.0、6.5、7.0、7.5、8.0) 条件对MRPs 的褐变度A420nm和低分子量香味中间体物质含量A280nm的影响。
1.3.2.2 响应面试验优化美拉德反应条件
根据Central Composite 试验设计原理,运用Design-Expert V8.0.6.1 软件,基于单因素试验结果,以还原糖添加量(A)、氨基酸添加量(B)、反应温度(C)、反应时间(D)、初始pH 值(E)为自变量,以褐变度(Y1)及低分子量香味中间体含量(Y2)为响应值,各因素选取5 个水平进行编码,因素水平和编码见表1。
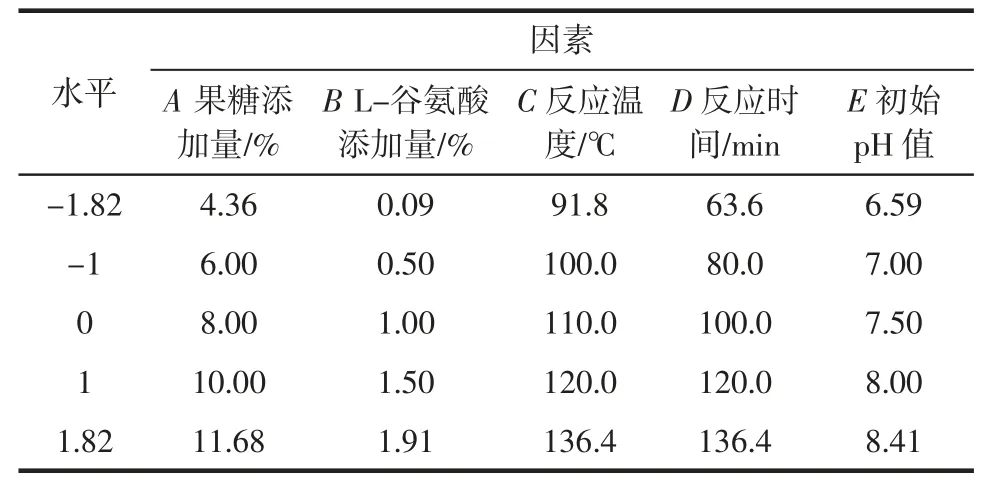
表1 响应面试验因素水平Table 1 Factors and levels of response surface experiment
1.3.2.3 美拉德反应产物褐变度及低分子量香味中间体物质测定
参照Chen 等[14]的方法,并结合试验实际将美拉德反应产物稀释5 倍后,以超纯水为对照,分别在波长420 nm 及280 nm 处测定吸光值。420 nm 处所测定得的吸光值为褐变度,A420nm越大,说明美拉德反应褐变产物越多[11];280 nm 处测得的吸光值为低分子量香味中间体含量,A280nm越大说明产生的风味物质越多[15]。
1.3.3 氨基酸测定
参照GB 5009.124—2016《食品安全国家标准食品中氨基酸的测定》,采用全自动氨基酸分析仪测定。
1.3.4 滋味贡献评价
采用味觉活性值(taste activity value,TAV)法评价呈味物质对兰茂牛肝菌酶解液滋味的贡献,TAV 指样品中各呈味物质的测定值与该物质味道阈值之比[16],计算公式如下。
式中:T 为TAV;C1为滋味化合物的质量浓度,mg/g;C2为滋味阈值浓度,mg/g。
1.4 数据处理与分析
试验数据采用Excel 处理,GraphPad prism5 做差异性分析及作图。P<0.05 为差异显著,P<0.01 为差异极显著。
2 结果与分析
2.1 单因素试验
2.1.1 还原糖种类和添加量对MPRs 的影响
酶解液的美拉德反应速度与还原糖的种类有关,一般单糖反应速度大于双糖,五碳糖反应速度大于六碳糖[10]。还原糖的种类和添加量对MRPs 的影响见图1和图2。

图1 不同还原糖对美拉德反应产物的影响Fig.1 Effects of different reducing sugars on Maillard reaction products
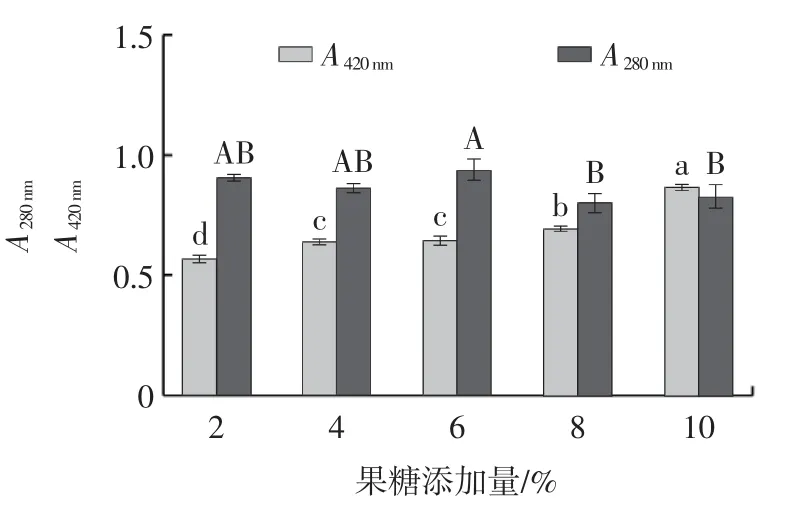
图2 果糖添加量对美拉德反应产物的影响Fig.2 Effect of fructose addition on Maillard reaction products
由图1 可知,木糖和果糖参与反应生成的MRPs的A420nm显著高于其他还原糖(P<0.05),葡萄糖参与反应生成的MRPs 的A280nm明显高于其他还原糖,木糖、果糖的A280nm高于甘露醇、乳糖、低聚半乳糖,但差异不显著(P>0.05)。因此,选择果糖为美拉德反应的外源还原糖。
由图2 可知,随着果糖添加量的增加,MRPs 的A420nm呈升高的趋势,果糖添加量10%时显著高于8%(P<0.05),此时褐变度最高;MRPs 的A280nm随着果糖添加量的增加整体呈先升高后降低的趋势,当果糖添加量6%时A280nm最高,但与果糖添加量2%、4%时没有显著性差异(P>0.05)。因此,选择果糖添加量为8%作为“0”水平进行响应面优化试验。
2.1.2 氨基酸种类和添加量对MRPs 的影响
不同的氨基酸会赋予产品不同的香味[17]。氨基酸种类和添加量对MRPs 的影响见图3 和图4。
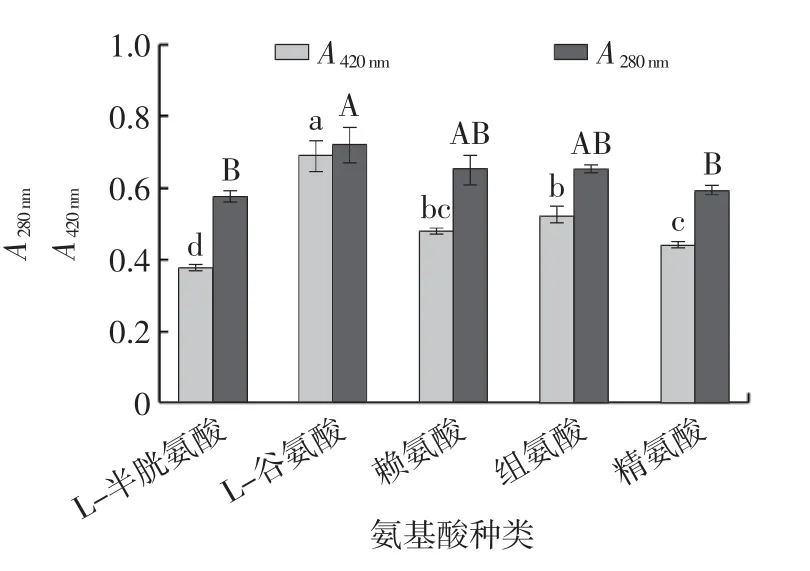
图3 不同氨基酸对美拉德反应产物的影响Fig.3 Effects of different amino acids on Maillard reaction products

图4 L-谷氨酸添加量对美拉德反应产物的影响Fig.4 Effect of L-glutamic and addition on Maillard reaction products
由图3 可知,添加L-谷氨酸的MRPs A420nm显著高于其他氨基酸(P<0.05),添加L-谷氨酸的MRPs A280nm最高,但与添加赖氨酸或组氨酸差异性不显著(P>0.05)。因此,选择L-谷氨酸为美拉德反应的外源氨基酸。
由图4 可知,随着L-谷氨酸添加量的增加,A420nm逐渐降低,A280nm则先降低后变化趋于平缓,当L-谷氨酸添加量为1.0%时,褐变产物积累量和低分子量香味中间体含量最高,且与其他处理组相比具有显著差异(P<0.05)。因此,选择L-谷氨酸添加量为1%作为“0”水平进行响应面优化试验。
2.1.3 不同反应温度对MRPs 的影响
反应温度影响美拉德反应的速度和产物,低温条件下美拉德反应速率很慢,随着温度升高,美拉德反应速率会相应加快,但是过高的温度会导致丙烯酰胺、苯并芘等致癌物的形成[18]。反应温度对MRPs 的影响见图5。

图5 反应温度对美拉德反应产物的影响Fig.5 Effect of reaction temperature on Maillard reaction products
由图5 可知,随着反应温度升高,A420nm和A280nm均整体呈升高的趋势,当反应温度为120 ℃时,A420nm最高,此时褐变产物积累量最多,但与110 ℃条件下无显著差异(P>0.05);120 ℃时,A280nm最高,与其他温度(80、90、100 ℃)差异显著(P<0.05),但与反应温度110 ℃差异不显著(P>0.05)。因此,选择110 ℃为“0”水平进行响应面优化试验。
2.1.4 不同反应时间对MRPs 的影响
反应时间影响美拉德反应的产物,反应时间短,产物少,反应时间长,产物的种类和含量也相应增加[18]。反应时间对MRPs 的影响见图6。
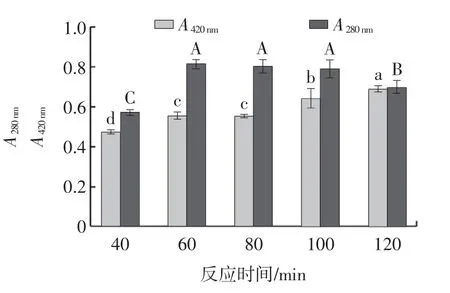
图6 反应时间对美拉德反应产物的影响Fig.6 Effect of reaction time on Maillard reaction products
由图6 可知,随着反应时间的延长,A420nm呈逐渐上升的趋势,当反应时间为120 min 时,A420nm显著高于其他反应时间(P<0.05),说明褐变产物增多;随着反应时间延长,A280nm呈先上升后降低的趋势,当反应时间为60、80、100 min 时,低分子量香味中间体较多,且无显著性差异(P>0.05)。反应时间为120 min 时,低分子量香味中间体减少,低分子量香味中间体部分为香味物质,会在一定时间内大量形成,但在高温长时间加热的环境中香味物质易分解及挥发,进而导致A280nm降低。因此,选择100 min 为“0”水平进行响应面优化试验。
2.1.5 不同初始pH 值对MRPs 的影响
pH 值对美拉德反应过程有着重要的影响,酸性条件不利于美拉德反应[19]。酶解液初始pH 值对MRPs 的影响见图7。
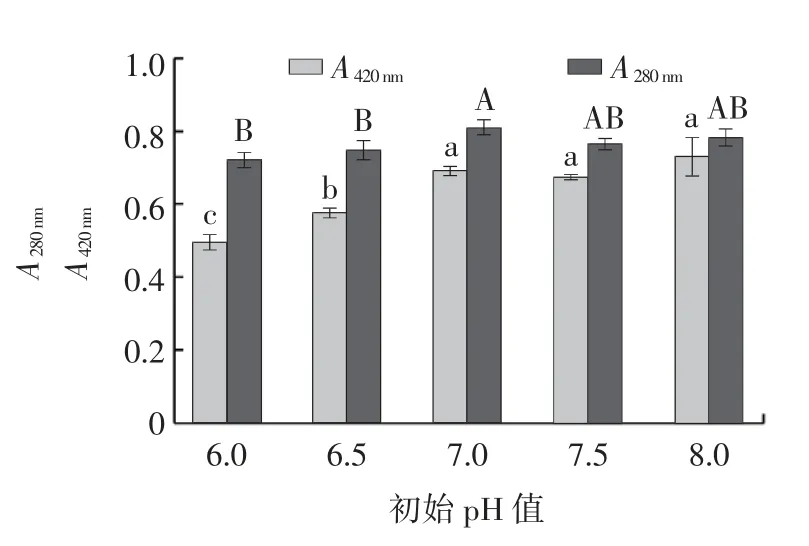
图7 初始pH 值对美拉德反应产物的影响Fig.7 Effect of initial pH on Maillard reaction products
由图7 可知,随着pH 值的增加,A420nm呈逐渐上升的趋势,pH 值为6.0 时,A420nm最低;pH8.0 时,A420nm最高;随着pH 值的增加,A280nm呈先上升后下降再上升的趋势,当pH 值为7.0 时,低分子量中间体含量最高。pH 值为7.0、7.5、8.0 时,A420nm无显著性差异,A280nm也无显著性差异。因此,选择pH7.5 为“0”水平进行响应面优化试验。
2.2 响应面优化试验结果及最佳工艺验证
2.2.1 回归模型的建立和方差分析
根据中心组合试验设计原理,设计试验组合24组,探究不同组合对美拉德反应产物褐变度(A420nm)及低分子量香味中间体含量(A280nm)的影响。试验结果如表2 所示。其中,Y1为A420nm;Y2为A280nm;对褐变度及低分子量香味中间体含量回归方程进行方差分析,结果如表3、表4 所示。
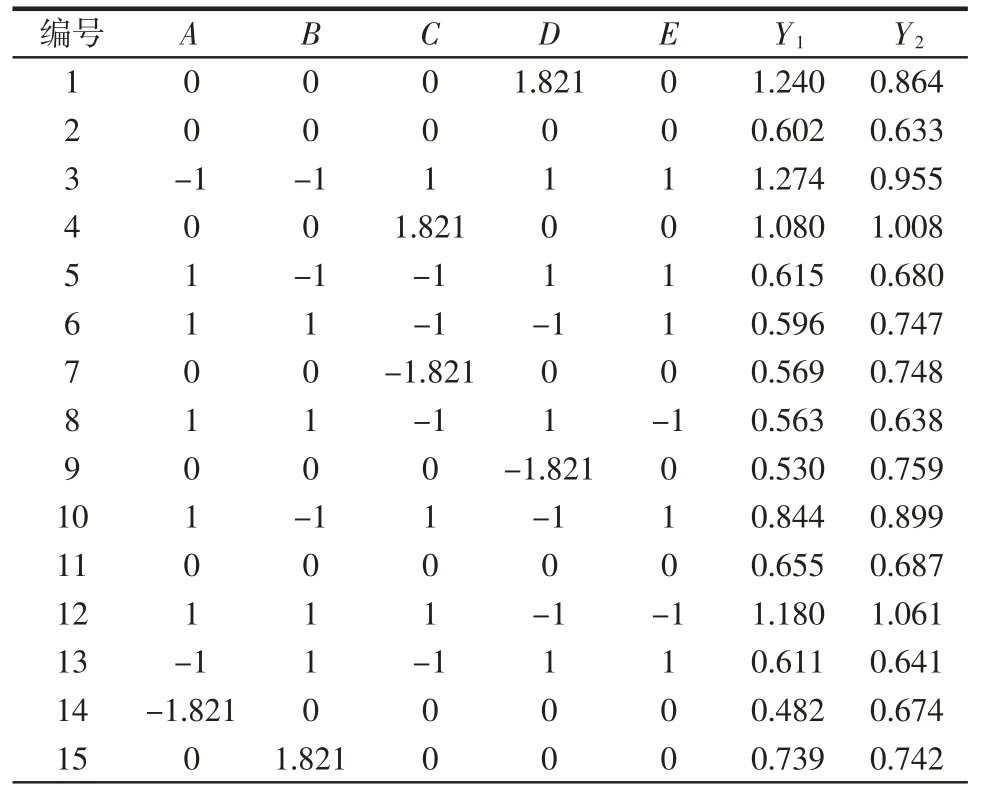
表2 响应面试验结果Table 2 Response surface test results

表3 褐变度方差分析结果Table 3 Analysis of variance results of browning degree

表4 低分子量香味中间体方差分析结果Table 4 Analysis of variance results of low molecular weight aroma intermediates
褐变度模型的R2=0.998 5、R2Adj=0.998 3、R2Pred=0.953 4,说明该回归模型拟合度好,可靠性高。分析表3数据可知,A、C、D、E、AD、AE、BC、CE、DE、A2、B2、C2、D2对美拉德反应产物的褐变度有显著影响(P<0.05),其中A、C、D、E、AD、BC、CE、C2、D2影响极显著(P<0.01)。5 个因素对美拉德反应产物褐变度的影响顺序:D>C>A>E>B。
低分子量香味中间体模型的R2=0.995 9,R2Adj=0.968 3,R2Pred=0.857 6,说明该回归模型拟合度好,可用于预测实际反应条件。分析表4 数据可知,B、C、E、AB、AC、BD、BE、C2、D2对美拉德反应产物的分子量香味中间体有显著影响(P<0.05),5 个因素对美拉德反应产物低分子量香味中间体的影响顺序:C(反应温度)>B(L-谷氨酸添加量)>E(初始pH 值)>D(反应时间)>A(果糖添加量)。
2.2.2 验证试验
响应面优化试验得到的最优条件为还原糖(果糖)添加量为10.00%,氨基酸(L-谷氨酸)添加量1.50%,反应时间80 min,反应温度119.99 ℃,初始pH8.0。在此条件下预测值:A420nm=1.66、A280nm=1.11。为了试验的可操作性,将最优条件调整为果糖添加量为10.00%,L-谷氨酸添加量为1.50%,反应时间80 min,反应温度120 ℃,初始pH8.0,进行3 次平行试验,实际测量A420nm=1.55、A280nm=1.01。实际值与预测值较为接近,表明模型可行。
2.3 美拉德反应对酶解液及MRPs 游离氨基酸的影响
游离氨基酸是兰茂牛肝菌中重要的营养成分,也是重要的滋味成分及香气前体物质[20]。在加工过程中会与其他成分相互作用赋予食品特殊的风味。美拉德反应产物游离氨基酸含量如表5、图8 所示。
由表5 可知,酶解液及MRPs 中含有17 种氨基酸,经过美拉德反应后,谷氨酸、蛋氨酸含量有所提高,其他氨基酸含量下降。氨基酸总量由10.68 mg/g 增加到20.29 mg/g,增加率为89.98%。由图8 可知,美拉德反应产物中鲜味氨基酸含量显著高于酶解液中的鲜味氨基酸含量(P<0.01)。而甜味、苦味、无味氨基酸经过美拉德反应后均显著减少(P<0.01)。说明美拉德反应可以增加酶解液的鲜味,减少苦涩味。
2.4 美拉德反应对酶解液及MRPs 游离氨基酸TAV的影响
不同的氨基酸具有不同的特征滋味[21]及呈味阈值[22],通过TAV 值的大小对呈味氨基酸进行评价,可以直观反映呈味氨基酸对风味的贡献程度[23]。美拉德反应产物游离氨基酸TAV 如表6 所示。
由表6 可知,酶解液中TAV 大于1 的氨基酸包括谷氨酸、丙氨酸、组氨酸、缬氨酸、精氨酸。其中有4 种氨基酸均为苦/甜味氨基酸。MRPs 中TAV 大于1的氨基酸包括谷氨酸、丙氨酸、缬氨酸。其中谷氨酸的TAV 为50.90,该值远大于1。谷氨酸是鲜味氨基酸,同时也能增加甜味,并且能增强滋味的醇厚感和持久性[24]。因此,谷氨酸对酶解液风味改善具有较大贡献。
3 结论
本研究通过外源添加果糖及L-谷氨酸发生美拉德反应对兰茂牛肝菌酶解液风味进行改善。首先进行单因素试验筛选得到:还原糖为果糖,添加量为6%;氨基酸为L-谷氨酸,添加量为1.0%;初始pH7.0;反应温度为120 ℃;反应时间为100 min。之后通过响应面试验优化反应条件,得到美拉德反应最适条件:果糖添加量10.00%,L-谷氨酸添加量1.50%,反应时间80 min,反应温度120 ℃,初始pH8.0。在该条件下得到的MRPs 氨基酸总量为20.29 mg/g,经过美拉德反应改善后鲜味氨基酸含量增加,苦味氨基酸含量减少,谷氨酸TAV 为50.90,是主要的鲜味来源。综上所述,美拉德反应可以有效改善兰茂牛肝菌酶解液风味。

