多期CT 增强扫描在各型胸腺上皮性肿瘤诊断中的价值
梁 恺,张建发(通信作者)
(汕大医学院第一附属医院放射科 广东 汕头 515000)
按2021 第五版WHO 肿瘤分类,胸腺上皮性肿瘤(thymic epithelial tumors,TETs)包括胸腺瘤及胸腺癌(包括胸腺神经内分泌上皮肿瘤),是一类起源于胸腺上皮细胞的前纵隔原发肿瘤,约占前纵隔肿瘤性病变的46%[1]。其中,胸腺瘤最常见,约占所有胸腺上皮性肿瘤的80%[2],主要包括A、AB、B1、B2 及B3 型胸腺瘤。胸腺瘤在细胞生物学上表现较为温和,进展缓慢,但研究表明几乎所有的胸腺瘤亚型都有可能发生复发和转移[3]。TETs 治疗方法及预后差别较大,因此,治疗前准确的诊断意义重大。CT 是TETs 患者首选的影像学检查,在术前诊断以及分期分型中发挥重大作用[4]。尽管国内对各型胸腺上皮肿瘤的CT 表现报道很多,但大多数是根据Masaoka 分期分为侵袭性或非侵袭性胸腺瘤;或者是简化分组后分为低危(A、AB、B1 型)/高危胸腺瘤(B2、B3 型)/C 型,少见按WHO 肿瘤分类详细分型的研究。本文即通过增强CT 检查结合临床指标探讨各型胸腺上皮性肿瘤诊断要点。
1 资料与方法
1.1 一般资料
回顾性选取2008 年1 月—2023 年4 月于汕头大学医学院第一附属医院行CT 检查并经手术及病理证实的胸腺上皮性肿瘤患者80 例,其中男性41 例,女性39例;平均年龄(53.34±11.75)岁;所有病例按2021 第五版WHO 肿瘤分类进行分组,包括A、AB、B1、B2、B3 型及胸腺癌组,整理所有病例的临床信息及CT 资料。本研究符合《赫尔辛基宣言》中的伦理准则。
纳入标准:①具有完整的临床、手术、病理相关资料及术前CT 资料;②经病理证实为TETs,术后WHO组织学分型明确;③患者CT 检查与手术的间隔时间小于4周。排除标准:①患者临床资料、术前CT资料不完整,或CT 图像质量欠佳影响观察者;②未得到病理证实或WHO 组织学分型无法明确的患者;③碘对比剂过敏史的患者。如图1。

图1 纳入及排除标准
1.2 方法
所有患者均采用GE Discovery 宝石500 排螺旋CT进行平扫和增强扫描,嘱患者仰卧并双手上举;扫描范围从胸廓入口至肺下界膈面;管电压120 kV,自动管电流调节技术,扫描层厚5 mm 并重建0.625 mm 层厚的数据,矩阵512×512,螺距0.984:1,旋转时间0.5 s/r;增强选择非离子型对比剂碘普罗胺(300 mgI/mL),静脉团注60~80 mL,注射流率为2.0~2.5 mL/s,分别于注射对比剂后的35 s、75 s 行两期扫描。扫描完毕选择超薄层进行图像后处理重组。CT 征象分析:由两名有5 年以上经验的放射科医师进行分析,该医生事先不知道肿瘤的具体病理分型,观察内容包括肿瘤大小、位置、分隔、分叶、强化程度、钙化、坏死或囊变、胸膜侵犯、心包侵犯、大血管侵犯、淋巴结转移、远处转移、瘤-肺交界面、正常胸腺组织侵犯、心包积液及胸水。其中纤维分隔主要在增强动脉期及静脉期显示,表现为条片或线状延迟强化但低于肿瘤实质。两名放射科医生分析结果不一致者经协商后确定。
1.3 统计学方法
采用SPSS 23.0 统计软件分析数据,符合正态分布的计量资料以均数±标准差()表示,采用t检验;计数资料以频数(n)、百分率(%)表示,采用χ2或Fisher 精确概率法检验;以P<0.05 显示有统计学意义。
2 结果
2.1 临床指标
本研究显示,80 例胸腺上皮性肿瘤中,男性41例,女性39 例,各组患者性别(χ2=6.165,P=0.29)差异无统计学意义。其中,30 岁以下病人仅有2 例,大部分在40 岁至69 岁,共66 例(82.5%),30 至39岁及70 岁以上病人相对少见,各6 例。各组患者年龄(F=1.483,P=0.206)差异无统计学意义,如表1。

表1 胸腺上皮性肿瘤的年龄分布[n(%)]
胸腺上皮性肿瘤患者可出现胸闷胸痛及咳嗽,但各组间差异无统计学意义,如表2。部分患者可出现重症肌无力(myasthenia gravis,MG),主要在B 型胸腺瘤,A 型、AB 型胸腺瘤及胸腺癌极少见。本研究中,B1、B2 及B3 型胸腺瘤出现重症肌无力分别为68.75%、18.18%及50.00%,B1、B3 型胸腺瘤与A 型、AB 型胸腺瘤及胸腺癌之间差异有统计学意义,如表3。

表2 按WHO 分型各组患者的临床症状[n(%)]
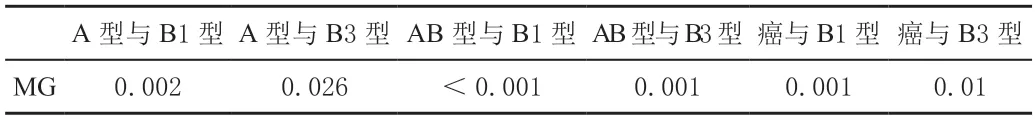
表3 各型胸腺上皮性肿瘤重症肌无力组间对比P 值
2.2 CT 表现
各型胸腺上皮性肿瘤的瘤内纤维分隔、胸膜侵犯、心包侵犯、大血管侵犯、淋巴结转移等CT 表现有一定的差异,如表4。

表4 各型胸腺上皮性肿瘤CT 表现
2.2.1 肿瘤内纤维分隔
CT 增强显示瘤内纤维分隔对诊断胸腺上皮性肿瘤意义较大,尤其是A B 型胸腺瘤,其内多有粗大纤维分隔(18/26),如图2,与其他各组之间有明显统计学差异(P<0.05),如表5。其他各组纤维分隔少见,并且多为细小分隔,且各组间差异无统计学意义(P>0.05)。

表5 AB 型胸腺瘤内粗大纤维分隔与各型肿瘤间CT 表现的P 值比较
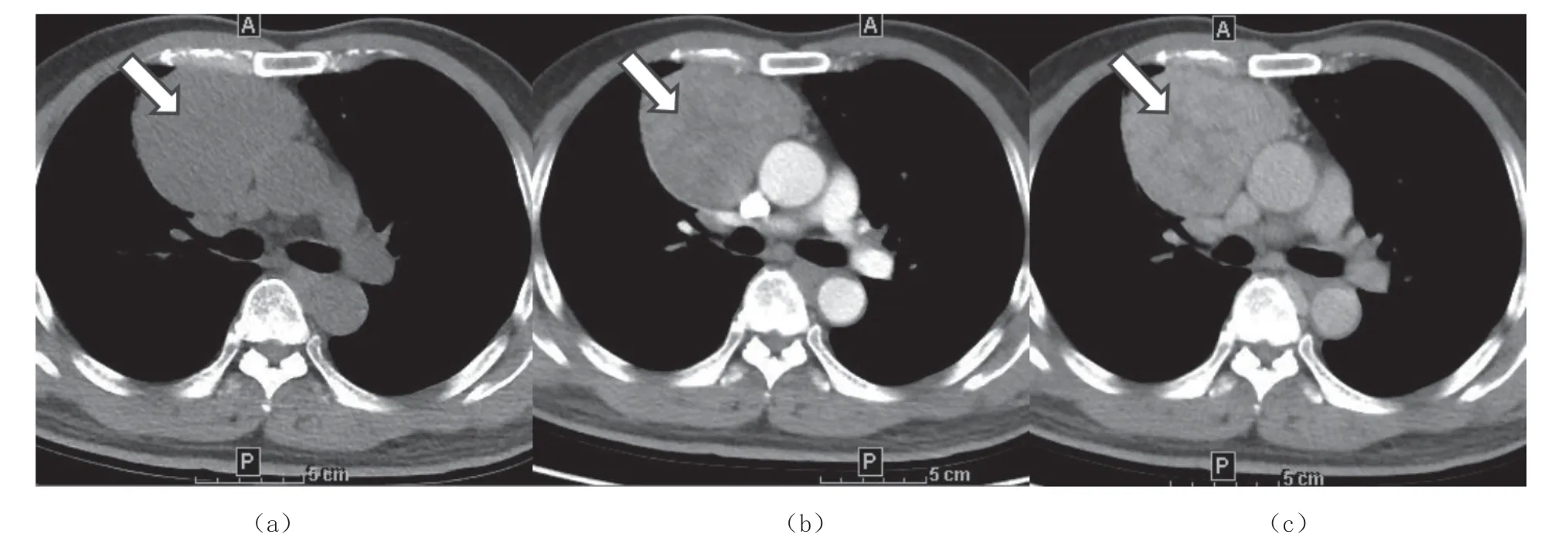
图2 AB 型胸腺瘤
2.2.2 胸膜侵犯
本研究显示,从B1 型胸腺瘤(2/16)开始可见肿瘤胸膜侵犯,更多见于B3型胸腺瘤(9/10)及胸腺癌(8/10),而B2 型胸腺瘤相对少见(6/11)。其中B3 型胸腺瘤及胸腺癌与A 型(0/7)、AB 型胸腺瘤(0/26)之间胸膜侵犯差异较大(P<0.05),如表6。
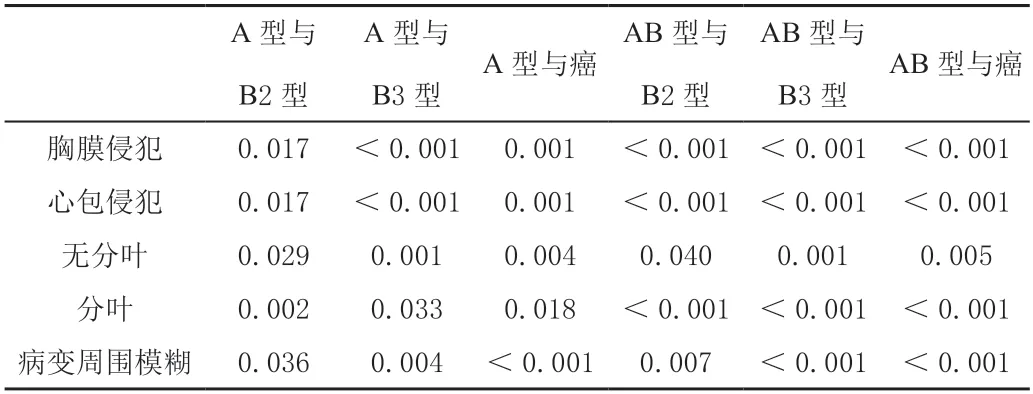
表6 各型胸腺上皮性肿瘤CT 表现的组间P 值比较
2.2.3 心包侵犯
从B1 型胸腺瘤(1/16)以上各组都可见心包侵犯,更常见于B2(6/11)、B3 型胸腺瘤(10/10)及胸腺癌(8/10),与A(0/7)、AB 型胸腺瘤(0/26)之间差异有统计学意义(P<0.05),如表6。B2 型胸腺瘤(如图3a)未见突入心包(6/11),B3 型胸腺瘤(3/10,图3b)及胸腺癌(8/10,图3c)可见部分突入心包,其中胸腺癌对比B2 型胸腺瘤突入心包,差异有统计学意义(P<0.05),如表7。
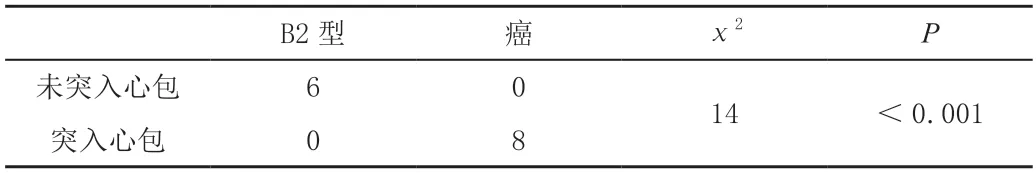
表7 B2 型胸腺瘤与癌突入心包的比较

图3 心包侵犯
2.2.4 肿瘤分叶
各型胸腺上皮性肿瘤均可有分叶,明显分叶主要见于B2(7/11)、B3 型胸腺瘤(7/10)及胸腺癌(7/10),与A、AB 型胸腺瘤之间差异有统计学意义(P<0.05),如表6。
2.2.5 肿瘤与正常胸腺之间界限
肿瘤与正常胸腺之间的界限模糊主要见于B2 型胸腺瘤以上肿瘤,分别为B2 型胸腺瘤45.45%(5/11)、B3 型胸腺瘤70%(7/10)及胸腺癌90%(9/10),与A、AB 型胸腺瘤之间差异有统计学意义(P<0.05)。本研究中,B1 型胸腺瘤肿瘤与正常胸腺之间的界限模糊为25%(4/16),如表6。
2.2.6 大血管侵犯
多见于胸腺癌(6/10),与各组之间差异有统计学意义(P<0.05),如表8 及图4。A、AB 型胸腺瘤及B2 型胸腺瘤均未见大血管侵犯,B1、B3 型胸腺瘤各见1 例大血管侵犯,增强扫描显示受累血管形态不规则,局部缺损。

表8 胸腺癌与各型胸腺瘤大血管侵犯、淋巴结及远处转移CT 表现的P 值比较
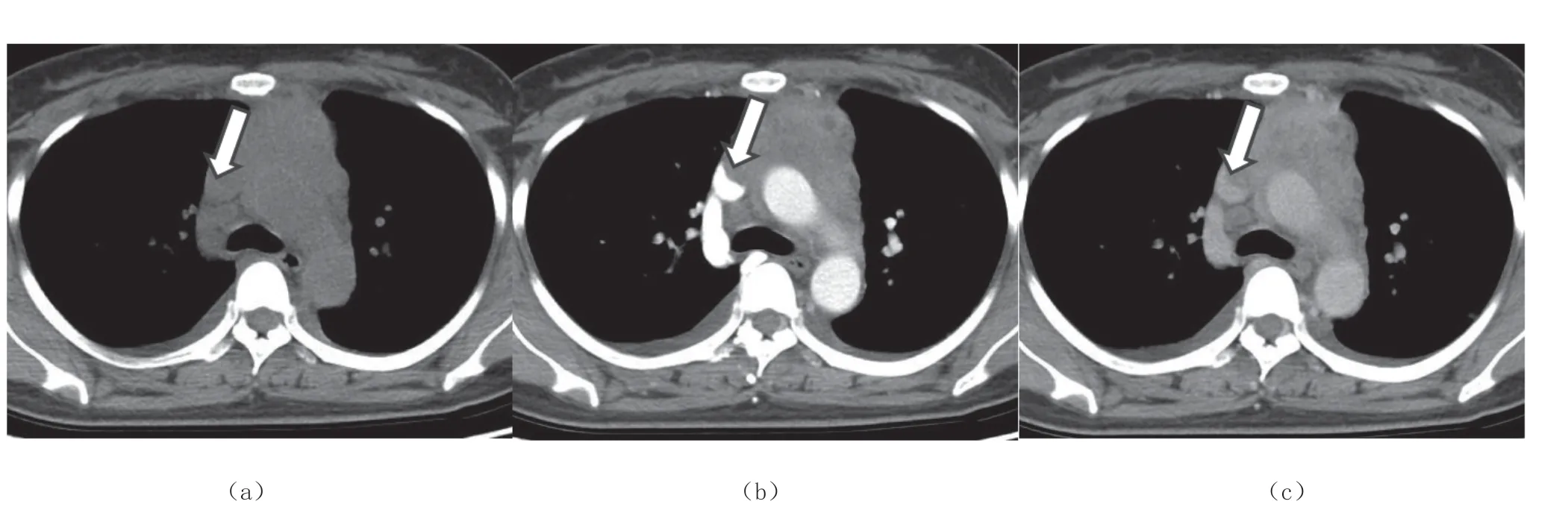
图4 胸腺癌侵犯上腔静脉
2.2.7 淋巴结及远处转移
淋巴结及远处转移仅见于胸腺癌,分别为90%(9/10)及30%(3/10),癌与各组之间的淋巴结转移差异有统计学意义(P<0.05),远处转移只与AB/B1 型胸腺瘤之间差异有统计学意义(如表8)。
2.2.8 肿瘤内坏死
各型胸腺上皮性肿瘤均可见坏死,主要见于B1 型以上胸腺上皮性肿瘤,分别为B1 型胸腺瘤43.75%(7/16)、B2 型胸腺瘤45.45%(5/11)、B3 型胸腺瘤80%(8/10)及胸腺癌90%(9/10),与AB 型胸腺瘤之间差异有统计学意义(P<0.05),(如表9)。本研究中,A 型胸腺瘤坏死为42.86%(3/7)。
2.2.9 其他
各组胸腺上皮型肿瘤之间肿瘤大小、强化程度、胸腔积液、心包积液、位置、瘤-肺交界面及钙化差异无统计学意义(P>0.05),如表2。其中A 型胸腺瘤仅有2 例钙化,均为包膜或分隔钙化,其他组钙化可发生在实质内。本研究中,大部分胸腺上皮性肿瘤发生在胸腺区(71/80),少部分发生在颈根部(2/80)及心包旁(7/80),各组之间差异无统计学意义。
3 讨论
3.1 组织胚胎起源及发病机制
胸腺起源于胚胎时期第3 腮弓的内胚层,位于原始咽侧壁外侧囊状突起,于胚胎期第4 周时,由其腹侧份细胞增生,逐渐演变为位于胸骨后方的左右2 条细胞索,即胸腺原基[5]。胸腺随年龄而变化。新生儿至青春期是胸腺生长发育最旺盛的时期,以后胸腺逐渐萎缩不断被脂肪组织替代,但胸腺髓质终生保留,退化的残余胸腺内存在髓质,可迷走异位于前上纵隔以外(如心包旁、颈部等)。目前,胸腺瘤的发病机制尚不明确,多数学者认为与自身免疫因素、EB 病毒感染、辐射及遗传等因素有关[6-7]。
3.2 临床特点
胸腺上皮性肿瘤是来源于胸腺上皮或向胸腺上皮(含皮质、髓质上皮)分化的肿瘤,发病年龄有一定的诊断意义,本研究显示,30 岁以下病人2 例(2.50%),40~69 岁病人66 例(82.50%),提示30 岁以下的病人诊断胸腺瘤需慎重。其好发部位为胸腺区,其次为心包旁及颈根部,本研究2 例位于颈根部(2.50%),7 例位于心包旁(8.75%),其他均位于胸腺区(91.25%),这可能与胸腺胚胎发育过程有关。其临床表现因各异,可伴重症肌无力,文献报道,胸腺上皮性肿瘤合并重症肌无力发病率B2 >B3=B1 >A >AB >胸腺癌[8],本研究中重症肌无力19 例,其中B 型18 例(约94.7%),与文献报道类似。
3.3 胸腺上皮性肿瘤CT 表现
胸部CT 具有快速性、密度分辨率高、低剂量等优点,是目前TETs 临床的首选检查方法[9]。2021 第五版WHO肿瘤分类根据病理,将其分为A、AB、B1、B2、B3 型及其他罕见亚型胸腺瘤、胸腺癌[10],由A 型胸腺瘤至胸腺癌,肿瘤具有逐渐增加的恶性生物学行为,这就决定了部分影像表现的差异,因此,除其他罕见亚型胸腺瘤外,其他各型胸腺上皮性肿瘤CT 表现存在一定的差异。
3.3.1 形态学特征
随着TETs 侵袭性的增高,肿瘤边缘分叶逐渐明显。本研究中,B3 型胸腺瘤及胸腺癌大部分分叶明显,而A型胸腺瘤均未见明显分叶。B1、B2 型胸腺瘤较小的肿瘤也可以出现明显分叶,而AB型较大的肿瘤主要为浅分叶。
3.3.2 肿瘤密度
本研究显示,CT 增强检查清晰地显示了AB 型胸腺瘤内部多发粗大纤维分隔,表现为条片状或线状延迟强化但低于肿瘤实质,与其他各组间差异有统计学意义,这也是AB 型胸腺瘤较为特征性的CT 表现。其他各型胸腺上皮性肿瘤在CT 上也可见纤维分隔,但较AB 型少见且细小。组织学上,各型胸腺上皮性肿瘤都可以有纤维分隔,但B1 型腺腺瘤至胸腺癌,CT 显示分隔逐渐减少或未见明显分隔,可能是因为随着侵袭性的增加,其内分隔被逐渐侵袭破坏,MRI 检查可能会发现更多纤维分隔。
各型胸腺上皮性肿瘤都可有钙化,可以位于肿瘤实质内,也可以位于肿瘤的包膜或分隔。本研究中,有21例肿瘤出现钙化,其中A 型胸腺瘤仅2 例,均位于包膜及分隔,无实质内钙化。其他19 例胸腺上皮性肿瘤的钙化可以位于包膜或分隔,也可以位于实质内。但钙化部位的意义还需要大样本进一步证实。
胸腺上皮性肿瘤可出现囊变及坏死[3],一般出现在B 型胸腺瘤及胸腺癌。本研究中,A 及AB 型胸腺瘤少见囊变及坏死,尤其是AB 型胸腺瘤,与B 型胸腺瘤及胸腺癌之间的差异有统计学意义。
3.3.3 侵袭性表现
组织学上,TETs 都有侵袭性,并随着分型的增高,侵袭性逐渐增强,影像上可以出现不同的表现。本研究显示,A 型及AB 型胸腺瘤基本与周围组织间分解清晰,较大肿块周围组织以受压推移为主。B2、B3 型胸腺瘤及胸腺癌无论大小,容易胸膜侵犯,出现“胸膜尾征”,A、AB 型胸腺瘤均无胸膜侵犯。心包侵犯也在B2、B3 型胸腺瘤及胸腺癌中常见,A、AB 型胸腺瘤均无心包侵犯,但B2 型胸腺瘤少见突入心包,多见于B3 型胸腺瘤及胸腺癌。大血管侵犯容易出现在胸腺癌。上述肿瘤侵袭性表现对胸腺上皮性肿瘤分型诊断意义较大。本研究中,B1 型胸腺瘤的特征多种多样,其中1 例出现了心包侵犯并突破心包,2 例出现胸膜侵犯及转移,1 例出现大血管侵犯,是本研究中各型胸腺上皮性肿瘤最复杂的一型,其特征需通过大量样本进行证实。
3.3.4 淋巴结和远处转移
淋巴结和远处转移提示恶性较高,本研究中,A 型胸腺瘤至B3 型胸腺瘤均未见明显淋巴结和远处转移,9 例(90%)胸腺癌见淋巴结转移,3 例(30%)胸腺癌见远处转移,并且胸腺癌淋巴结转移与各组之间有统计学差异。但胸腺癌远处转移与A 型、B2 型及B3 型胸腺瘤之间差异无统计学意义,可能是由于病例太少而造成的偏倚。
综上所述,各型胸腺上皮性肿瘤具有一定的特征,CT 是首选的影像学检查方法。术前行CT 增强扫描对评估胸腺上皮肿瘤亚型的生物学行为、手术前后是否需行辅助治疗及判断疾病预后具有重大意义。

